Pathophysiologie und Pathodiagnostik HIV-assoziierter Nierenerkrankungen
Seit der Entdeckung des HI-Virus in den frühen 1980er- Jahren haben sich die Infektion und ihre Folgekrankheiten als Pandemie global verbreitet. Die HIV-Infektion ist in zunehmendem Ausmaß ein national und international schwerwiegender Problemfaktor mit hoher Morbidität und Mortalität. Derzeit sind zirka 33 Millionen Menschen HIV-infiziert, wobei in der Prävalenz der Bevölkerung starke regionale Unterschiede bestehen. Die am schwersten betroffenen Regionen liegen in Afrika südlich der Sahara und in Entwicklungsländern Asiens. Mit dem Auftreten humaner HIV- Infektionen wurden neben dem typischen Folgesyndrom Aids schon früh andere Organmanifestationen beschrieben, die mit steigender HIV-Prävalenz an Häufigkeit zunehmen und damit neue Herausforderungen an Diagnostik und Therapiestellen. Die Niere wurde schon früh in der Geschichte der HIV-Forschung als ein Ziel der HIV-Schadwirkung erkannt. HIV-assoziierte Nierenerkrankungen stellen neben der Immunsuppression des Aids die bei Weitem häufigste gefährliche Folge der HIV-Infektion dar. Sie beeinflussen die Überlebenswahrscheinlichkeit der Patienten grundlegend. Generell ist die eingeschränkte Nierenfunktion ein unabhängiger prädiktiver Faktor für die Mortalität der HIV-Infektion. Mit der Verfügbarkeit neuer, hocheffizienter antiviraler Medikamente haben sich das Spektrum und der Verlauf dieser Organmanifestation gewandelt. Pathophysiologie und Diagnostik HIV-assoziierter Nierenerkrankungen sind somit ein zunehmendes und wichtiges Thema im Management HIV-positiver Patienten.
Im Rahmen der HIV-Erkrankung können eine Vielzahl von Nierenstörungen auftreten, deren Pathophysiologie und Diagnostik – soweit bekannt – hier im Kurzen beschrieben werden sollen. Um eine in der Praxis brauchbare Klassifikation HIV- assoziierter Nierenerkrankungen zu generieren, soll hier zwischen Nephropathien durch die Schadwirkung des HIV selbst und therapieassoziierten Nierenschädigungen unterschieden werden. Bei den durch HIV selbst ausgelösten Nephropathien ist zwischen Nephropathien mit bewiesenem, kausalem Bezug zur HIV-Erkrankung und einer Vielzahl von bisher nur koinzident beschriebenen Nephropathien zu unterscheiden.
Gesicherte HIV–assoziierte Nierenerkrankungen
HIV-assoziierte Nephropathie (HIVAN)
Die HIVAN wurde bereits 1984 beschrieben und stellt die bei Weitem schwerwiegendste und die am meisten verbreitete HIV-assoziierte Nierenerkrankung dar. HIVAN manifestiert sich durch neu auftretende Proteinurie mit Nierenfunktionseinschränkung und schnellem Fortschreiten zur End-Stage Renal Disease (ESRD). Sie tritt nahezu ausschließlich bei HIV-Patienten schwarzer Hautfarbe und afrikanischer Abstammung auf. Die HIVAN stellt den Großteil der HIV-assoziierten Nierenerkrankungen in der US-amerikanischen und afrikanischen Patientenpopulation und macht die ESRD zur vierthäufigsten Todesursache bei HIV-Patienten dieser Population.
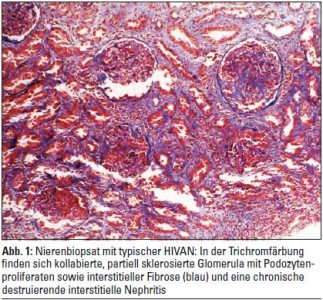
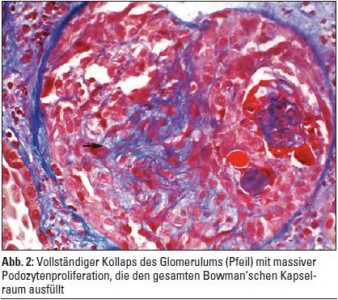
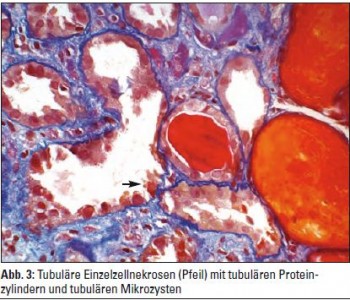
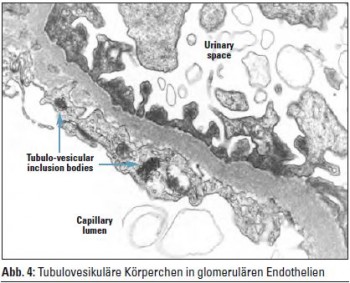
Neue Studien zeigen, dass HIVAN die Folge einer direkten Schadwirkung des HIV an der Niere, konkret an den Podozyten der Glomerula und an den Tubulusepithelien, ist. Die direkte Infektion der renalen Epithelzellen mit HIV-1 kann auf Basis des genetischen Backgrounds von Menschen mit schwarzer Hautfarbe zum Auftreten der HIVAN führen. Die Diagnostik erfolgt mittels Nierenbiopsie. Charakteristisch sind ein massiver glomerulärer Schlingenkollaps, halbmondartige Proliferate im Bowman’schen Kapselraum, interstitielle Fibrose, Tubuluszysten und Tubulusatrophie. Elektronenmikroskopisch lassen sich tubulovesikuläre Einschlusskörper vereinzelt in glomerulären Endothelien und Podozyten nachweisen, die pathologischen Zytoskelettaggregaten entsprechen (Abb. 1–4). Die Pathogenese der HIVAN war lange Zeit rätselhaft, da klassisch HIV-Zelloberflächenrezeptoren (CD4) und Korezeptoren (CXCR4, CCR5) auf renalen Epithelzellen nicht exprimiert werden. HIV benutzt, wie neue Studien zeigten, alternative Rezeptoren (DC-SIGN, Makrophagen-Mannose-Rezeptor (MMR), DEC-205 …) aus der Gruppe der C-Typ-Lektine, Zelloberflächenproteine, die an Karbohydratketten ihrer Liganden binden, um in renale Epithelzellen einzudringen. Cholesterinreiche Endozytoseeinheiten auf der Zelloberfläche, sogenannte Lipid Rafts, spielen in der HIV-Infektion renaler Epithelzellen eine wichtige Rolle. So wurde in Studien die Neuinfektion renaler Epithelzellen unter In-vitro-Cholesterindepletion stark herabgesetzt. Des Weiteren sind nicht alle HIV-1-Subtypen fähig, in renale Epithelzellen einzudringen und sich in ihnen zu replizieren. So wurde gezeigt, dass HIV-1-Isolate aus dem peripheren Blut teilweise nicht in der Lage sind, renale Epithelien zu infizieren. Einmal in die Podozyten eingedrungen, führt HIV-1 zu einem Verlust differenzierter Zellfunktionen mit Verlust differenzierungsassozierter Oberflächenmarker wie Podocalyxin oder Podocin. Die im regulären Zustand nahezu vollständige proliferative Ruhe der Podozyten wird durch Wirkung HIV-1-spezifischer Genprodukte unterbrochen und eine Redifferenzierung in den Ruhezustand wird verhindert, sodass es graduell zum Verlust funktionierender Podozyten kommt. Die übriggebliebenen Podozyten hypertrophieren, die glomeruläre Basalmembran wird freigelegt und sklerosiert segmental, was mit einem Verlust der Nierenfunktion einhergeht. In Studien mit transgener retroviraler Infektion zeigte sich, dass die HIV-Gene Nef und Vpr zentrale Bedeutung in der intrarenalen Schadwirkung von HIV haben. So interagiert Nef mit der Src-Kinase und führt zur Aktivierung des Ras-c-Raf- MAPK1,2-Pathways, der die podozytäre Dedifferenzierung und Proliferation induziert. Über Reduktion der RhoA und Aktivierung von Rac1 leitet Nef weiters den Verlust von Stress Fibers in den podozytären Fußfortsätzen und deren Abflachung ein. Weiters wurde in Experimenten an Mäusen gezeigt, dass das podozytenspezifische Protein Podocin eine Rolle in der HIVAN-Entstehung spielt.
Eines der großen Rätsel der HIVAN, der nahezu exklusive Befall schwarzafrikanischer Patienten, erscheint nach jüngsten Studien weitgehend aufgeklärt. Präliminäre Studien weisen auf die Assoziation eines Genlokus im humanen Genom rund um das MYH9-Gen (nonmuscle myosin heavy chain-9) auf dem Chromosom 22 mit der HIVAN-Entwicklung hin. In weiteren Analysen gelang es, das benachbarte Apolipoprotein-L1-Gen als Promoter einer HIVAN-Entwicklung zu identifizieren. ApoL1 kodiert einen Serumfaktor, der den Krankheitserreger der Schlafkrankheit, Trypanosoma brucei, lysiert. Die Trypanosoma-brucei-Subtypen T. b. gambiense und T. b. rhodesiense entwickelten evolutionär einen ApoL1-Inhibitor, der eine Infektion erlaubt. In Schwarzafrika traten daraufhin Mutationen des ApoL1-Gens auf (G1, G2), die eine Resistenz gegen T. b. rhodesiense mediieren und somit einen evolutionären Vorteil darstellen. Dies sind nun jene ApoL1-Varianten, die bei HIV-Infektion das Auftreten einer HIVAN begünstigen. Interessanterweise gehen beide ApoL1-Varianten bei Schwarzafrikanern auch mit erhöhten Raten an fokal-segmen- taler Glomerulosklerose und hypertensiver ESRD einher.
HIV-assoziierte Immunkomplexglomerulonephritiden
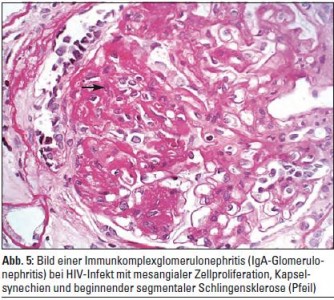
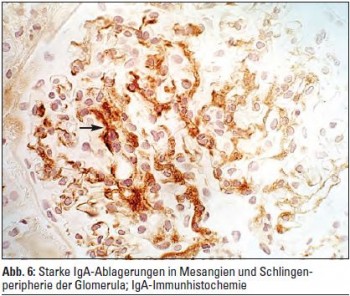
Bei nicht schwarzafrikanischen Patienten ist die vorherrschende HIV-assoziierte Nierenerkrankung die Immunkomplexglomerulonephritis. Sie kann in jeder ihrer Manifestationsformen auf- treten. Besonders häufig werden IgA-Glomerulonephritiden, membranöse Glomerulonephritiden und membranoproliferative Glomerulonephritiden diagnostiziert. Leitendes klinisches Erscheinungsbild ist die Proteinurie optional in Verbindung mit Mikrohämaturie und/oder einem aktiven Harnsediment. Die Prävalenz von Proteinurie bei kaukasischen HIV-Patienten wird zwischen 5,6% und 32% recht divergent angegeben und liegt somit über jener der HIV-negativen Bevölkerung. Auch bei HIV-positiven Patienten schwarzafrikanischen Ursprungs ist die Immunkomplexglomerulonephritis weit verbreitet. Die verschiedenen Typen der Glomerulonephritis bei HIV-infizierten und nicht HIV-infizierten Patienten unterscheiden sich histologisch nicht (Abb. 5, 6). Häufige Koinfektionen mit Hepatitis B und Hepatitis C erhöhen die Wahrscheinlichkeit für die Entwicklung einer Immunkomplexglomerulonephritis weiter und verschlechtern das therapeutische Ansprechen und die Prognose. Die Ursache der erhöhten Inzidenz von Glomerulonephritiden unter HIV ist nicht restlos geklärt. Die Heterogenität der HIV-assoziierten Immunkomplexglomerulonephritiden erschwert die Suche nach einer Kausalkette. In erster Linie dürfte es sich um eine generelle Aktivierung des humanen Immunsystems un- mittelbar nach der HIV-Infektion und um einen proinflammatorischen Zustand während der HIV-Infektion handeln, der letztlich ohne Behandlung im Kollaps des Immunsystems im Aids seinen Höhepunkt findet. So findet sich bei HIV-Patienten ein erhöhter Spiegel zirkulierender Immunkomplexe, eine Komplementaktivierung und das vermehrte Auftreten autoimmuner Antikörper in Verbindung mit einer Aktivierung des angeborenen und des adaptiven Immunsystems. Insbesondere werden unter HIV starke Aktivierungen des proinflammatorischen Transkriptionsfaktors NF-kappaB beobachtet. Es entsteht dadurch ein Immunstatus, der entfernt dem des Lupus erythematosus ähnelt, und der die Entwicklung autoimmuner Pathologien insbesondere in der Niere fördert. So werden neben Glomerulonephritiden auch vermehrt autoimmune interstitielle Nephritiden beobachtet, die über progressive interstitielle Fibrose und Tubulusatrophie die Entwicklung einer ESRD beschleunigen.
HIV-assoziierte thrombotische Mikroangiopathie
Die HIV-assoziierte akute thrombotische Mikroangiopathie (TMA) wurde vor allem in den Prä-HAART-Zeiten bei Patienten mit bereits manifestem Aids beobachtet. Hierbei dürfte es sich um eine direkte Schadwirkung des HIV-1 auf Endothelien handeln, die klinisch den Manifestationsformen der TMA bei HIV-negativen Patienten entspricht. Histopathologisch erkennt man in der Nierenbiopsie multiple, überwiegend glomeruläre Kapillaren, welche von Fibrinthromben verschlossen sind und starke Zeichen einer Endothelzelldystrophie zeigen.
Pathogenetisch wurde eine Induktion des prokoagulatorischen Tissue Factors in arteriolären glatten Muskelzellen durch das HIV-Oberflächenprotein gp120 beobachtet, das so die intravasale Gerinnung initiieren kann. Weiters wurde eine Reduktion der Spiegel des Von-Willebrand-Faktor-Cleaving-Proteaseinhibitors bei HIV-positiven Patienten gemessen. Der weitverbreitete Einsatz der HAART ließ die Inzidenz der HIV-assoziierten TMA stark zurückgehen, sie stellt jedoch in nicht therapierten Populationen eine gefährliche Ursache der ESRD dar.
Nierenerkrankungen mit vermuteter Assoziation mit HIV
Eine Vielzahl von Berichten lässt einen Kausalzusammenhang einer HIV-Infektion mit einer Reihe unterschiedlicher Nierenerkrankungen vermuten, darunter Amyloidosen, fibrilläre Glomerulonephritis, immunotaktoide Glomerulonephritis und Formen der interstitiellen Nephritis. Allen ist gemein, dass eine HIV-Wirkung pathogenetisch noch unklar ist. Diagnostisch unterscheiden sie sich nicht von den Analoga in der HIV-negativen Population.
Renale Nebenwirkungen der HIV–Therapie
Der weitverbreitete Einsatz hocheffektiver antiretroviraler Therapien (HAART) hat seit der Mitte der 1990er-Jahre zu einer deutlichen Verbesserung der Überlebensraten HIV-positiver Patienten geführt. Die Inzidenz des Aids als Endstufe der HIV-Erkrankung ist rückläufig. Somit ist eine immer größer werdende Anzahl HIV-positiver Patienten der chronischen Ein- nahme potenziell nephrotoxischer Substanzen im Rahmen der HAART ausgesetzt. In diesem Überblick ist es nur möglich, kursorisch einen Einblick in potenziell nephrotoxische Nebenwirkungen einzelner Substanzgruppen zu geben. Weiterentwicklung der Therapien und neue Studien lassen hier noch großen Raum für neue Erkenntnisse, die in die Therapieregimes einzubeziehen sind.
Renale Nebenwirkungen der Nukleosid/Nukleotid- Reverse-Transkriptase-Inhibitoren (NRTI)
Tenofovir kann zu akutem Nierenversagen, nephrogenem Diabetes insipidus und Fanconi-Syndrom führen. NRTIs werden renal sezerniert und über den humanen organischen Anionentransporter in proximale Tubulusepithelien wieder aufgenommen. Eine Akkumulation der NRTI in den Epithelzellen führt zu lokaler Toxizität und reversibler Funktionseinschränkung. Histomorphologisch ist eine unspezifisch imponierende Tubulusschädigung zu erkennen, die nur in Zusammenschau mit der klinischen Anamnese zur korrekten Diagnose führen kann. Der Verlauf ist nach Absetzen bzw. Reduktion der Substanz reversibel.
Renale Nebenwirkungen der Proteaseinhibitoren
Indinavir ist der Vertreter mit dem größten nephrotoxischen Potenzial dieser Substanzgruppe. Es fand sich Kristallurie mit Ausbildung von Steinen in Niere und ableitenden Harnwegen. Die Substanz wird partiell tubulär sezerniert und ist bei saurem pH schlecht löslich. Kristallbildung wird hier durch Dehydratation gefördert, was ein gezieltes Flüssigkeitsmanagement indiziert.
Referenzen
1 Kaufman L et al., Adv Chronic Kidney Dis 2010; 17(1):36-43
2 Papeta N et al., J Mol Med (Berl) 2011; 89(5):429-36
3 Medapalli RK et al., Curr Opin Nephrol Hypertens 2011; 3:306-11
4 Rachakonda AK et al., Adv Chronic Kidney Dis 2010; 17(1):83-93
5 Jao J et al., Adv Chronic Kidney Dis 2010; 17(1):72-82
6 Bruggeman LA et al., Nat Rev Nephrol 2009; 5(10):574-81
7 Mikulak J et al., Nephron Exp Nephrol 2010; 115(2):e15-21
NEPHRO Spot
Die HIV-Infektion wird immer mehr auch zur Aufgabe für die nephrologische Diagnostik und Therapie. Der unter HAART vollzogene Übergang von der HIV-Infektion bzw. Aids zu einer chronischen Erkrankung rückt die Niere in den Fokus jener Faktoren, die Überlebensdauer und -qualität der Infizierten bestimmen. Eine schnelle und präzise diagnostische Abklärung erfordert eine Zusammenarbeit zwischen Klinikern und den diagnostischen Disziplinen, um das optimale Outcome für den Patienten zu erreichen.