Vitamin-K-Antagonisten bei Patienten mit Vorhofflimmern und chronischer Nierenerkrankung
Mehr als 2,3 Millionen Amerikaner haben gegenwärtig Vorhofflimmern. Diese Zahl wird sich bis zum Jahr 2050 auf etwa 5,6 Millionen erhöhen. Vorhofflimmern ist der wesentlichste Risikofaktor für einen ischämischen Insult und ein unabhängiger Risikofaktor für die Mortalität. Mit Abnahme der Nierenfunktion nimmt das Risiko für Vorhofflimmern zu. Da mehr als 26 Millionen Amerikaner keine normale Nierenfunktion haben, lässt sich aus dieser Konstellation ein großes Gefährdungspotenzial sowohl hinsichtlich kardiovaskulärer Risikofaktoren als auch hinsichtlich Vorhofflimmerns für diese Patientenpopulation herleiten.
Häufigkeit des Vorhofflimmerns bei Niereninsuffizienz
Bei 3.267 Patienten (mittleres Alter 58,55 Jahre) mit chronischer Nierenerkrankung (mittlere GFR 43,6 + 13,0ml/min/1,73 m2) lag die Prävalenz des Vorhofflimmerns bei 18%, bei den über 70-jährigen Patienten dieser Studie bei über 25%. Für die Allgemeinbevölkerung bekannte Risikofaktoren, wie Rasse, Hypertonie, Diabetes, Body Mass Index, Umfang der körperlichen Aktivität, Bildungsstand, C-reaktives Protein, Cholesterin oder Alkoholkonsum, hatten keinen Einfluss auf die Manifestation des Vorhofflimmerns bei Patienten mit chronischer Niereninsuffizienz.
Cerebrovaskuläre Komplikationen sind in der Dialysepopulation häufig. In den 1990er Jahren wurde bei Dialysepatienten über mehr cerebrale Blutungen als cerebrale Ischämien berichtet. In zwei japanischen Dialysezentren waren beispielsweise cerebrale Blutungen 1,7-fach bzw. 2,3-fach häufiger als cerebrale Ischämien. Dagegen wurden in Studien der letzten Jahre cerebrale Ischämien häufiger registriert als cerebrale Blutungen, dies möglicherweise aufgrund einer verbesserten Blutdruckeinstellung und einer erhöhten Komorbidität mit Zunahme von Vorhofflimmern bei zunehmender Überalterung der Dialysepopulation. Vorhofflimmern ist eine häufige Komplikation vor allem bei chronischen Hämodialysepatienten und ursächlich verantwortlich für cerebrovaskuläre Komplikationen in dieser Population.
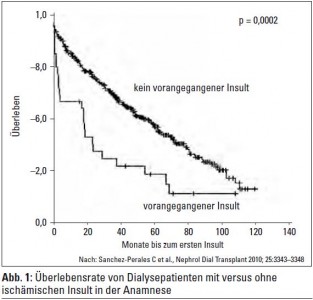
Vorhofflimmern bei Hämodialysepatienten: Bei 30 von 449 inzidenten Hämodialyse-(HD)-Patienten (6,5%) bestand ein ischämischer Insult in der Anamnese. Höheres Lebensalter, ischämische Herzerkrankung, Vorhofflimmern und ein erniedrigtes Serum-Kalzium waren in dieser Studie Risikofaktoren für cerebrovaskuläre Ischämie, während in anderen Studien – nicht unerwartet – eher erhöhte Kalziumwerte mit Gefäßkomplikationen assoziiert waren. Im Verlauf der Dialysebehandlungen entwickelten 34 Patienten (7,5%) einen oder mehrere ischämische Insulte. 112 der 449 HD-Patienten (22,7%) hatten Vorhofflimmern, 49 Patienten (43,7%) erhielten Coumarine. Die Überlebensrate der 30 HD-Patienten mit initialem ischämischen Insult lag nach 1, 2 und 5 Jahren bei 60%, 39% und 24%, während die Vergleichszahlen der HD-Patienten ohne Vorhofflimmern bei 82%, 72% und 47% lagen (Abb. 1). In der CHOICE-Studie lag das Schlaganfallrisiko bei 11%, wobei allerdings nur Patienten in die Studie aufgenommen wurden, die die ersten 45 Tage nach Einleitung der Dialysebehandlung überlebt hatten. Im Zeitraum von 2,7 Jahren entwickelten 15,8% der Patienten ein oder mehrere cerebrovaskuläre Ereignisse, wobei 76% dieser Gefäßkomp likationen durch Ischämie bedingt waren.
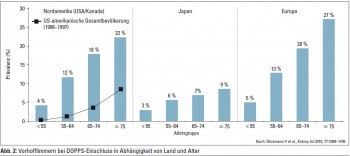
Von 17.513 Patienten der International Dialysis Outcomes and Practice Patterns Study (DOPPS) hatten 2.188 Vorhofflimmern mit deutlicher Variation zwischen den beteiligten Ländern: In Nordamerika (USA und Kanada) bestand bei 4% der 75-jährigen HD-Patienten waren es 22%. Ähnlich waren die Zahlen für HD-Patienten in Europa und Australien/Neuseeland ( 75 Jahre: 27%), während der Anteil in Japan geringer war ( 75 Jahre: 9%) (Abb. 2). Auch innerhalb Europas variierten die Prävalenzzahlen für Vorhofflimmern bei HD-Patienten beträchtlich (Belgien: 24,7%; Frankreich: 18,3%; Deutschland: 16%; Italien: 11,3%; Vergleich Japan: 5,6%). Bei den > 75-jährigen HD-Patienten mit Vorhofflimmern war die Therapie mit Warfarin ein signifikanter Risikofaktor für die Entwicklung eines Schlaganfalls, dies wohl durch cerebrale Blutungen.
Vorhofflimmern bei Peritonealdialysepatienten: Die Prävalenz von Vorhofflimmern wird bei Peritonealdialyse-(PD)-Patienten mit 7% angegeben. Die Ursachen für diese im Vergleich zu HD-Patienten niedrige Prävalenz sind nicht wirklich klar. PD-Patienten haben vermutlich weniger Begleiterkrankungen. Ein asymptomatisches Vorhofflimmern wird wohl eher bei HD-Patienten entdeckt, die dreimal wöchentlich in der Klinik oder Praxis dialysiert werden, als bei PD-Patienten, die zuhause dialysieren. Die kontinuierlich durchgeführte PD-Behandlung provoziert weniger Volumen- und Elektrolytveränderungen als die intermittierende HD-Behandlung. Die bessere und längere Aufrechterhaltung der Restnierenfunktion führt zu weniger linksventrikulärer Hypertrophie bei PD- als bei HD-Patienten, vor allem während der ersten Behandlungsjahre.
Risikofaktoren für Vorhofflimmern bei Niereninsuffizienz
Unabhängige Risikofaktoren für Vorhofflimmern bei Patienten mit terminaler Niereninsuffizienz sind
-
Alter
-
koronare Herzerkrankung
-
Dilatation des linken und/oder rechten Vorhofs
-
Dauer der Dialysetherapie
-
schlechte körperliche Verfassung
-
Höhe des prädialytischen systolischen Blutdrucks
-
Art der Dialysebehandlung (mehr Vorhofflimmern bei HD versus PD durch größere Flüssigkeits- und Elektrolytveränderungen, mehr Inflammation und oxidativen Stress)
-
Aktivierung des Renin-Angiotensin-Aldosteron-Systems und des sympathischen Nervensystems.
Coumarine bei Niereninsuffizienz ja oder nein?
Basierend auf der Extrapolation von Richtlinien, die sich aus Studien bei der Allgemeinbevölkerung herleiten, wird eine orale Antikoagulantientherapie auch bei Dialysepatienten mit Vorhofflimmern praktiziert, um Thrombosen und vor allem Schlaganfälle zu verhindern. Ob eine derartige Behandlung für Dialysepatienten mit terminaler Niereninsuffizienz auch von Vorteil ist, wurde niemals anhand von prospektiven kontrollierten Studien überprüft. Bei HD-Patienten ist sowohl das Schlaganfallrisiko als auch das Blutungsrisiko im Vergleich zur Allgemeinbevölkerung um den Faktor 3-10 erhöht. Daher muss im Einzelfall entschieden werden, ob antikoaguliert wird oder nicht. Für eine orale Antikoagulation bei HD-Patienten mit paroxysmalem oder permanentem Vorhofflimmern sprechen:
- Alter > 75 Jahre und Risikofaktoren wie Diabetes, Hypertonie und/oder Herzinsuffizenz
- vorausgegangene TIA oder vorausgegangener Schlaganfall
- bekannter Vorhofthrombus
- CHADS2-Score (Thromboembolierisiko), der den OBRI-Score (Blutungsrisiko) um 2 Punkte übersteigt
- künstliche Herzklappe und Mitralstenose
Gegen eine orale Antikoagulation bei Dialysepatienten mit Vorhofflimmern werden folgende Argumente angeführt:
-
Alter < 65 Jahre ohne Risikofaktoren
-
unkontrollierte Hypertonie
-
präexistente Therapie mit Thrombozytenaggregationshemmer
-
Kalziphylaxie (auch in der Anamnese)
-
lebensbedrohliche Blutung in der Anamnese
-
schwere Malnutrition
-
Non-Compliance
-
häufige Stürze.
Vitamin-K-Antagonisten gehören zu den weltweit am meisten verwendeten Medikamenten. Eine orale Antikoagulantientherapie mit Vitamin-K-Antagonisten hat sich als effektive Therapiemaßnahme in der Primär- und Sekundärprävention venöser und arterieller Gefäßthrombosen erwiesen. Warfarin wird als Vitamin-K-Antagonist hauptsächlich in Nordamerika, Großbritannien und Skandinavien verwendet, während in den übrigen europäischen Ländern Phenprocoumon und Acenocoumarol die Vitamin-K-Antagonisten der ersten Wahl sind. Der antikoagulatorische Effekt basiert auf einer Hemmung der Vitamin-K-Epoxid-Reduktase mit nachfolgender Depletion Vitamin-K-abhängiger Gerinnungsfaktoren in der Leber. Durch die großen inter- und intraindividuellen Schwankungen der Dosis-Wirkungs-Beziehung ist eine regelmäßige Bestimmung der INR-Werte erforderlich, um eine optimale Antikoagulation zu erzielen und Blutungskomplikationen zu vermeiden. Unterschiede in der Dosis-Wirkungsbeziehung beruhen vor allem auf pharmakokinetischen Eigenschaften, genetischen Faktoren und Nahrungs- und Lebensgewohnheiten. Cytochrom-P450-(CYP)-Enzyme sind verantwortlich für die Hydroxylierung von Phenprocoumon und Acenocoumarol und damit für die Inaktivierung dieser Vitamin-K-Antagonisten. Jeder Vitamin-K-Antagonist ist ein Substrat von CYP2C9, wobei Pharmakokinetik und Dosis-Wirkungs-Beziehung der drei Vitamin-K-Antagonisten im Hinblick auf dieses Enzym trotz struktureller chemischer Ähnlichkeit deutlich verschieden sind. Entsprechend beeinflussen CYP2C9-Polymorphismen in unterschiedlicher Weise die Elimination von Warfarin, Phenprocoumaron und Acenocoumarol. Warfarin und Acenocoumarol werden beispielsweise nur in Spuren mit dem Harn und Stuhl in unveränderter Form ausgeschieden, während Phenprocoumon zu 40% auf diesen Wegen eliminiert wird. Entsprechend geringer ist die Bedeutung der Hydroxylierungsschritte und damit der CYP2C9-Polymorphismen für die Elimination von Phenprocoumon.
Wie schon ausgeführt, wirken Coumarine antikoagulatorisch durch Hemmung von VKORC1 (“vitamin K epoxide reductase complex subunit 1”). Durch diese Untereinheit wird physiologischerweise Vitamin-K-Epoxid in Vitamin K übergeführt. Polymorphismen im Promotor des VKORC1-Gens beeinflussen die VKORC1-Genexpression und damit die Coumarindosierung. Im Vergleich zu VKORC1c.-1639GA-Carrier haben AA-Carrier einen um 27,5% niedrigeren Phenprocoumon-Bedarf pro Tag, während GG-Carrier um 44,6% mehr Phenprocoumon pro Tag benötigen. Der Phenprocoumonbedarf ist stark altersabhängig und liegt im Mittel bei 2,14 mg/Tag (Schwankungsbreite 0,75-4,50 mg/Tag pro Patient). Patienten in der 8. und 9. Lebensdekade benötigen durchschnittlich 1,71 mg/Tag (1,50-2,36 mg/Tag) bzw. 1,50 mg/Tag (0,83-2,14 mg/Tag) im Vergleich zu 2,79 mg/Tag (1,82-3,64 mg/Tag) bei den 19- bis 50-Jährigen.
In einer retrospektiven Analyse wurde überprüft, ob eine Therapie mit Warfarin, Clopidogrel oder Aspirin das Überleben von HD-Patienten über einen Zeitraum von fünf Jahren beeinflusst. Von 41.425 inzidenten HD-Patienten hatten in den ersten 90 Tagen allein oder in Kombination erhalten:
-
8,3% Warfarin
-
10,0% Clopidogrel
-
30,4% Aspirin
-
56,3% keine Antikoagulation
In dieser Studie erhöhte Warfarin das Mortalitätsrisiko 1,27-fach, Clopidogrel 1,24-fach und Aspirin 1,06-fach. Viele Fragen blieben in dieser Studie jedoch unbeantwortet: War die Indikation für die Coumarintherapie und/oder Thrombozytenaggregationshemmung nur Vorhofflimmern? Wie sorgfältig wurden die Patienten bezüglich ihrer Antikoagulation überwacht? Sind die einzelnen Gruppen wirklich vergleichbar?
In einer weiteren retrospektiven Analyse bei 1.671 inzidenten HD-Patienten fanden die Autoren eine signifikante Zunahme cerebraler Insulte unter Therapie mit Warfarin (HR 1,93) im Vergleich zu HD-Patienten ohne orale Antikoagulation. Bei Patienten mit Clopidogrel oder Aspirin ließ sich keine Zunahme cerebraler Insulte nachweisen. Besonders war das Insultrisiko – nicht überraschend – bei Patienten mit Warfarin ohne adäquate INR-Kontrolle (HR 2,79). Bei HD-Patienten mit Warfarintherapie waren Mortalität und Hospitalisierungsrate nicht erhöht.
Auch wenn Coumarine ganz überwiegend extrarenal metabo – lisiert werden, spielt die Nierenfunktion für eine optimale Antikoagulation eine wichtige Rolle. Bei 528 Patienten mit verschiedenen Stadien einer chronischen Nierenerkrankung hatten Patienten mit einer GFR < 30 ml/min/1,73 m2 einen geringeren Warfarinbedarf als Patienten mit einer GFR > 30 ml/min/1,73 m2. Bei diesen Patienten waren INR-Werte zwischen 2 und 3 schwieriger zu erreichen, und mehr Patienten hatten INR-Werte > 4 als Patienten mit einer GFR > 30 ml/min/1,73 m2. Einschränkend muss gesagt werden, dass die optimalen INR-Werte für Patienten mit chronischer Nierenerkrankung mit und ohne Dialyse nicht wirklich definiert sind. Die orale Antikoagulation interagiert mit zwei Vitamin-K-abhängigen Proteinen, Matrix-Gla-Protein (MGP) und Growth Arrest Specific Gen (Gas-6), die normalerweise Gefäßverkalkung (MGP) und Apoptose glatter Gefäßmuskelzellen (Gas-6) verhindern. Die Gerinnungsfaktoren II, VII, IX und X werden in der Leber produziert und durch Carboxylierung ihrer Glutaminreste in die biologisch aktiven Formen umgewandelt. Für diesen Prozess ist Vitamin K als Kofaktor notwendig. MGP und Gas-6 werden peripher in der Gefäßwand carboxyliert und aktiviert. Diese Prozesse werden durch Warfarin gehemmt und induzieren (zumindest im Tierexperiment) eine Kalzifizierung von Gefäßen. Die klinische Relevanz dieser Mechanismen ist für Patienten mit chronischer Nierenerkrankung gegenwärtig ebenso unklar wie die Frage, ob diese Patienten eventuell von einer additiven Vitamin-K2-Substitution profitieren. Auch ohne orale Antikoagulantientherapie haben viele Patienten mit chronischer Niereninsuffizienz eine schwere Gefäßsklerose.
Bei 19 Männern < 55 Jahren mit mehr als 10-jähriger Coumarintherapie durch Herzklappenersatz oder rezidivierender Beinvenenthrombose (aber sonst keinem kardiovaskulärem Risikofaktor) fand man ein 8,5-faches Risiko für Femoralarterienverkalkung im Vergleich zu entsprechenden Kontrollpersonen durch Hemmung der Carboxylierung von Matrix-Gla-Protein.
Beseitigung des Vorhofflimmerns durch Katheterablation?
Die Katheterablation ist eine erfolgreiche Therapieoption sowohl bei paroxysmalem als auch permanentem Vorhofflimmern. Trotz mittel- und langfristiger Erfolge dieses Therapieverfahrens ist die Rekurrenz des Vorhofflimmerns nach Ablation ein bedeutsames Problem. Prädiktoren für eine Rekurrenz des Vorhofflimmerns nach Katheterablation sind
-
Volumen des linken Vorhofs
-
persistierendes Vorhofflimmern
-
Inflammation
-
begleitendes metabolisches Syndrom
-
chronische Nierenerkrankung
Bei 87 von 211 Patienten (39%) mit chronischer Nierenerkrankung rekurrierte das Vorhofflimmern innerhalb von 31,9 ± 7,6 Monaten. In der multivariaten Analyse wurden folgende Prädiktoren für die Rekurrenz des Vorhofflimmerns identifiziert:
a. eine chronische Nierenerkrankung, definiert als GFR < 60 ml/min/1,73 m2 (HR 2,089; 95%-CI 1,292-3,378, p < 0,01), und
b. das Volumen des linken Vorhofs (HR 1,009; 95%-CI 1,002-1,017, p < 0,05)
Von den 221 Patienten mit Vorhofflimmern hatten 54 (24,4%) eine GFR 60 ml/min/1,73 m2 (57,4% versus 33,5%, p < 0,01), wobei offenbleibt, ob nur die Niereninsuffizienz oder auch die (vielleicht) höhere Komorbidität zum Vorhofflimmern der Patienten mit chronischer Nierenerkrankung beiträgt.
Alternative Antikoagulation?
Durch die Interaktionen mit verschiedenen Nahrungsmitteln und Medikamenten sowie die bereits diskutierten Nebenwirkungen (z.B. Blutungskomplikationen, Kalzifizierungen) wird seit Jahren nach alternativen antikoagulatorisch effektiven Substanzen gesucht.
Dabigatran ist ein potenter, direkter, kompetitiver Thrombininhibitor mit einer Bioverfügbarkeit von 6,5%. Etwa 80% der Substanz werden über die Nieren ausgeschieden, die Halbwertszeit im Serum liegt bei 12-17 Stunden. Bei 18.113 Patienten mit Vorhofflimmern und erhöhtem Schlaganfallrisiko wurden zwei fixe Dabigatran-Dosierungen (110 mg oder 150 mg 2-mal/Tag) mit Warfarin verglichen. Die Inzidenz von Schlaganfällen oder zentraler Embolie lag in der Warfarin-Gruppe bei 1,69% pro Jahr, bei 1,53% pro Jahr in der Gruppe mit 110 mg Dabigatran 2-mal täglich (RR 0,91; 95%-CI 0,74-1,11) und bei 1,11 % pro Jahr in der Gruppe mit 150 mg Dabigatran 2-mal täglich (RR 0,66; 95%-CI 0,53-0,82). Die jährliche Raten schwerere Blutungskomplikationen lagen bei 3,36% unter Warfarin, bei 2,71% unter 110 mg Dabigatran 2-mal täglich (p = 0,003) und bei 3,11% pro Jahr (p = 0,31) unter 150 mg Dabigatran 2-mal täglich. Die Raten an cerebralen Blutungen lagen in den drei Gruppen bei 0,38%/Jahr, 0,12%/Jahr (p < 0,001) bzw. 0,10%/Jahr (p < 0,001). Die Mortalität betrug 4,13% pro Jahr in der Warfarin-Gruppe, 3,75% pro Jahr unter Dabigatran 110 mg 2-mal täglich (p = 0,13) und 3,64% pro Jahr unter 150 mg Dabigatran 2-mal täglich (p = 0,051). Die Studienautoren schlossen, dass 110 mg Dabigatran 2-mal täglich bei Patienten mit Vorhofflimmern zu einer vergleichbaren Senkung des Risikos für Schlaganfall und systemischer Embolie führt wie Warfarin, dies bei weniger Blutungskomplikationen. Umgekehrt senkt eine Therapie mit 150 mg Dabigatran 2-mal täglich die Raten an Schlaganfall und systemischer Embolie im Vergleich zu Warfarin signifikant, und dies bei vergleichbarem Risiko für Blutungskomplikationen. Nach der Dosis der Wahl bei Patienten mit Vorhofflimmern gefragt, antwortete Prof. Stuart Connolly beim ESC-Kongress 2009, beide Dosierungen hätte Vorteile gegenüber Warfarin: Die 150-mg-Dosierung reduziert signifikant das Schlaganfallrisiko bei gleichem Blutungsrisiko, die 110-mg-Dosierung reduziert signifikant das Blutungsrisiko bei vergleichbarer Reduktion des Schlaganfallrisikos. Hervorgehoben wurde auch, dass bei Dabigatran keine Dosisanpassung und kein Monitoring der Antikoagulation notwendig sei.
Ausgeschlossen von der Studie waren allerdings Patienten mit einer Kreatinin-Clearance < 30 ml/min.
Schlussfolgerungen
Vorhofflimmern ist ein häufiger und signifikanter Risikofaktor für die Morbidität und Mortalität von Patienten mit chronischer Nierenerkrankung, vor allem aber in der HD-Population. Coumarine sind ein Risikofaktor für Blutungskomplikationen und Gefäß- oder Herzklappenverkalkungen durch Hemmung der Carboxylierung von Matrix-Gla-Protein. Daher soll die orale Antikoagluanzientherapie individuell unter Berücksichtigung des CHADS2- und OBRI-Scores erfolgen, z.B. Thrombozytenaggregationshemmer bei CHADS2-Score 1 und 2, Coumarintherapie bei CHADS2-Score 3-6. Um unter oraler Antikoagulantien therapie das Kalzifizierungsrisiko zu minimieren, wird bei Patienten mit chronischer Nierenerkrankung eine strikte Kontrolle von Kalzium, Phosphat und Parathormon empfohlen.