ÖGN 2012: Indikation zur Sondenernährung
Was sagt die Evidenz?
DGN Leitlinien1, Leitlinie „Ernährung in der Geriatrie“2: Eine Malnutrition, die bei 22 bis 35 % der PatientInnen in den ersten beiden Wochen nach Schlaganfall auftritt, stellt einen prädiktiven Faktor für ein schlechtes funktionelles Resultat dar und sollte daher vermieden werden.3, 4 Allerdings verbessert eine routinemäßige Sondenernährung nicht für alle SchlaganfallpatientInnen das Outcome.4
Eine eindeutige Indikation für den Erhalt einer enteralen Ernährungstherapie besteht für PatientInnen, die wegen Aspiration von Nahrung bzw. Flüssigkeit auch nach etwa einer Woche nicht oral ernährt werden können. Daher kommt dem Nachweis einer neurogenen Dysphagie, die zur Aspiration führt, ein hoher Stellenwert im Management neurologischer Erkrankungen zu.
Sowohl die Anlage einer nasogastralen Sonde (NGS) als auch einer perkutanen endoskopischen Gastrostomie (PEG) stellen die Nahrungs- und/oder Flüssigkeitszufuhr sicher, wobei beide Möglichkeiten das Aspirationsrisiko reduzieren, aber nicht vollständig davor schützen.
Wegen der Nachteile einer NGS wie Irritation der Schleimhäute, störender Faktor bei der Schlucktherapie und Verstärkung einer Dysphagie, besteht bei einer längerfristigen enteralen Ernährung die Indikation zur PEGAnlage. Als Faustregel wird hierfür eine Ernährungsdauer von mindestens einem Monat angesehen. Jedoch ist die Abschätzung der voraussichtlichen Ernährungsdauer schwierig, da eindeutige Prädiktoren fehlen. Bei PatientInnen mit amyotropher Lateralsklerose sollte die PEG-Anlage erfolgen, bevor die forcierte Vitalkapazität (fVK) < 50 % beträgt, da sonst die Mortalitäts- und Morbiditätsrate ansteigt.5
In der multizentrischen, randomisierten und kontrollierten FOOD-Studie wurden 321 dysphagische PatientInnen in der akuten Schlaganfallphase einer Ernährung über eine PEG oder eine NGS zugeteilt. In der PEG-Gruppe kam es im Vergleich zur NGS-Gruppe zu einer signifikanten absoluten Risikozunahme von knapp 8 % hinsichtlich des längerfristigen Outcome (Tod oder schwere Behinderung nach 6 Monaten).4
In der Leitlinie „Ernährung in der Geriatrie“ wird festgestellt, dass bei PatientInnen, die aufgrund der Schwere der Grunderkrankungen eine enterale Ernährung über Sonde benötigen, eine Verlängerung der Lebenszeit nicht gesichert ist. Multimorbide, gebrechliche Ältere profitieren von einer enteralen Ernährung über Sonde nur, solange der Allgemeinzustand stabil ist (nicht im Endzustand). Eine Sondenernährung wird daher bei einem Ernährungsrisiko frühzeitig empfohlen.
Bei geriatrischen PatientInnen mit neurologisch bedingten Schluckstörungen wird die frühzeitige enterale Ernährung zur Sicherung der Nahrungsaufnahme und damit zur Aufrechterhaltung bzw. Verbesserung des Ernährungszustandes empfohlen. Ist die Notwendigkeit enteraler Ernährung für einen Zeitraum von länger als 14 Tagen abzusehen, ist die Anlage einer PEG so früh wie möglich vorzunehmen. Der Evidenzlevel für diese Empfehlung ist allerdings vergleichsweise gering. Grundsätzlich sollte begleitend zur konsequenten Schlucktherapie bei SchlaganfallpatientInnen die enterale Ernährung bis zum Erreichen der sicheren und ausreichenden oralen Nahrungsaufnahme durchgeführt werden.2
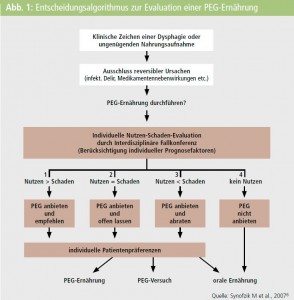
Entscheidungsalgorithmus zur Evaluation ei ner PEG-Ernährung.6 Der Algorithmus (Abb. 1) basiert auf den weithin akzeptierten ethischen Grundprinzipien ärztlichen Handelns. Ärzte und Ärztinnen sollen
- den PatientInnen nutzen (Prinzip des Wohltuns),
- ihnen keinen Schaden zufügen (Prinzip des Nichtschadens),
- ihre Selbstbestimmung fördern und respektieren (Prinzip des Respekts der Autonomie).
Zunächst müssen reversible Ursachen für eine ungenügende Nahrungsaufnahme wie z. B. Infekte, Delir und Medikamentennebenwirkungen ausgeschlossen und gegebenenfalls behandelt werden.
Die immer individuell durchzuführende Nutzen-Schaden-Evaluation sollte im Rahmen einer interdisziplinären Fallkonferenz erfolgen. Diese sollte sich aus einem/einer MitarbeiterIn des ärztlichen Behandlungsteams, dem Pflegepersonal, einem (Schluck-)Therapeuten/einer (Schluck-)Therapeutin, einem Diätologen/einer Diätologin und – wenn möglich – dem Patienten/der Patientin selbst bzw. seinen/ihren Angehörigen zusammensetzen. Konkret lassen sich für die einzelnen Szenarien folgende Beispiele anführen:
- Szenario 1: Der Nutzen ist größer als der Schaden: PEG-Ernährung an bie ten und empfehlen. Beispiel: akuter/akute SchlaganfallpatientIn mit ausgeprägter neurogener Dysphagie und hohem Aspirationsrisiko, wobei aufgrund der Läsionslokalisation und -ausdehnung mit einer guten funktionellen Prognose zu rechnen ist.
- Szenario 2: Der Nutzen entspricht dem Schaden und
- Szenario 3: Der Schaden überwiegt den Nutzen. In der klinischen Praxis sind diese beiden Szenarien nicht immer scharf zu trennen. In beiden Fällen wird der/die PatientIn bzw. eher die Ange hörigen über die Möglichkeit einer PEG informiert und aufgeklärt. Allerdings wird betont, dass diese Maßnahme das funktionelle Outcome des/der PatientIn mit hoher Wahrscheinlichkeit nicht verbessert, demgegenüber die Lebensqualität massiv reduziert bleibt und die Gefahr von Komplikationen (Aspirationspneumonie, Schmerzen, Dekubiti) hoch ist. In diesen Fällen bekommt die Ermittlung des mutmaßlichen PatientInnenwillens eine große Bedeutung. Soweit möglich sollte dieser in den Entscheidungsprozess nach Aufklärung mit einbezogen werden. Sollte dies – wie in den meisten Fällen zu befürchten – nicht möglich sein, gilt es zu eruieren, ob der/ die PatientIn zuvor zu diesem Problemfeld schriftliche oder mündliche Äußerungen getätigt hat. Beispiele für die Szenarien 2 und 3 sind PatientInnen im „persistent vegetative state“ oder mit schweren Hirnblutungen im fortgeschrittenen Lebensalter bei Multimorbidität.
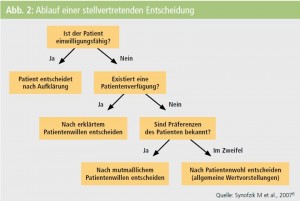
- Szenario 4: Kein Nutzen – PEG-Ernährung wird nicht angeboten. Dies gilt zum Beispiel für PatientInnen mit fortgeschrittener Demenz. Die Anlage einer PEG bringt in diesem Fall keinen Nutzen für das Überleben, die Lebensqualität oder die Vermeidung von Komplikationen.6 Wie schon betont, wird in der Neurologie häufig (besonders relevant für die Szenarien 2 und 3) eine stellvertretende Entscheidung für den/die PatientenIn (Abb. 2) unumgänglich sein.6
Fallbericht
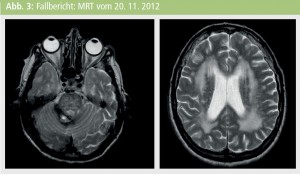
86 a, weibliche Patientin, akute intrazerebrale Blutung Kleinhirnstil rechts am 4. 11. 2011, Leukenzephalopathie (Abb. 3a und 3b). Nebendiagnosen: Herzinsuffizienz mit Pleuraergüssen bds., bradykarde FA, St. p. Mamma-Ca., neurogene Dysphagie und massives Erbrechen bei jeder oralen Nahrungsaufnahme und Mobilisierungsversuchen.
Aufnahme am 14. 11. zur neurologischen Akutnachbehandlung, Barthel-Index: 5 Punkte, Gewicht: 67 kg, gehunfähig, kein freier Sitz möglich.
Zunächst Gabe von Weichkost und nektarartig eingedickten Flüssigkeiten unter Aufsicht, zusätzlich parenteral Flüssigkeit. Medikation: Ondansetron, Domperidon, Dexamethason, Haloperidol gegen das Erbrechen, das weitgehend therapierefraktär bleibt. Der Allgemeinzustand bleibt sehr schlecht, die Patientin ist müde und kaum belastbar. In der interdisziplinären Fallkonferenz wird keine Indikation für eine PEG gesehen. Es wurde aufgrund des Erbrechens ein hohes Aspirationsrisiko angenommen.
22. 11. 2011: Gewicht 61,5 kg, Anlage eines zentralen Venenkatheters und Beginn einer bilanzierten parenteralen Ernährung.
29. 12. 2011: Gewicht 56 kg, Patientin aber wacher, Erbrechen gebessert, aber noch nicht vollständig verschwunden, die Patientin ist zunehmend therapiefähig. Es wurde nun entschieden, eine PEG zu setzen.
Im weiteren Verlauf zunehmende Besserung: Gewicht bei Entlassung: 57,5 kg, Patientin isst wieder selbst, Barthel-Index 35 Punkte, Patientin geht vor der Entlassung mit Rollmobil und Begleitung auf der Station.
Dysphagie-Screening
Für die Indikation zur Sondenernährung ist der Nachweis einer neurogenen Dysphagie mit hohem Aspirationsrisiko wesentlich. Die Bedeutung des Dysphagie-Screenings liegt in der Tatsache, dass die Aspirationshäufigkeit innerhalb von 5 Tagen nach Auftreten eines Schlaganfalls zwischen 19,5 und 42 % liegt und die Aspirationspneumonie als gefürchtete Komplikation mit einem deutlich schlechteren Outcome nach Schlaganfall assoziiert ist.7–9
Demgegenüber reduziert allein die systematische Evaluation des Schluckaktes das Pneumonierisiko.10
Ein erhöhtes Dysphagierisiko besteht in Abhängigkeit vom Schweregrad bei neurodegenerativen Erkrankungen (u. a. Parkinson-Syndrom, Multisystematrophien, Demenz vom Alzheimer-Typ), neuromuskulären Erkrankungen (u. a. amyotrophe Lateralsklerose, Myasthenie) sowie traumatischen und entzündlichen Erkrankungen (u. a. multiple Sklerose, Enzephalitis).11–14
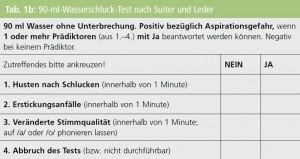
Es wird empfohlen, das Dysphagie-Screening auf der Stroke Unit mit dem Gugginger Swallowing Screen (GUSS) durchzuführen, der in diesem Setting bereits gut untersucht wurde.15 Da dieser Test eines gewissen Aufwands bedarf, wird zum Dysphagie-Screening auf der neurologischen Normalstation bzw. im Rehabilitationsbereich die Anwendung der Daniels-Kriterien in Kombination mit Wasserschlucktests empfohlen.16, 17
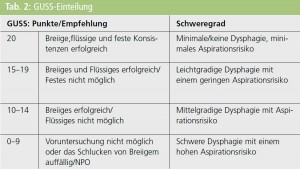
Sollte das Dysphagie-Screening ein erhöhtes Dysphagierisiko ergeben (Tab. 1a und 1b), erfolgt die Zuweisung zur Logopädie mit Durchführung des GUSS möglichst noch am Aufnahmetag, spätestens jedoch am folgenden Tag. Der GUSS bietet den Vorteil der Einteilung in 4 Schweregrade mit einer dem Befund angepassten Ernährungsempfehlung bezüglich der Konsistenz von Nahrung und Flüssigkeiten (Tab. 2).15
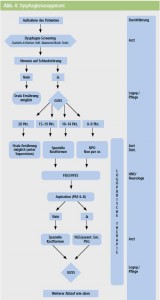
Bei pathologischem Befund im GUSS ist in der Regel eine apparative Abklärung des Schluckaktes indiziert. In etwa gleichwertige Verfahren sind die videoendoskopische Schluckaktuntersuchung (FEES) mit einem flexiblen Laryngoskop und die videofluoroskopische Schluckaktuntersuchung (VFS – Röntgenkinematographie). Welches Verfahren angewendet wird, hängt meist von der Verfügbarkeit ab, wobei sich beide Untersuchungen bei bestimmten Fragestellungen auch ergänzen können. Grundsätzlich kann die videoendoskopische Untersuchung für die Beurteilung des Schluckaktes von NeurologInnen ohne weiteres erlernt werden und ist dann bei entsprechender Ausrüstung ein schnell verfügbares Tool zur sicheren und zuverlässigen Beurteilung des Schluckaktes.18 Die FEES sollte bei hochpathologischem GUSS (< 14 Punkte) so früh wie möglich, jedoch innerhalb von 3 Tagen erfolgen. Den wichtigste Befund im FEES stellt der Nachweis einer Aspiration des verabreichten Bolus (mit Lebensmittelfarbe gefärbt, diverse Konsistenzen) dar. Zur Graduierung hat sich die Penetrations-Aspirations-Skala (PAS) nach Rosenbek bewährt (Tab. 3).19 Der beschriebene Ablauf zum Dysphagiemanagement an neurologischen Abteilungen wird in Abbildung 4 dargestellt.
Resümee
Zusammenfassend lässt sich feststellen, dass eine Indikation zur Sondenernährung bei neurogener Schluckstörung mit hohem Aspirationsrisiko besteht. Diese muss rasch und zuverlässig diagnostiziert werden (Screening, FEES). In der Akutphase, z. B. bei einem Schlaganfall, ist die Anlage einer NGS sinnvoll, bei (voraussichtlich) länger dauernder Dysphagie (> 14 Tage) muss über die Anlage einer PEG entschieden werden. Dies sollte immer eine individuelle Entscheidung im Rahmen einer interdisziplinären Fallkonferenz unter Berücksichtigung der Nutzen-Schaden-Relation und Einbezug des (mutmaßlichen) PatientInnenwillens sein.
1 Leitlinien für Diagnostik und Therapie in der Neurologie. Kommission LL d. DGN (Hrsg.), 4. überarbeitete Auflage 2008:913–917.
2 Volkert D et al., Leitlinie Ernährung in der Geriatrie; Leitlinie Enterale Ernährung. Aktuell Ernähr Med 2004; 29:198–225.
3 Axelsson K, Asplund K, Norberg A, Alafuzoff I, Nutritional status in patients with acute stroke. Acta Med Scand 1988; 224:217–24.
4 Dennis MS, Lewis SC, Warlow C and the FOOD Trial Collaboration. Effect of timing and method of enteral tube feeding for dysphagic stroke patients (FOOD): a multicentre randomised controlled trial. Lancet 2005; 365:764–772.
5 Miller RG, Rosenberg JA, Gelinas DF, Mitsumoto H, Newman D, Sufit R et al., Practice parameter: the care of the patient with amyotrophic lateral sclerosis (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology: ALS Practice Parameters Task Force. Neurology 1999; 52:1311– 1323.
6 Synofzik M, Marckmann G, Ernährung bis zuletzt? Deutsches Ärzteblatt 2007; Jg. 104 Heft 49.
7 Perry L, Love CP, Screening for dysphagia and aspiration in acute stroke: a system review. Dysphagia 2001; 16:7–18.
8 Kidd D, Lawson J, Nesbitt R, MacMahon J, The natural history and clinical consequences of aspiration in acute stroke. Q J Med 1995; 88:409–413.
9 Martino R, Foley N, Bhogal S, Diamant N, Speechley M, Teasell R, Dysphagia after stroke: incidence, diagnosis and pulmonary complications. Stroke 2005; 36:2756–2763.
10 Carnaby G, Hankey GJ, Pizzi J, Behavioural intervention for dysphagia in acute stroke: a randomised trial. Lancet Neurol 2006; 5:31–33.
11 Lo RY et al., 2009; Lo RY, Tanner CM, Albers KB, Leimpeter AD, Fross RD, Bernstein AL, McGuire V, Quesenberry CP, Nelson LM, Van Den Eeden SK, Clinical features in early Parkinson disease and survival. Arch Neurol. 2009; 66(11):1353–8.
12 Giusti A, Giambuzzi M, Management of dysphagia in patients affected by multiple sclerosis: state of the art. Neurol Sci 2008; 29 Suppl 4:S364–6.
13 Kühnlein P, Gdynia HJ, Sperfeld AD, Lindner-Pfleghar B, Ludolph AC, Prosiegel M, Riecker A; Medscape. Diagnosis and treatment of bulbar symptoms in amyotrophic lateral sclerosis. Nat Clin Pract Neurol 2008; 4(7):366–74.
14 Prosiegel M, Schelling A, Wagner-Sonntag E, Dysphagia and Multiple Sclerosis. The International MS Journal 2004; 11:22–31.
15 Trapl M, Enderle P, Nowotny M, Teuschl Y, Matz K, Dachenhausen A, Brainin M, Dysphagia Bedside Screening for Acute-Stroke Patients. The Gugging Swallowing Screen: Stroke 2007; published online Sep 20th.
16 Daniels SK, McAdam CP, Brailey K, Foundas AL, Clinical assessment of swallowing and prediction of dysphagia severitiy. Am J Speech Lang Pathol 1997; 6:17–24.
17 Suiter DM, Leder SB, Clinical Utility of the 3-ounce Water SwallowTest. Dysphagia 2008; 23:244–250.
18 Warnecke T, Teismann I, Oelenberg S, Hamacher C, Ringelstein EB, Schäbitz WR, Dziewas R, The safety of fiberoptic endoscopic evaluation of swallowing in acute stroke patients. Stroke 2009; 40(2):482–6.
19 Rosenbek JC, Robbins JA, Roecker EB, Coyle JL, Wood JL, A penetration-aspiration scale. Dysphagia 1996; 11:93–98.