Schmerzen bei Rückenmarkverletzung
Häufigkeit: Die Prävalenz von Schmerz bei Rückenmarkverletzungen wird in der Literatur unterschiedlich angegeben. In einer Studie von Ehde et al. lag die Prävalenz zwischen 11 und 94 %. 18–63 % der Patienten klagen über sehr starke, inakzeptable Schmerzen.3
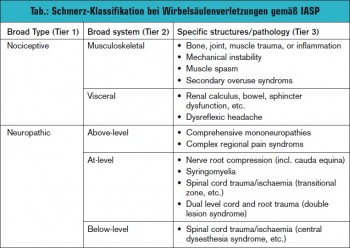
Siddall et al. berichten über das Auftreten verschiedener Arten von Schmerz im Zeitraum von 5 Jahren nach Rückenmarkverletzungen. Der muskuloskelettale Schmerz war mit 59 % der am häufigsten aufgetretene Schmerz, gefolgt von neuropathischem Schmerz im Bereich der Verletzung mit 41 %, unterhalb der Läsion mit 34 % und viszeralem Schmerz mit 5 %. Allodynie war in 14 % der Patienten mit neuropathischem Schmerz im Bereich des Niveaus der Verletzung vorhanden. Neuropathische Schmerzen über dem Niveau der Verletzung treten in geringerer Prozentzahl auf.
Zeitpunkt: Auf der Höhe der Verletzung entwickelt sich der neuropathische Schmerz am frühesten gefolgt von muskuloskelettalem Schmerz.4 Neuropathischer Schmerz unterhalb der Verletzung tritt erst später auf. Der viszerale Schmerz hat das längste Intervall zwischen Auftreten und dem Zeitpunkt der Verletzung. Allodynie ist am frühesten präsent, es kommt aber in den ersten 6 Monaten nach der Verletzung zu einem dramatischen Rückgang.
Im Detail beginnen neuropathischer Schmerz im Bereich der Verletzung und muskuloskelettaler Schmerz bei der Hälfte der Patienten in den ersten Monaten.
Neuropathischer Schmerz unterhalb des Niveaus der Verletzung und der viszerale Schmerz beginnen 2 oder mehrere Jahre nach der Verletzung.
Neuropathischer Schmerz verbunden mit Allodynie wurde häufiger bei Patienten mit inkompletter Rückenmarkläsion beobachtet und war bei zervikalen Rückenmarkverletzungen präsenter als bei thorakalen.
Mechanismus und Pathophysiologie der Schmerzen nach Rückenmarkverletzungen: Die Schmerzen sind von der Art der Läsion, von den neurologischen Strukturen, die verletzt wurden, sowie von den pathophysiologischen Veränderungen des umgebenden Gewebes beeinflusst. Der Schmerz durch Rückenmarkverletzungen kann durch erhöhte neuronale Übererregung, reduzierte Hemmung und neuronale Reorganisation oder Plastizität verursacht werden. Die verstärkte neuronale Übererregung ist eine Konsequenz dramatischer oder ischämischer Rückenmarkverletzungen. Es kommt zu einem dramatischen Ansteigen der exzitatorischen Aminosäuren, welche für sekundäre pathologische Veränderungen verantwortlich sind. Des Weiteren kommt es zu Störungen der aszendierenden und deszendierenden Schmerzsysteme bei Rückenmarkverletzungen, was dazu führt, dass die lokalen inhibitorischen Interneurone unterbrochen sind und es zum Verlust der supraspinalen und propriospinalen hemmenden Bahnen kommt.
Schmerzen assoziiert mit Syringomyelie sind das Resultat der Irritation des Rückenmarks bei Rückenmarkverletzung und haben eine Dynamik mit komplexen neuronalen Aktivitätsmustern auf verschiedenen Niveaus des Nervensystems.
Neben dem somatischen Aspekt des Schmerzes kommen auch die psychosozialen Aspekte des Schmerzes bei Rückenmarkverletzungen zum Tragen. Ein wichtiger Punkt ist die Lebensqualität nach Rückenmarkverletzung, da es oft nicht möglich ist, ohne personelle Unterstützung zu leben. Betroffene können oft nicht mehr am sozialen Leben teilnehmen und verlieren häufig die Arbeitsstelle. Die Behandlung von Patienten mit Rückenmarkverletzungen benötigt einen interdisziplinären Zugang und erfordert, dass der Patient motiviert am vorgeschlagenen Therapiekonzept teilnimmt. Existierende Probleme müssen dargestellt werden, d. h. es gilt die biologischen und psychosozialen Faktoren, die den Schmerz beeinflussen, festzustellen (Feststellen der Risken, Vorhandensein von zusätzlichen Folgen von Schmerzen und Rückenmarkverletzungen wie Medikamentennebenwirkungen, Kontrakturen, Dekubitus). Weitere Maßnahmen sind die Schmerzlinderung, die Reduktion der Spastizitätsfrequenz und -stärke und damit Funktionsverbesserung.
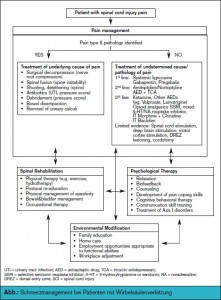
Interdisziplinarität: Den Betroffenen hilft es, mit so wenig Unterstützung wie möglich leben zu können, eventuell wieder eine geeignete Arbeit zu finden und damit wieder in das soziale Leben integriert zu sein. Eine weitere Stufe der Behandlung stellt das interdisziplinäre Schmerzmanagement dar, wie etwa die Behandlung von Harnwegsinfektionen, Instabilität der Wirbelsäule, das Management der Symptome wie Spastizität und Schmerz sowie die Organisation von Reorganisationsprogrammen für den Patienten (z. B. Behandlung einer etwaigen Depression, Implantation von Elektroden, Behandlung einer der Darm- und Blasendysfunktion). Der multidisziplinäre Behandlungsalgorithmus bei Patienten mit Rückenmarkverletzungen ist in > Abb. dargestellt.
Die pharmakologische Behandlung bei neuropathischen Schmerzen entspricht den 2009/2010 publizierten Guidelines. Bei Patienten mit lokalisierten Schmerzen ist das topische Lidocain-Pflaster Therapie der 1. Wahl. Zur Behandlung neuropathischer Schmerzen werden Antikonvulsiva und Antidepressiva eingesetzt (> Abb.).2 Der Muskelspasmus kann mit oralem Baclofen, alternativ mit oralem Diazepam behandelt werden. Reicht orales Baclofen zur Kontrolle der Spastizität nicht aus, kann eine intrathekale Verabreichung mittels programmierbarer Pumpe erfolgen. Bringt die medikamentöse Therapie nicht ausreichend Erfolg, besteht auch die Möglichkeit der Rückenmarkstimulation und der alternativen Hirnstimulation, die aber nur geringe Evidenz hat. Chirurgische Behandlungen sind notwendig bei Instabilität der Wirbelsäule (Stabilisierung bzw. auch chirurgische Dekompression der Nervenwurzeln). Andere chirurgische Behandlungen, einschließlich Chordotomie, Chordektomie, Myelotomie und „Dorsal Root Eentry Zone Lesion“ haben geringe Evidenz. Im Vordergrund stehen die Durchführung von Rehabilitationsprogrammen für die Patienten und die Einleitung psychotherapeutischer Maßnahmen.
1 Siddall P.J., Yezierski R.P., Loeser J.D., International Association for the Study of Pain Newsletter 2000; 3:3-7
2 Que J.C., M.D., Siddall P.J., Cousins M.J., Anesthesia & Analgesia 2007; 105 (5):1462-73
3 Ehde D.M., Jensen M.P., Engel J.M. et al., Clin J Pain 2003:19:3
4 Siddall P.J., Taylor D.A., McClelland J.M. et al., Pain 1999; 81:187-197