Aggressive hämatologische Neoplasien: Image-based ex-vivo drug screening
Die Entwicklung von zielgerichteten Biologika und „small molecule inhibitors“ hat die Prognose aggressiver hämatologischer Neoplasien deutlich verbessert. Das Outcome der rezidivierten Erkrankung ist jedoch weiterhin schlecht. Image-based ex-vivo drug screening kann in diesem Setting in der Therapieentscheidung helfen. Der erfolgreiche Einsatz dieser Methode beruht auf einer engen Zusammenarbeit zwischen klinischen und diagnostischen Fächern und der Grundlagenforschung.
Präzisionsmedizin
Die Prognose von rezidivierten oder refraktären aggressiven hämatologischen Erkrankungen ist nach wie vor schlecht – so beträgt das mittlere Überleben bei rezidivierten aggressiven B-Zell-Lymphomen sechs Monate, bei T-Zell-Lymphomen drei Monate. Angesichts dieser ernüchternden Zahlen liegen große Hoffnungen auf innovativen Zugängen, die großteils dem Bereich der Präzisionsmedizin zugerechnet werden können. Eine möglichst breite molekulargenetische Analyse – mittlerweile immer häufiger durch „next generation sequencing“ (NGS) – soll hier jene genetischen Veränderungen zutage fördern, die für den Erfolg zielgerichteter Therapien prädiktiv sind.
Die erste Studie mit einem personalisierten „molekulargenetisch und histologisch agnostischen“ Zugang (SHIVA-Trial) zeigte keinen Vorteil dieses Zugangs gegenüber dem „physician’s choice“.1 Demgegenüber stehen „molekular agnostische“ Verfahren, die funktionell orientiert sind und das Tumoransprechen auf bestimmte Interventionen direkt anhand des Zelluntergangs evaluieren, wobei hier zwischen In-vivo-Verfahren mit „patient-derived xenografts“ (PDX) in Tiermodellen und In-vitro-Verfahren in der Zellkultur unterschieden werden kann. Der Vorteil des In-vitro-Zugangs ist die Möglichkeit des Hochdurchsatzes, also der parallelen Analyse von zahlreichen antineoplastischen Substanzen, was angesichts der stetig wachsenden Zahl an Therapeutika bedeutsam ist. Die EXALT-Studie basiert auf einem solchen Hochdurchsatz-Screening, einem „image-based ex-vivo drug screen“.2
EXALT-Studie
EXALT (EXtended Analysis for Leukaemia/Lymphoma Treatment) ist eine prospektive Open-Label-Studie, die die Effektivität von funktionellem ex-vivo drug testing im Setting von relapsierten hämatologischen Neoplasien, die bereits zwei oder mehr Therapielinien erhalten haben, beweisen soll. Die Studie erfolgt in Zusammenarbeit mit der Medizinischen Universität Wien und dem Center for Molecular Medicine (CeMM; Giulio Superti-Furga, Stefan Kubicek).
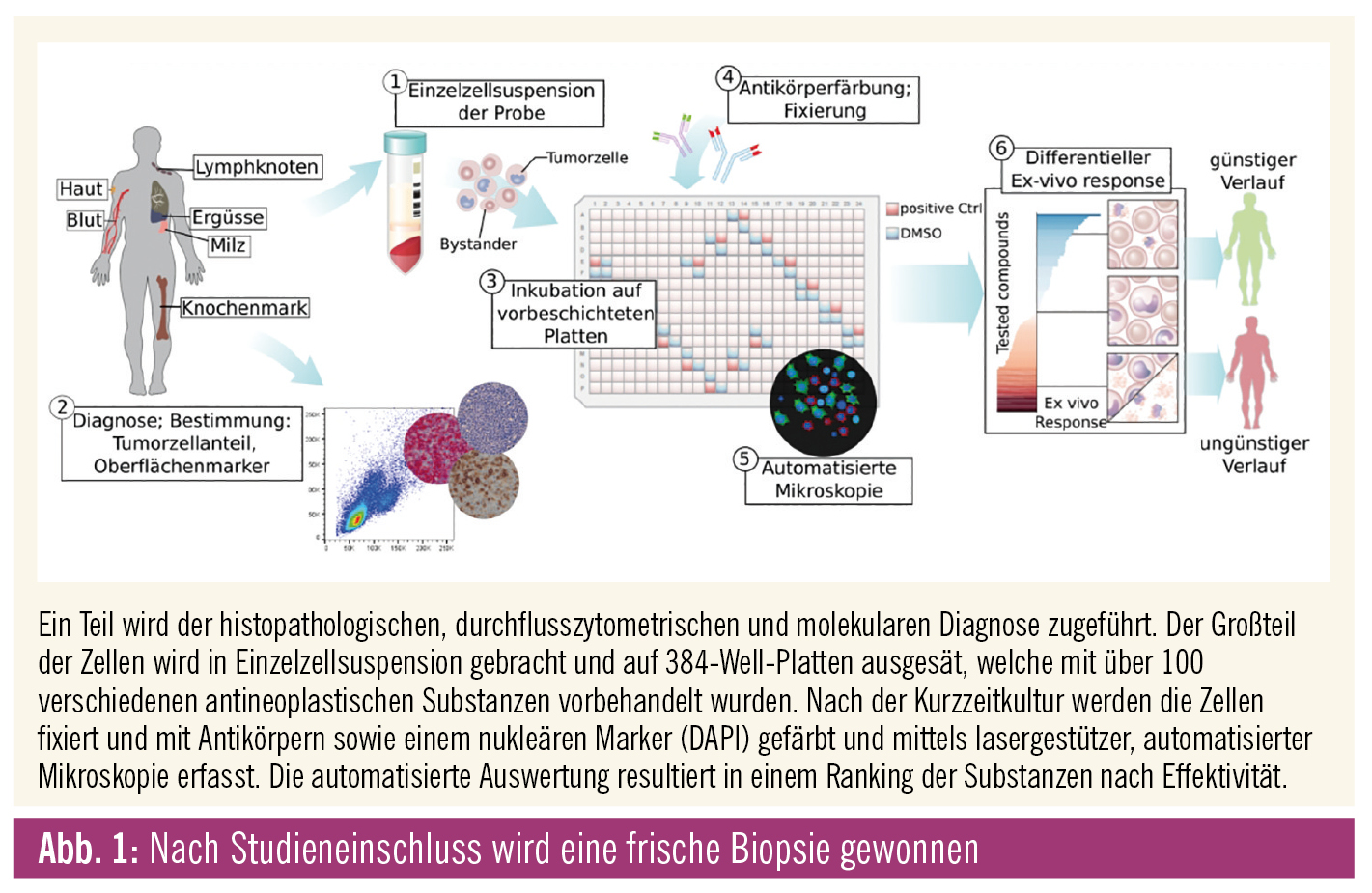
Abbildung 1 zeigt den Ablauf nach Einschluss in die Studie: Zunächst wird frisches Tumormaterial gewonnen – bei Lymphomen durch eine Biopsie, bei leukämischen Erkrankungen durch Blut- oder Knochenmarkentnahme, in seltenen Fällen auch durch Ergusspunktion. Ein Teil des Gewebes wird im Rahmen der Standardaufarbeitung durch Pathologie und/oder Labormedizin zur genauen Charakterisierung der Oberflächenmerkmale durch Immunhistochemie oder FACS-Analysen und zur Bestimmung des Tumorzellanteils herangezogen. Dies stellt die Grundlage für die Interpretation der Ergebnisse aus dem image-based ex-vivo drug screening dar. Eine ausführliche molekulare Diagnostik erlaubt später eine Korrelation von genetischen Veränderungen mit dem ex-vivo Response.
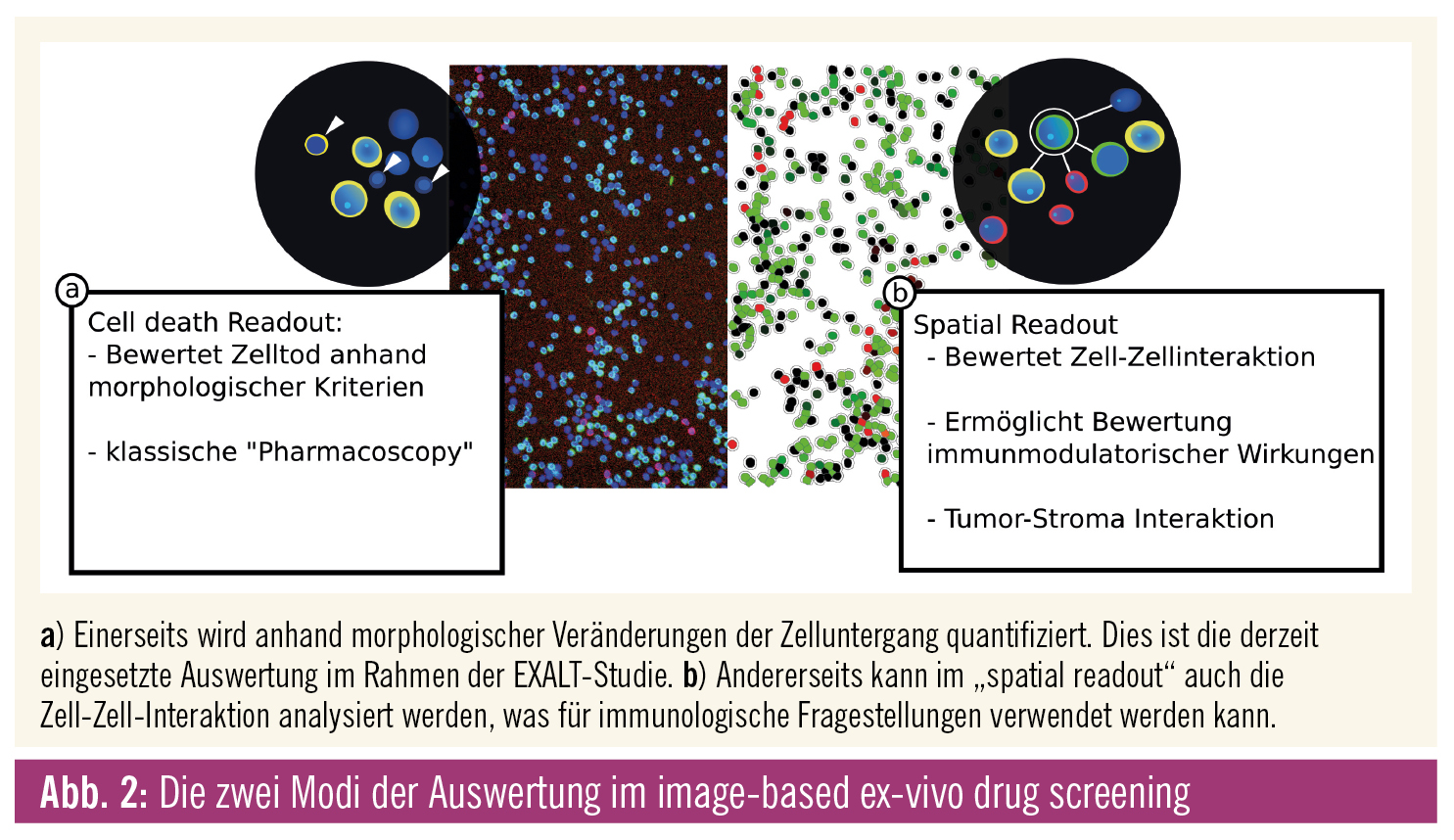
Im Falle von Biopsien erfolgt die Aufteilung der Probe nach makroskopischer Begutachtung durch die Pathologie. Die Probe wird in Einzelzellsuspension gebracht und in Kurzzeitkultur einem Set von über 100 antineoplastischen Substanzen in verschiedenen Konzentrationen ausgesetzt. Die Zellen werden anschließend fixiert und mittels Immunfluoreszenz gefärbt. Der Zelluntergang wird anhand morphologischer Veränderungen der Zellen durch automatisierte, fluoreszenzgestützte Lasermikroskopie evaluiert, wobei dank der Oberflächenmarker zwischen Tumor- und Bystander-Zellen unterschieden werden kann und so die tumorspezifische Wirkung der Substanz bestimmt wird („fractional killing“). Die Ergebnisse dieser als „Pharmacoscopy“ bezeichneten Untersuchung werden im Rahmen eines interdisziplinären Tumorboards bewertet. Die Wirksamkeit dieses Verfahrens konnte in einer bereits publizierten Interimsanalyse gezeigt werden,2 die Endauswertung des EXALT-Trials wird für Ende dieses Jahres erwartet.
Der größte methodische Unterschied zu anderen Drug-Screening-Verfahren, die üblicherweise auf biochemischen Assays des Zelltodes beruhen, liegt in der Bewertung des Zelluntergangs anhand von morphologischen Kriterien. Dies ist eine große Stärke der image-based Screenings, da es neben der Bestimmung des Zelluntergangs auch die Analyse der Zell-Zell-Interaktion, der sogenannten „spatial interaction“ (Abb. 2), erlaubt. So sind auch immunologische Untersuchungen möglich, was Aufschluss über immunmodulatorische Effekte von Substanzen gibt und dadurch neue Erkenntnis zur Wirkungsweise von antineoplastischen Substanzen ermöglicht.3
Ausblick
In Anbetracht der immer wichtiger werdenden Immuntherapien und des steigenden Verständnisses für die Wichtigkeit der Tumor-Stroma-Interaktion ist für das image-based ex-vivo drug screening eine Reihe von Anwendungsmöglichkeiten im Rahmen der Hämatoonkologie denkbar: Zukünftig sollen damit nicht nur der Zelluntergang, sondern auch die Veränderungen der Zell-Zell-Interaktion durch antineoplastische Substanzen in primärem Patientenmaterial bewertet werden. Es ist wahrscheinlich, dass auch Veränderungen in der Interaktion zwischen Tumorzelle und Bystander durch antineoplastische Substanzen in unserer Plattform nachvollziehbar werden und so zusätzliche Informationen über einen potenziellen Behandlungserfolg geben können. Darüber hinaus erlaubt die Flexibilität der Plattform in Bezug auf die immunmorphologischen Färbungen und die verwendeten Substanzen eine tiefer gehende Analyse der Tumor- und Stromazellen sowie der Expression von Signalproteinen. Auch hier wird die histopathologische und durchflusszytometrische Diagnostik eine wichtige Basis zur Weiterentwicklung der Methode darstellen.
Ein weiterer Entwicklungspfad ist die Etablierung von kombinatorischen Screens. Durch Tumorheterogenität und klonale Evolution sind Monotherapien häufig zum Scheitern verurteilt, die Entdeckung von erfolgreichen Kombinationstherapien ist jedoch langwierig. Auch hier bietet das high-content drug screening die Möglichkeit, rasch Erfolg versprechende Kombinationen an primärem Tumorgewebe zu testen und vor allem im Falle von leukämischen Erkrankungen die Veränderung des Therapieansprechens effektiv zu verfolgen. Als „proof of concept“ konnte dies für die seltene, hochaggressive T-Zell-Prolymphozytenleukämie gezeigt werden, wo sich der BCL2-Inhibitor Venetoclax in Kombination mit dem BTK-Inhibitor Ibrutinib als effektiv erwiesen hat.4 Eine entsprechende klinische Studie ist für Ende dieses Jahres geplant (Venetoclax und Ibrutinib in T-PLL: VIT-Studie; Start: Q4 2018).
Da die hier vorgestellte Methode auf viablem Zellmaterial beruht, ist nicht zuletzt der Aufbau entsprechender Register und Biobanken hämatologischer Erkrankungen notwendig; auch hier spielen die diagnostischen Disziplinen Pathologie und Labormedizin eine große Rolle. An der Medizinischen Universität Wien wurde dies bereits im Rahmen der Vivibank (Viennese Viable Biobank for Haematological Diseases) in Angriff genommen.