Funktionelle Bildgebung in der Epileptologie
Epilepsie ist eine der häufigsten neurologischen Erkrankungen mit einer Inzidenz von etwa 40 bis 70 Fällen pro 100.000 Personen pro Jahr1 und einer Prävalenz von 5 bis 10 Fällen pro 1000 Personen2. Die Inzidenz der Epilepsie ist in der Kindheit und bei älteren Menschen höher; sie nimmt im jungen Erwachsenenalter ab1.
Lokalisationsbedingte Anfälle und Epilepsien sind am häufigsten und umfassen 40 % aller Epilepsien. Die Temporallappenepilepsie (TLE), die häufigste Form der lokalisationsbedingten Epilepsien, ist oft mit pharmakoresistenten Anfällen verbunden. Daher werden die PatientInnen mit einer TLE für eine Epilepsiechirurgie in Betracht gezogen, wodurch eine postoperative Anfallsfreiheit von bis zu 80 % erzielt werden kann. Die komplexe präoperative Abklärung von PatientInnen mit medizinisch refraktärer Epilepsie umfasst das funktionelle Neuroimaging-Verfahren wie Positronenemissionstomografie (PET), Single-Photonen-Emissionstomografie (SPECT) und funktionelle Magnetresonanztomografie (fMRT).
PET
Die 18F-Fluoro-D-Desoxyglucose-PET (FDG-PET) ist eine Technik, die eine Injektion einer radioaktiven Substanz erfordert. Jedoch ist es eine äußerst hilfreiche Methode, speziell bei PatientInnen mit einer nichtläsionalen MRT oder in Fällen, in denen der MRT-Befund nicht mit den iktalen elektroklinischen Daten übereinstimmt3. Die FDG-PET trägt auch zur Bestimmung der Funktionsdefizitzone, zur Abgrenzung möglicher anatomischer Grenzen einiger epileptogener Läsionen, wie der fokalen kortikalen Dysplasie (FCD) (Abb. 1), sowie zur Planung einer invasiven EEG-Aufzeichnung bei. Die Rolle der FDG-PET in der prächirurgischen Evaluation von PatientInnen mit pharmakoresistenter Epilepsie ist am besten bei der TLE untersucht4. Bei PatientInnen mit einer pharmakoresistenten TLE wird bei einer FDG-PET in der Regel ein ipsilateraler Hypometabolismus beobachtet. Der hypometabolische Bereich ist möglicherweise größer als die epileptogene Läsion, die bei der MRT nachgewiesen wurde, wobei es sich meist um eine Hippocampussklerose (HS) handelt5. Ein starker FDG-PET-Hypometabolismus kann durch eine FCD, insbesondere von Typ I, verursacht werden, die manchmal mit der HS assoziiert wird. Im Vergleich zu PatientInnen mit einer HS kann die „nichtläsionale“, mesiale TLE jedoch einen noch größeren Hypometabolismus bei einer FDG-PET aufweisen, der über die vorderen und mesialen Bereiche hinausgeht3.
In der Gruppe von MRT-negativen TLE-PatientInnen ist eine FDG-PET die empfindlichste interiktale Bildgebungstechnik zur Identifizierung der fokalen Funktionsdefizite. Ein einseitiger FDG-PET-Hypometabolismus ipsilateral zu iktalem EEG-Muster kann bei über 70 % der PatientInnen mit einer pharmakoresistenten TLE auftreten und steigt mit quantitativer Analyse auf bis zu 90 %3. Die Pathophysiologie des interiktalen FDG-PET-Hypometabolismus ist nicht ganz klar. Es ist unwahrscheinlich, dass der Hypometabolismus in erster Linie mit einem neuronalen Verlust zusammenhängt, da dieser in der Histologie bei PatientInnen mit einer MRT-negativen TLE selten identifiziert werden kann. Das Ausmaß des Hypometabolismus von einer FDG-PET korreliert nicht mit dem Ausmaß des neuronalen Verlustes des Hippocampus, auch bei PatientInnen mit mesialer TLE und Hippocampussklerose6. Die plausibelste Hypothese ist, dass der Hypometabolismus sich aus einer funktionellen Veränderung in den Neuronen als Resultat einer kontinuierlichen iktalen Aktivität speziell bei PatientInnen mit pharmakoresistenten häufigen Anfällen entwickelt. Der FDG-PET Hypometabolismus ist jedoch nicht ein akutes postiktales Phänomen, wie es bei Studien zur Zeit des letzten Anfalls bis zum FDG-PET demonstriert wurde7.
PatientInnen mit einer MRT-negativen und FDG-PET-positiver TLE haben ein ähnliches postoperatives Outcome, inklusive Langzeit-Outcome, wie PatientInnen mit einer MRT-identifizierbaren HS3, 8, 9. Je stärker und klarer der präoperative interiktale FDG-PET-Hypometabolismus, desto besser ist das postoperative Anfallsergebnis. Die Rate der Anfallsfreiheit nach der Operation ist also höher, wenn der präoperative FDG-PET-Hypometabolismus hauptsächlich im anterioren Temporalareal lokalisiert ist10.
Koregistrierung von einer FDG-PET mit einer MRT ist wesentlich für die anatomische Darstellung der Grenzen des Hypometabolismus und dessen Zusammenhang mit einer epileptogenen Läsion. Die Verwendung einer FDG-PET und einer MRT-Koregistrierung im Rahmen von multimodalem Imaging verbessert die nichtinvasive Identifikation und eine erfolgreiche operative Behandlung der FCD (Typ I und II), speziell bei PatientInnen mit widersprechenden prächirurgischen Befunden und fehlenden strukturellen Veränderungen im MRT11, 12. PatientInnen mit einer nichtläsionalen TLE und einem eindeutigen Hypometabolismus in der FDG-PET könnte ein intrakraniales EEG-Monitoring erspart bleiben, speziell wenn die elektroklinischen Manifestationen mit dem FDG-PET-Ergebnis übereinstimmen. Diese PatientInnen gelten als gute KandidatInnen für eine anteriore Temporallappenresektion9. Manche dieser PatientInnen jedoch, insbesondere die mit einer Frontallappenepilepsie (FLE), benötigen ein invasives EEG für die Abgrenzung der Anfallsursprungszone und eloquenter Areale.
Die FDG-PET spielt eine maßgebliche Rolle in der Entwicklung von Hypothesen zur Planung der Implantation der Elektroden in der Phase II der präoperativen Evaluation. In einer relativ großen Gruppe von pharmakoresistenten FLE-PatientInnen (N = 71), die sich einem epilepsiechirurgischen Eingriff unterzogen, lag der positiv vorhergesagte Wert („positive predictive value“, PPV) der FDG-PET für Anfallsfreiheit bei 63,2 %, welches nur von der MRT mit 73,9 % übertroffen wurde und gleichzeitig vergleichbar mit den Werten des interiktalen EEG mit 62,5 % und der iktalen SPECT bei 63,6 % war. Die interiktale FDG-PET war dem iktalen EEG in der Vorhersage des positiven postoperativen Outcomes (56,4 %) überlegen13. Im Allgemeinen ist die hohe Wertschätzung der FDG-PET in der Entscheidungsfindung und der Planung des epilepsiechirurgischen Eingriffes unbestreitbar. In einer retrospektiven Studie mit 110 TLE-PatientInnen, die sich einer FDG-PET und anschließend einer Epilepsiechirurgie unterzogen, führten die FDG-PET-Ergebnisse in 71 % der Fälle zu Änderungen in der Entscheidungsfindung, die zuvor auf MRT und EEG beruhten. Die FDG-PET war am nützlichsten, wenn die MRT unauffällig war oder eine bilaterale Veränderung zeigte, beziehungsweise wenn ein iktales EEG sich mit der MRT und der Anfallssemiologie widersprach. Die positiven und negativen Vorhersagewerte für das MRI- und Video-EEG-Monitoring, die zwischen 48 % und 67 % lagen, stiegen auf 62 % und 86 % bei einer Kombination mit der FDG-PET14.
Andere PET-Liganden als FDG sind limitiert in der prächirurgischen Evaluation von EpilepsiepatientInnen, einige könnten jedoch Lokalisierungspotenzial in spezifischen Fällen haben. 11C-Flumazenil-(FMZ-)PET zeigt eine reduzierte Benzodiazepinrezeptorbindung in der TLE. Die FMZ-PET konnte gelegentlich einen lokalen Hypometabolismus detektieren, welcher nicht bei einer FDG-PET ersichtlich ist15. 18F-FMZ könnte als Alternative dienen, da es aufgrund seiner längeren Halbwertszeit verglichen zu 11C-FMZ ein praktikablerer Ligand ist.
11C-α-Methyl-l-Tryptophan (AMT) wird als hilfreich in der Identifizierung eines „aktiven“ epileptogenen Tuber bei PatientInnen mit einer tuberösen Sklerose angesehen16.
Zusammenfassend ist die FDG-PET eine akkurate Methode zur Lateralisierung und Lokalisierung des epileptogenen Fokus bei Temporallappenepilepsie, speziell bei PatientInnen mit nichtläsionaler oder unklarer MRT oder nichtlokalisierbaren Video-EEG-Monitoring-Ergebnissen. Bei den PatientInnen mit einer MRT-negativen und einer FDG-PET-positiven TLE sollte eine Epilepsiechirurgie in Erwägung gezogen werden. Postoperativer Anfallsoutcome ist bei solchen PatientInnen erfolgreich und vergleichbar mit einer mesialen temporalen Sklerose (ca. 75 % Engel Klasse I). Bei einer TLE mit den konkordanten Ergebnissen der präoperativen Untersuchungen könnte auf das invasive Monitoring verzichtet werden. Bei einer FLE spielt die FDG-PET in der Planung von invasiven intrakranialen EEG-Aufnahmen eine wichtige Rolle.
SPECT
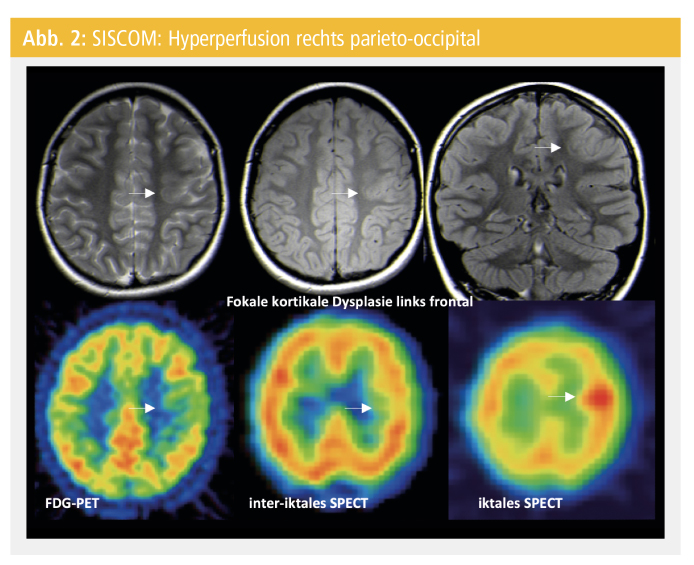
Eine SPECT kann Informationen über zerebrale Blutperfusionsänderungen vor, während und nach einem Anfall liefern. Eine iktale SPECT zeigt eine Hyperperfusion im Anfallsursprung (Abb. 1), welcher von einem Areal der Hypoperfusion umgeben ist, der eine Hemmung oder eine Verschiebung des zerebralen Flusses zum Anfallsherd darstellt. Neben der iktalen SPECT wird eine interiktale SPECT im Rahmen einer präoperativen Evaluation durchgeführt. Zur Identifizierung der Anfallsursprungszone und der Vorhersage eines Anfalls bei einer TLE und einer extra-TLE ist die Subtraktion der interiktalen von der iktalen SPECT und dessen Koregistrierung mit einer strukturellen MRT ein hilfreiches Tool (SISCOM)17 (Abb. 2). Die Injektion des radioaktiven Tracers, zumeist 99mTechnetium, sollte rasch, bevorzugt von einem automatisierten System, nach dem Beginn des Anfalls verabreicht werden. Nach der Injektion benötigt der Tracer 40 Sekunden, um über die Hirn-Blut-Schranke ins Gehirn zu gelangen und konzentriert sich in der Anfallsursprungszone. Für Anfälle, die weniger als 30 Sekunden dauern, ist die iktale SPECT deshalb nicht geeignet. Der Tracer sollte innerhalb von 15 Sekunden nach dem Beginn des Anfalls injiziert werden, da die verspätete Injektion zu einer Darstellung der Anfallsausbreitung anstatt des Ursprungs führt4. Es ist von ausschlaggebender Bedeutung, dass es sich bei der iktalen Tracer-Applikation um einen habituellen Anfall handelt. Wenn die iktale Hyperperfusion in der SPECT mit dem resezierten Areal übereinstimmt, kann bei 63 % der PatientInnen mit einer TLE und bei 58 % der extra-TLE PatientInnen postoperativ mit einer Anfallsfreiheit gerechnet werden4.
Die iktale SPECT ist am nützlichsten bei nichtläsionalen Extra-TLE-PatientInnen, insbesondere wenn eine Implantation von intrakraniellen Elektroden in Phase II der präoperativen Evaluation geplant ist. Die Rolle der SPECT ist jedoch in dieser anspruchsvollen PatientInnengruppe umstritten. Abgesehen von der hohen Rate von 68 % der eindeutigen Lokalisation bei Hyperperfusionen in der iktalen SPECT hat das iktale und interiktale EEG höheren Vorhersagewert über die postoperative Anfallsfreiheit verglichen mit der SPECT bei extra-TLE-PatientInnen mit einer nichtläsionalen MRT18. Bei läsionalen TLE-PatientInnen, im Speziellen bei denen mit einer HS, bestätigt die iktale SPECT die Lokalisation eines Anfallsherds, womit ein invasives EEG vermieden werden kann. Bei TLE-PatientInnen mit einer nichtläsionalen MRT, einem nichtlokalisierendem EEG und einer dualen Pathologie ist die SPECT die nützlichste Methode für die Planung einer Implantation der intrakranialen Elektroden4. Im Allgemeinen sind die FDG-PET und die iktale bzw. interiktale SPECT koregistriert mit strukturellen MRT-Sequenzen (SISCOM) in der Fähigkeit der Lokalisation des Anfallsherdes und der Vorhersage des postoperativen Outcomes vergleichbar4. Multimodale Bildgebung mit inkludierten FDG-PET- und SPECT-Ergebnissen erhöhen die Chance der Detektion einer möglichen epileptogenen Zone bei PatientInnen mit einer TLE und einer extra-TLE19.
Zusammenfassend sollten PET- und SPECT-Ergebnisse im Kontext mit elektroklinischen und MRT-Daten interpretiert werden. Die PET und die SPECT spielen eine unwichtige Rolle in der prächirurgischen Abklärung, wenn eine unilaterale epileptogene Läsion in der MRT mit elektroklinischen Daten konkordant ist.
Bei PatientInnen mit einer nichtläsionalen MRT könnte ein epilepsiechirurgischer Eingriff ohne invasives EEG durchgeführt werden, wenn die PET und die SPECT mit dem elektroklinischen Befund übereinstimmen. Wenn die MRT multifokal und widersprechend mit dem EEG und der klinischen Anfallssemiologie ist, sind die PET und die SPECT am nützlichsten in der Planung der Implantation von intrakranialen Elektroden. Die Chance einer Anfallsfreiheit ist sehr niedrig, wenn die PET und die SPECT bei PatientInnen mit nichtläsionaler oder multifokaler MRT nicht lokalisieren können und die elektroklinische Manifestation nicht übereinstimmt.
Funktionelle MRT
Die funktionelle MRT (fMRT) ermöglicht die nichtinvasive Darstellung der Blutoxygenierung und der Perfusion des menschlichen Gehirns. Das primäre Phänomen der fMRT ist der BOLD-Kontrast (Blood-Oxygenation-Level-Dependent, abhängig vom Blutsauerstoffgehalt). BOLD reflektiert die komplexe Interaktion zwischen Blutfluss, Blutvolumen und der Hämoglobinoxygenierung20. Den funktionellen Kontrast kann man beobachten, weil das Eisen im Hämoglobin im desoxygenierten Zustand paramagnetisch ist20. Dabei kommt es zu einer lokalen Suszeptibilitätserhöhung, die als Signaländerung auf den T2-gewichteten Aufnahmen abgebildet wird. Die typische BOLD-Antwort beinhaltet 0,5–5 % der Änderungen in regionaler Image-Intensität, die innerhalb von 2 bis 8 Sekunden nach der Initiierung der Aufgabe einsetzt, typischerweise mit einem Peak oder Overshoot, einem niedrigeren Plateau und oft einem Undershoot zur Baseline. Diese Peak-Latenz von über mehreren Sekunden ist der größte limitierende Faktor bei der zeitlichen Auflösung der fMRT-Methode.
Präoperatives Mapping der Sprachfunktionen
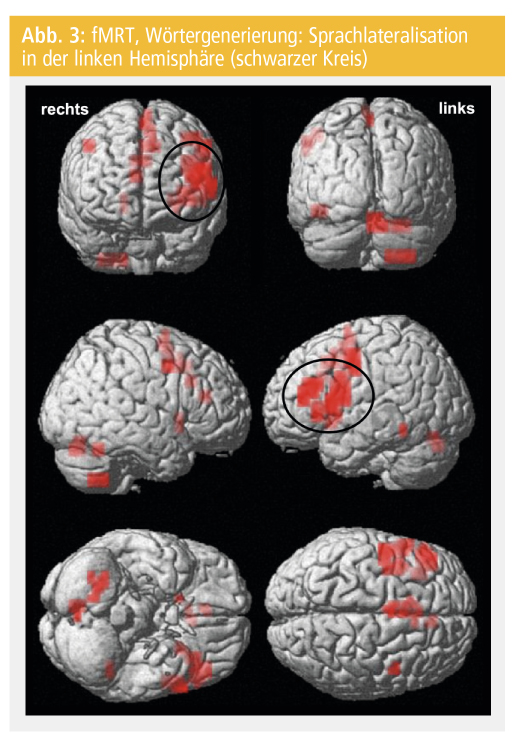
Ziel der präoperativen Sprachlateralisation ist die Minimierung des postoperativen Sprachdefizits, das durch den epilepsiechirurgischen Eingriff verursacht werden kann21. Die häufigsten Paradigmen, welche zur Bestimmung der sprachdominanten Hemisphäre genutzt werden, sind semantische Entscheidungen und Wörtergenerierung (Verben)22 (Abb. 3).
In den fMRT-Studien, in denen die Sprachlateralisation der gesunden RechtshänderInnen und erwachsenen EpilepsiepatientInnen verglichen wurden, wurde eine hohe Inzidenz der atypischen Sprachdominanz (bilateral oder rechts lateralisiert) bei den PatientInnen mit Epilepsien beobachtet. Dies ist ein bekanntes Phänomen bei PatientInnen mit dem Anfallsursprung in der linken Hemisphäre23.
In einer Studie wurde ein strenger Zusammenhang zwischen dem Lateralisationsindex und dem frühem Alter zum Zeitpunkt des Anfallsbeginns mit der Tendenz der Verschiebung (Shifting) der Sprachfunktionen zur rechten Hemisphäre gefunden24. Diese Daten korrelieren gut mit den Ergebnissen des Wada-Tests25.
Voraussage hinsichtlich des Sprach-Outcomes
Die fMRT kann für die Vorhersage von postoperativen Sprachergebnissen nach vorderer Temporallappenresektion in Betracht gezogen werden, jedoch basiert diese Evidenz nur auf zwei wenigen (einer Klasse II und einer Klasse III) Studien26, 27.
In der Klasse-III-Studie mit 24 PatientInnen mit linker TLE, die sich einer vorderen Temporallappenresektion unterzogen haben, konnte eine präoperative fMRT (semantische Entscheidungsaufgabe) das postoperative Sprachdefizit mit einer Sensitivität von 100 % und einer Spezifität von 73 % vorhersagen27.
In der Klasse-II-Studie konnte bei PatientInnen mit linker TLE (N = 24) mit einer starken linksseitig frontalen Aktivierung ein größeres postoperatives Sprachdefizit mit einer Sensitivität von 100 %, 33 % Spezifität und 60 % positivem Vorhersagewert prognostiziert werden26. Nach einer rechtsseitigen vorderen Temporallappenresektion wurde kein signifikanter Rückgang der Sprache beobachtet. Je größer der postoperative shift der fMRT-Aktivierung von links nach rechts war, desto besser war die Sprachperformance nach der Resektion26.
Präoperatives Mapping des medialen Temporallappen-Gedächtnissystems
Der Wada-Test bleibt ein Goldstandard für die präoperative Sprach- und Gedächtnislateralisierung, allerdings ist dieser eine invasive Methode mit einem sehr beschränkten Zeitfenster für die Testung. Die anderen einschränkenden Faktoren sind der Cross-Flow von Barbiturat in die kontralaterale Hemisphäre und auch der Fakt, dass der Hippocampus nicht vom anterioren Versorgungsbereich versorgt wird und somit während der Wada-Testung deafferenziert und nicht direkt anästhesiert wird28.
Aus diesem Grund ist die prächirurgische Untersuchung der Gedächtnisfunktionen von ausschlaggebender Bedeutung.
Bekanntermaßen ist eine verlässliche Aktivierung des Hippocampus schwierig. Die semantischen Sprachparadigmen zeigten die Aktivierung des medialen Temporallappens sowie des Netzwerkes der inferioren präfrontalen, lateralen temporalen, cingulären und zerebellären Areale29. In der überwiegenden Anzahl der PatientInnen mit einer mesialen TLE konnte die Hippocampusaktivierung gezeigt werden. Es konnte ein signifikanter Unterschied in der Hippocampusaktivierung bei PatientInnen mit einer linken und rechten TLE beobachtet werden. Die PatientInnen mit einer rechten TLE zeigten ein erhöhtes Signal im linken Hippocampus im Vergleich zu den linksseitigen TLE-PatientInnen. Im Gegensatz dazu zeigten die PatientInnen mit einer linken TLE keine Signalerhöhung im rechten Hippocampus30. Fehlende fMRT-Aktivierung im Hippocampus beim Gedächtnisparadigma ist auch ein Hinweis für die Lateralisierung der Anfallsursprungszone31; manche Ergebnisse zeigen, dass die postoperative Amnesie mit der präoperativen fMRT-Aktivierung im Resektionsareal korreliert.
In einer Klasse-II-Studie unterzogen sich 54 PatientInnen entweder einer linken (N = 29) oder einer rechten (N = 25) vorderen Temporallappenresektion32. Verbales und visuelles Gedächtnis wurden vor und 4 Monate nach der Resektion untersucht. Eine höhere Aktivierung des linken anterioren Hippocampus versus des rechten im Falle des Word-Encoding-Tasks korreliert mit einem postoperativ stärkeren verbalen Gedächtnisverfall nach einer links anterioren Temporallappenresektion. Eine stärkere linke als rechte posteriore Hippocampusaktivierung war jedoch mit einem besseren postoperativen verbalen Gedächtnisergebnis verbunden. Beim Face-Encoding-Task wurde ein stärkeres visuelles Gedächtnisdefizit bei einer rechten TLE nach einer Resektion des rechten vorderen Temporallappens vorhergesagt. Höhere Aktivierung im rechten posterioren Hippocampus im Vergleich zum linken wurde mit einem besseren postchirurgischen visuellen Gedächtnis assoziiert32.
Zusammenfassend ist die Asymmetrie in der fMRT-Aktivierung für die Kodierung von Wörtern und Gesichtern im ipsilateralen medialen Temporallappen der stärkste Prädiktor für ein postoperatives verbales und visuelles Gedächtnisdefizit.
























































































-bk-wustinger_opt.jpg)


