Erfassen kardiovaskulärer Risikofaktoren und (präventive) Therapie
Die Gesamtmortalität der Patienten mit rheumatoider Arthritis (RA) ging zwar im Lauf der letzten Jahre zurück, ist aber im Vergleich zur Normalbevölkerung immer noch erhöht.1
Kardiovaskuläre Erkrankungen (CVD – Cardiovascular Disease) gelten mit ca. 50 % aller Todesfälle2 als die Hauptursachen. Im Folgenden werden das CVD-Risiko bei Patienten mit rheumatischen Erkrankungen beleuchtet und Interventionsmöglichkeiten dargestellt.
Risiko und Mortalität
Bei Patienten mit einer RA ist wie bei der Psoriasisarthritis (PsA) und der Spondylarthritis (SpA) das CVD-Risiko im Vergleich zu Gesunden um das etwa 1,5-Fache erhöht, und das schon 1 Jahr vor der Diagnose – zum Zeitpunkt der Diagnose besteht oft schon eine subklinische Atherosklerose. Das Risiko für einen tödlichen Myokardinfarkt (MCI) ist um das 1,5- bis 2,4-Fache erhöht. RA-Patienten nach einem MCI nehmen seltener die Medikation zur Sekundärpävention ein; dadurch kommt es im 1. Jahr nach MCI zu einer 30 % höheren Rezidivrate.
Ein weiterer, die Mortalität erhöhender Faktor ist die Entwicklung einer Herzinsuffizienz. Bei RA-Patienten ist das Risiko für eine Herzinsuffizienz ca. doppelt so hoch wie in der Normalbevölkerung, insbesondere eine HFpEF (heart failure with preserved ejection fraction) kommt häufiger vor.3 RA-Patienten mit einer kardialen Insuffizienz versterben daran auch häufiger.4
Als Surrogatparameter für eine CVD konnten eine erhöhte Insulinresistenz, vermehrt Koronarplaques10 sowie eine Zunahme der Intima-Media-Dicke der Carotiden11 und eine endotheliale Dysfunktion nachgewiesen werden.
Risikofaktoren
Chronisch entzündliche Erkrankungen wie die RA führen durch die Inflammation per se, also unabhängig von anderen Risikofaktoren, zu einer vorzeitigen Atherosklerose. In den ESC-Guidelines werden sie deswegen als zusätzlicher Risikofaktor für die Entstehung einer CVD bewertet.8
Eine hohe RA-Aktivität mit gleichzeitig positivem Rheumafaktor ist zum Beispiel nahezu mit dem gleichen CVD-Risiko wie eine Hypercholesterinämie vergesellschaftet.7
Darüber hinaus kommen traditionelle CVD-Risikofaktoren (Rauchen, Hypertension, Adipositas) bei RA-Patienten häufiger vor als in der Normalbevölkerung.6 RA-Patienten würden von einer Lebensstiländerung bzw. einer Behandlung der Risikofaktoren also besonders profitieren.
Umgekehrt können Lebensstiländerungen auch die Grunderkrankung verbessern. So wurde vor kurzem gezeigt, dass Patienten mit einer PsA durch Gewichtsabnahme auch eine Verbesserung der Erkrankungsaktivität erreichen.
Screening/Diagnostik
Die Diagnostik der CVD liegt leider, auch aus Kapazitätsgründen, nicht immer im Blickfeld der Rheumatologen. Daher ist eine interdisziplinäre Betreuung von enormer Bedeutung.
Wichtig für den Rheumatologen ist daher zu wissen, welche Patienten dem Kardiologen zugewiesen werden sollen bzw. womit man gefährdete Patienten frühzeitig erfassen kann. Hierfür stehen diverse Tools zur Verfügung, die aber in der Regel für die Normalbevölkerung und nicht für Rheumatiker validiert sind.
Neben den bekannten Screening-Tools wie dem Framingham- Score, dem SCORE der ESC und dem Score der ACC/AHA gibt es auch solche, bei denen rheumatische Diagnosen miteinbezogen werden. Der QRISK3-2018-Calculator nimmt die Diagnosen RA und SLE in die Berechnung auf, der ERS-RA-Rechner9 rechnet mit einem aktuellen CDAI, HAQ und der Dauer der RA-Erkrankung. Trotzdem werden diese Scores, mangels langjähriger Evaluierung, von der EULAR (noch) nicht empfohlen, sondern es sollen die bei Rheuma-Patienten mit den „klassischen“ Screening-Tools erhobenen Scores mit dem Faktor 1,5 multipliziert werden um dem durch die Erkrankung bedingten erhöhten Risiko Rechnung zu tragen.
Die EULAR empfiehlt, mindestens alle 5 Jahre ein Screening durchzuführen; bei erhöhter KH-Aktivität oder bei einer dadurch notwendigen Änderung der Basistherapie empfiehlt sie dieses Intervall zu verkürzen.
Welches Programm man nun auch immer verwendet, die wichtigste Maßnahme ist, das Screening strukturiert und einheitlich zu etablieren. Ebenso sollte die Wahl von den lokalen Gegebenheiten und Personalressourcen abhängig gemacht werden.
Lipidstoffwechsel
Bei einer RA kommt es zu funktionellen Veränderungen der Lipoproteine, die dadurch atherogener werden. So wird HDL in eine proinflammatorische Form umgewandelt, und es kommt zu einem Anstieg von Lipoprotein (a). Umgekehrt kommt es unter einer DMARD-Therapie zu einer HDL-Umwandlung in eine antiatherogene Form.
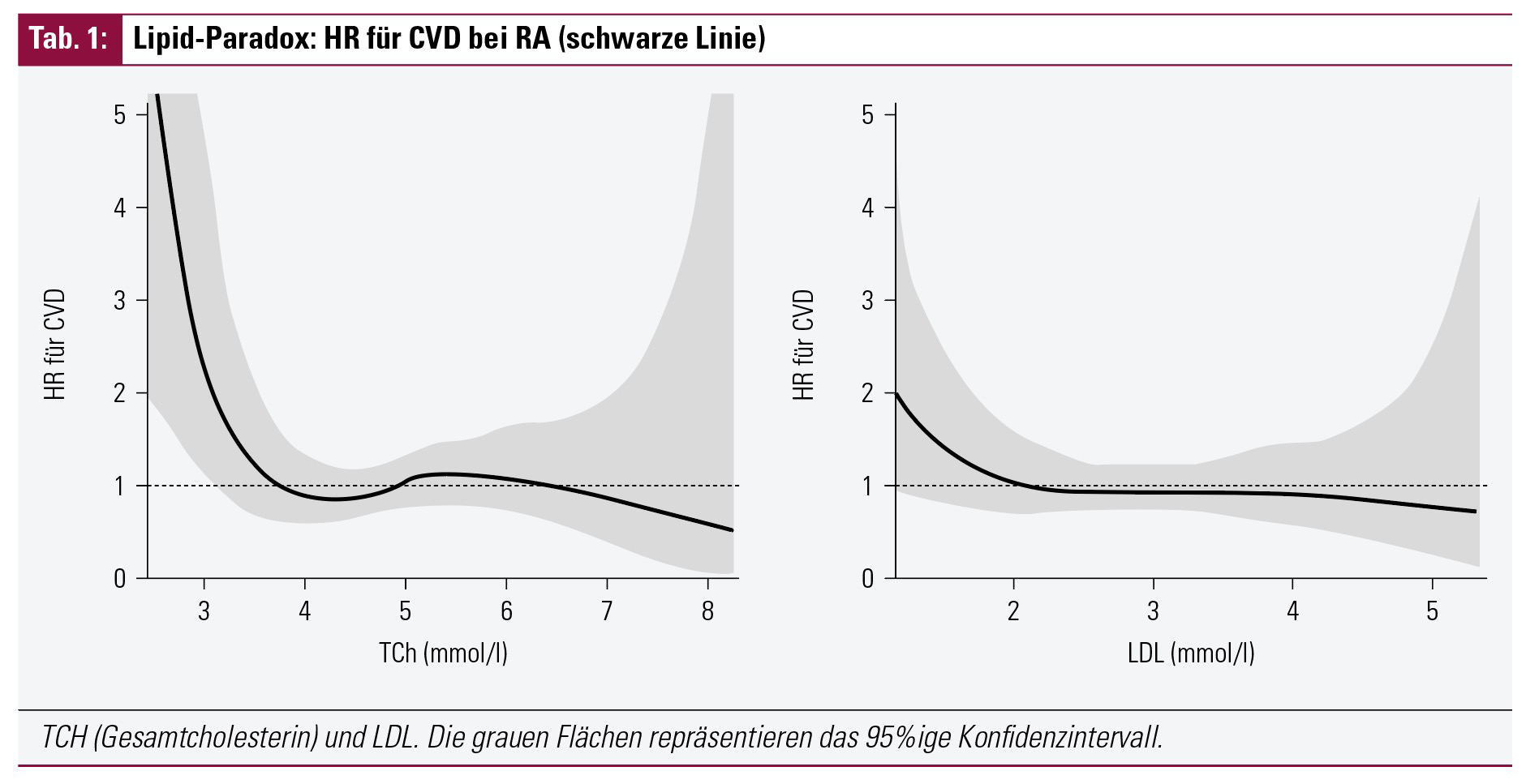
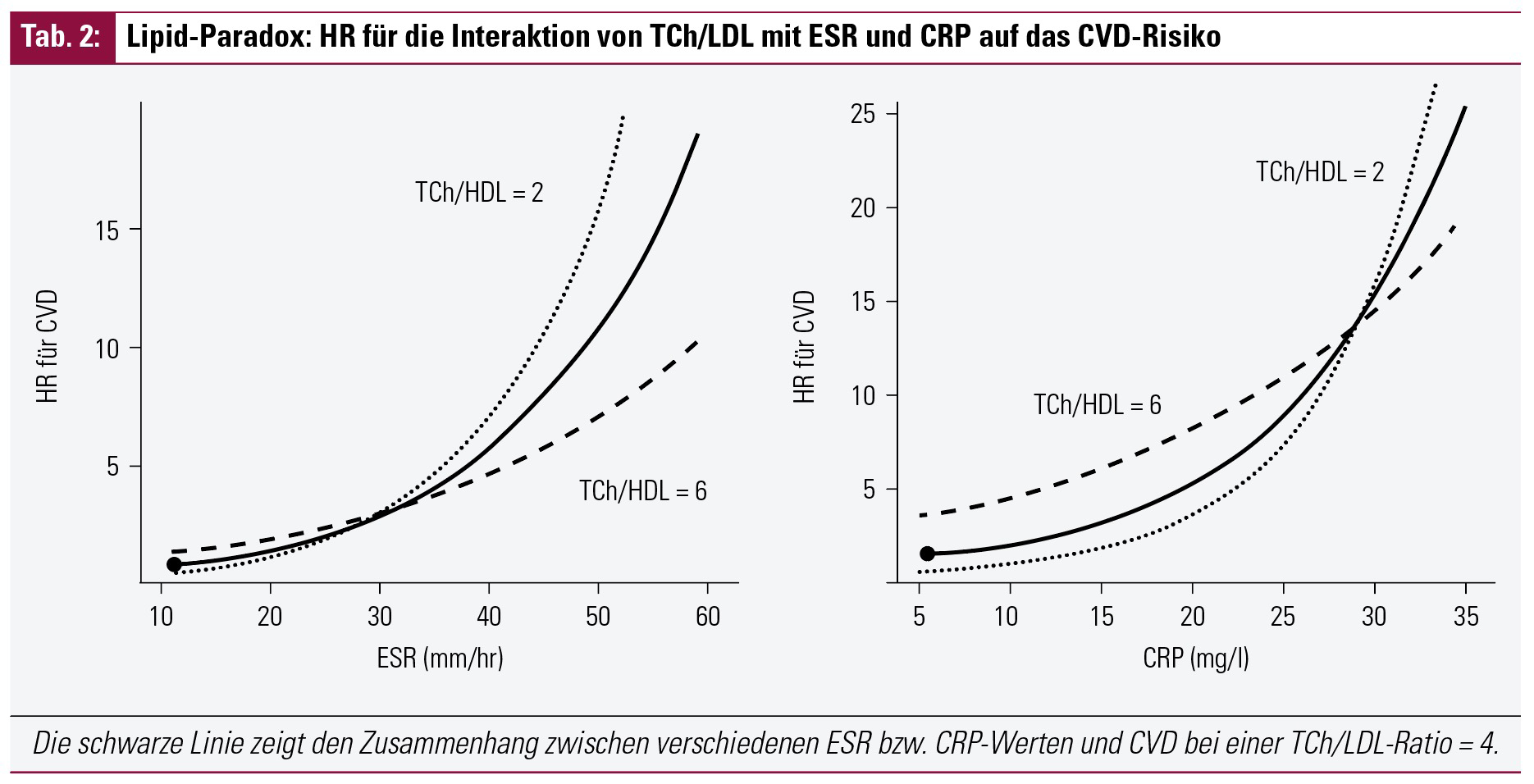
Eine Besonderheit ist das Lipid-Paradox12, das für die RA beschrieben wurde. Es wurde gezeigt, dass eine Atherosklerose gehäuft bei RA-Patienten vorkommt, die ein sehr niedriges LDL aufweisen.
Niedrige LDL- und Gesamt-Cholesterin-Blutwerte treten vor allem bei RA-Patienten mit erhöhter Entzündungsaktivität auf und gehen mit einem erhöhten Kalzium-Score in Computertomografien der Koronararterien einher; der Mechanismus ist noch unklar. Umgekehrt ist ein erhöhtes HDL nicht mit einem niedrigen Kalziumscore assoziiert. Dieser ist am höchsten bei Patienten mit sehr niedrigem und sehr hohem LDL.
Somit kann man vom LDL-Level nicht exakt auf das CVD-Risiko schließen, sondern sollte immer die RA-Aktivität mit einbeziehen. Vor allem RA-Patienten mit einem sehr niedrigen LDL profitieren von einem genaueren Screening.
Therapie
Die Darstellung der Therapie atherosklerotischer Erkrankungen würde über den Rahmen dieses Beitrages hinausgehen. Im Folgenden werden zielgerichtete präventive Maßnahmen dargestellt.
Krankheitskontrolle: Mehrfach wurde nachgewiesen, dass es durch das Erreichen einer Remission bzw. niedrigen Krankheitsaktivität zu einer CVD-Reduktion kommt, und das (nahezu) unabhängig von der Basismedikation.13, 14 Ziel der Krankheitskontrolle sollte nicht das einmalige Erreichen einer Remission sein, sondern eine regelmäßig eingenommene Basistherapie und somit eine konstante Reduktion der Krankheitsaktivität über Jahre und Jahrzehnte.
Lebensstilmodifikation: Gleichbedeutend mit einer Verbesserung der Krankheitskontrolle sollten die Patienten – angesichts der häufigeren klassischen CVD-Risikofaktoren bei Rheumatikern – falls möglich zu einer Gewichtsabnahme und körperlichen Aktivität motiviert werden.
Essenziell ist das Erreichen einer Nikotinkarenz. Rauchen ist ein Risikofaktor für die Entwicklung einer RA und ist unbestritten für die Entwicklung einer CVD mitverantwortlich; ebenso ist dadurch das Ansprechen auf die krankheitsmodifizierende Therapie bei RA-Patienten vermindert. Rauchern sollten Möglichkeiten und Anlaufstellen, wo sie Unterstützung beim Erreichen eines Rauchstopps erhalten können, angeboten werden.
Adhärenz: Eine große Herausforderung für Rheumatologen ist die Therapieadhärenz der Patienten, vor allem wenn eine subjektiv gute bzw. sehr schlechte Krankheitskontrolle besteht. Eine mangelhafte Adhärenz kann das Auftreten einer CVD begünstigen.
Polypharmazie: Zum Erhalt der Adhärenz ist es notwendig, die Patienten vor einer Polypharmazie zu schützen. Eine gute Krankheitskontrolle (wodurch es weniger oft zu einem Einsatz von NSAR und Glukokortikoiden kommt) und der Einsatz von Kombinationspräparaten können hierbei helfen.
Welches DMARD wirkt besonders gut bei einer CVD: Hierzu gibt es keine direkten Vergleichsstudien. Es wurde eine CVD-Reduktion durch den Einsatz von Basistherapeutika (MTX, Anti-TNF) und dem Erreichen einer Remission/niedrigen Krankheitsaktivität nachgewiesen, dies sollte als wichtigste Therapiemaßnahme zur Senkung des Risikos gelten.15
Nach Beginn einer Behandlung mit konventionellen DMARDs/ Biologika kann ein Anstieg der Lipide beobachtet werden, dies wurde bei MTX, TNF-Hemmern und vor allem bei Tocilizumab und Tofacitinib nachgewiesen. Gleichzeitig konnte aber keine Erhöhung der CVD-Rate beobachtet werden. Dies wird auf eine Änderung des Lipid-Profils und auf die Verbesserung der Krankheitskontrolle zurückgeführt.
Auf die Beachtung CVD-relevanter Nebenwirkungen (arterielle Hypertonie unter Leflunomid) und Kontraindikationen (TNF-Hemmung bei schwerer Herzinsuffizienz) sei hier der Vollständigkeit halber hingewiesen.
Die chronische Inflammation wird als gemeinsamer Pathomechanismus der RA und der Atherosklerose suspiziert und die positive Wirkung verschiedener DMARDs durch deren entzündungsreduzierende Wirkung erklärt. Ob DMARDs per se, also auch ohne das Vorhandensein einer entzündlich rheumatischen Erkrankung, eine CVD-prophylaktische Wirkung haben, ist nicht genau geklärt. Bei Patienten (ohne RA) wurde nach einem MCI MTX zur Sekundärprophylaxe eingesetzt; diese Studie musste allerdings aufgrund der Unwirksamkeit von MTX im Vergleich zu Placebo abgebrochen werden.16 Andererseits zeigt eine Studie bei Patienten (ebenfalls ohne rheumatische Erkrankungen) mit einem MCI und erhöhten Entzündungswerten unter Therapie mit Canakinumab, einem IL-1-Hemmer, eine niedrigere Rate an Re-Infarkten.17
Hydroxychloroquin (HCQ): Der Einsatz von HCQ zeigt bei RA-Patienten eine Verbesserung im kardiovaskulären Outcome.18 So konnte eine Senkung der Lipide im Vergleich zu MTX nachgewiesen werden; weiters hemmt HCQ die Thrombozytenaggregation und senkt den HbA1c. Somit wäre HCQ ein ideales Kombinationspräparat bei RA-Patienten mit einem hohen kardiovaskulären Risikoprofil. Andererseits ist der Stellenwert auch im Sinne der Polypharmazie sowie der geringen entzündungshemmenden Wirkung zu hinterfragen. Möglicherweise sollte HCQ bei Patienten mit hohem Risikoprofil und noch nicht nachgewiesener atherosklerotischer Erkrankung (da hier ohnehin eine Standardtherapie mit ASS, ACE-Hemmern etc. indiziert und effektiver ist) eingesetzt werden. Auch hier sei auf Nebenwirkungen von HCQ wie das Long-QT-Syndrom sowie eine Kardiomyopathie hingewiesen.
Vermeiden von Glukokortikoiden: Unbestritten ist systemisch wirksames Kortison ein starker Risikofaktor. Der dauerhafte Gebrauch ist nach Möglichkeit zu minimieren. Hier sind die Rheumatologen gefordert, eine wirksame Basistherapie zu etablieren, um Steroide einzusparen.
NSAR: Kontinuierlicher NSAR-Gebrauch führt zu einem CVD-Anstieg, vor allem bei Patienten mit RA und PsA. Bei SpA-Patienten hingegen gibt es Signale, dass eine NSAR-Dauermedikation das Auftreten von atherosklerotischen Erkrankungen reduziert; dies ist auf deren basistherapeutische Wirkung zurückzuführen.
Zu beachten ist bei Patienten mit manifester CVD und somit indizierter Behandlung mit Acetylsalicylsäure ein Interaktionspotenzial von NSAR mit ASS; hier sollte neben einer suffizienten Basistherapie auch die Schmerztherapie angepasst werden.
Acetylsalicylsäure: In der Primärprophylaxe hat ASS bei Rheuma-Patienten wie auch in der Normalbevölkerung keinen Stellenwert.19 Dies gilt natürlich nicht für spezielle Indikationen (APLAS, SLE-Schwangerschaften mit Präeklampsierisiko etc.). In der Sekundärprophylaxe ist der Einsatz von ASS obligat.
Lipidmanagement: Statine wirken in der Primär- und Sekundärprophylaxe einer CVD; je größer die LDL-Reduktion ist, umso weniger Events treten auf, was in der Folge zu einem Rückgang der Mortalität führt.
In den ESC-Guidelines für Hyperlipidämie werden Patienten anhand des Risikoscores eingestuft; daraus ergeben sich die jeweiligen Interventionen und LDL-Zielwerte für jeden Patienten. In den neuen Leitlinien wurden für die jeweiligen Risikostufen teils neue LDL-Zielwerte definiert.
Eine koronare mikrovaskuläre Dysfunktion führt zu einer erhöhten Mortalität und kommt bei RA in gleicher Häufigkeit vor wie bei Patienten mit Diabetes mellitus.20 Dies könnte – neben einem suspizierten Pathomechanismus der CVD-assoziierten Mortalität – die Annahme stützen, dass in der Risikobewertung die RA dem Diabetes mellitus ähnlich ist und somit die LDL-Zielwerte für RA-Patienten jenen von Diabetikern gleichzustellen wären.
Für andere lipidsenkende Medikamente gibt es keine Daten rein für Rheumatiker und kein Statement von der EULAR, weshalb man sich hier an den Empfehlungen der Fachgesellschaften orientieren sollte.
Conclusio
Kardiovaskuläre Komorbiditäten rücken in den Vordergrund, die Patientenversorgung lässt allerdings zu wünschen übrig. Warum es dennoch zu einem Rückgang der Mortalität kommt, ist letztlich nicht geklärt (Rückgang der Sterblichkeit in der gesamten Bevölkerung? Suppression der Inflammation durch effizientere Therapie? Einsparen von Steroiden und NSAR durch T2T?).
Die wichtigsten Punkte zur Senkung der Mortalität sind:
- einheitliches und strukturiertes Screening
- Reduzieren von Risikofaktoren, vor allem des Nikotinabusus
- dauerhafte, konsequente Basistherapie und Erreichen einer Remission bzw. LDA
- Vermeiden von systemisch wirksamen Glukokortikoiden und NSAR (außer bei der SpA)
- Vermeiden von Polypharmazie
Halm VP, Nurmohamed MT, Twisk JW, Dijkmans BA, Voskuyl AE, Diseasemodifying antirheumatic drugs are associated with a reduced risk for cardiovascular disease in patients with rheumatoid arthritis: a case control study. Arthritis Res Ther 2006; 8(5):R151.