Hämatologie, Stammzelltransplantation und antivirale Strategien
Die Management-Maßnahmen für Patienten mit COVID-19 stellen eine therapeutische Herausforderung dar. Seit Beginn des Ausbruchs wird eine polypragmatische Strategie zur Behandlung Erkrankter angewandt. Die tatsächlich wirksamste Herangehensweise ist letztlich noch nicht definiert, insbesondere da die Evidenzlage zur Effizienz einzelner Medikamente noch sehr bescheiden ist. Eine Vielzahl an klinischen Studien ist aktiv, deren Ergebnisse ungeduldig erwartet werden. Eine besondere Patientengruppe stellen Patienten mit hämatologischen Systemerkrankungen dar, die außerdem häufig immunsupprimiert sind. Insbesondere für jene, die aktuell therapiebedürftig sind oder eine Blutstammzelltransplantation benötigen, ist zu Zeiten einer viralen Pandemie eine modifizierte Vorgehensweise erforderlich.
Risiko viraler Erkrankungen bei hämatologischen Patienten
Generell ist das Risiko für oder bei einer viralen Infektion für immundefiziente hämatologische Patienten, insbesondere unter einer Chemo-/Immuntherapie oder nach Blutstammzelltransplantation, erhöht. Die Inzidenz respiratorischer Virusinfektionen variiert signifikant in verschiedenen Studien; in einer Auswertung aus 37 EBMT-Zentren lag die Inzidenz zwischen 0 % und 18 %, wobei die Lymphozytopenie der wichtigste Risikofaktor für den Progress in den unteren Respirationstrakt darstellt.
Belastbare Inzidenzahlen zu SARS-CoV-2-Infektionen bei hämatologischen Patienten liegen – ebenso wie bei den nicht-hämatologischen Patienten – aktuell noch nicht vor.
Risiko bei COVID-19 für hämatologische Patienten: Bisherige Daten zeigen nicht unerwartet, dass Patienten mit Komorbiditäten schwerere Erkrankungsverläufe haben. Eine chinesische Chart Review- Studie an 1.590 COVID-19-infizierten Patienten zeigte, dass das Vorliegen von COPD, Diabetes, Hypertonie oder einer malignen Erkrankung Risikofaktoren für einen kombinierten Endpunkt (Aufnahme in die Intensivstation, invasive Beatmung oder Tod) waren. Aussagen zu Stadium und Schwere der entsprechenden Begleitkrankheit, Informationen zu deren Kontrolle oder Angaben zu notwendigen Begleitmedikationen liegen nicht vor.
Erfahrungen von Influenza: Aus den oben angeführten Gründen haben hämatologische Patienten ein höheres Risiko, eine Influenza-Infektion sowohl in häuslicher Umgebung wie auch im Krankenhaus zu erwerben. Möglicherweise lassen sich Erkenntnisse daraus auf die aktuelle COVID-19-Pandemie übertragen.
Hämatologische Patienten mit Influenza waren oft afebril und hatten nicht immer die typischen Symptome, was durch verminderte Zytokin-Response und/oder die Verwendung immunsupprimierender Medikamente wie Cortison bedingt sein könnte.
Superinfektionen sind bei Influenza bei hämatologischen Patienten häufig. Aktives Vorgehen bei der Diagnostik – auch bei oligosymptomatischer Präsentation – wird empfohlen. Auch bei Influenza ist eine tiefe Lymphozytopenie der signifikanteste Risikofaktor für ein Übergreifen auf den tiefen Respirationstrakt. In der Literatur angegebene Mortalitätsraten bei hämatologischen Patienten mit Influenza-Pneumonie reichen von 0 % bis zu 25 % in manchen Serien transplantierter Patienten. Zum Management werden rigoroses Testen sowie Isolation im Krankenhausbereich als äußerst effektiv zur Kontrolle auch bei hohen Erkrankungszahlen in der allgemeinen Bevölkerung empfohlen. Antivirale Therapie wird kontroversiell diskutiert; bei Infektion sollte Chemotherapie und/oder Konditionierung zur Blutstammzelltransplantation verschoben werden. Die bei Influenza verfügbare Impfung vorab wird naturgemäß empfohlen.
SARS-CoV-2-Screening-Maßnahmen bei hämatologischen Patienten: Das er höhte Risiko für Tumorpatienten, eine COVID-19-Infektion zu erwerben bzw. einen schweren Verlauf zu erfahren, führt zur Empfehlung, Tumorpatienten rigoros auf SARS-CoV-2 zu testen. Dies ist bei entsprechendem Beschwerdebild selbstverständlich und sollte auch vor geplanten Therapien für asymptomatische Patienten gelten.
Empfehlungen für hämatologische Patienten
Wie für alle Patienten mit Begleit- und Vorerkrankungen besteht auch für Patienten mit hämatologischen Erkrankungen oder unter spezifischen Therapien ein erhöhtes Risiko einer SARS-CoV-2-Infektion. Dies hängt von der genauen Diagnose sowie dem Grad der Kontrolle dieser Erkrankung ab. Patienten mit humoraler Immundefizienz oder unter immunsuppressiver Therapie sind entsprechend besonders betroffen. Während bei malignen Erkrankungen als Komorbidität ein erhöhtes Risiko für schwere Verläufe der Infektion dokumentiert ist, gibt es noch keine validierten Vorgangsweisen für spezifische klinische Situationen. Die Empfehlungen zur Vorgangsweise bei hämatologischen Patienten sind daher derzeit nur eminenzbasiert und wurden von Fachgesellschaften oder als Reviews für Hämatologie generell oder – wie auf der ASH-Website – für Subentitäten publiziert.
Allgemein wird Krebspatienten geraten, besonders achtsam zu sein und sich an die Empfehlungen wie Selbstisolation strikt zu halten. Es muss prinzipiell abgewogen werden, ob die Verzögerung der hämatologischen Behandlung indiziert ist bzw. verantwortet werden kann. Entscheidungskriterien hierfür sind beispielsweise das Therapieziel, der Status der Krebserkrankung, das Rezidivrisiko, die Ansteckungsgefahr für SARS-CoV-2 etc. Generell wird in vielen Fällen die effektive Behandlung der Krebserkrankung wichtiger sein.
In der Diagnostik ist zum Nachweis von COVID-19 eine Multiplex-NAT-Diagnostik aus respiratorischem Material empfohlen. Sollten Antikörpertests in Zukunft verfügbar werden, ist deren Aussagekraft bei hämatologischen Patienten vermutlich eingeschränkt. Bei pulmonaler Symptomatik sollte eine CT der Lunge erfolgen, ein Thorax-Röntgen alleine ist nicht ausreichend.
In Zeiten der Corona-Pandemie muss die Behandlung von hämatologischen Erkrankungen auf modifizierte Weise erfolgen. Risiken für eine Ansteckung sollten reduziert werden, Hospitalisierung und Ambulanzvisiten sollten vermieden werden, telemedizinische Ansätze nach Möglichkeit verfolgt werden. Nicht unbedingt notwendige Therapien sollten, wenn es klinisch vertretbar ist, aufgeschoben oder modifiziert durchgeführt werden. Die Einleitung oder Fortführung palliativer Therapien muss hinterfragt werden, nicht unbedingt notwendige Supportivbehandlung, die Langzeitnebenwirkungen minimieren soll (z. B. Bisphosphonate für Knochen-bezogene Ereignisse in Patienten mit Myelomen), könnte pausiert bzw. auf orale Präparate umgestellt werden.
Die Therapien akuter Erkrankungen wie akute myeloische Leukämie (AML) oder akute lymphatische Leukämie (ALL), wo ein kurativer Ansatz verfolgt wird, sind auch in Zeiten von COVID-19 in voller Intensität unverzüglich zu beginnen. Eine Verringerung der Zahl von Konsolidierungszyklen bei Erreichen einer CR kann u. U. erwogen werden. In der Erhaltungstherapie z. B. bei ALL sollten höhere ANC-Werte mittels G-CSF-Gabe angestrebt werden. Bei Erkrankungen mit geringerer Dynamik – wie indolente Lymphome – sollte die Schwelle für den Therapiebeginn hoch gelegt werden und nur bei absoluter Indikation eine Behandlung initiiert werden. Mitigierte Behandlungsschemata können erwogen werden; die Rolle von Erhaltungstherapien (Erhöhung der Infektionsgefahr?) ist zu diskutieren. Therapien bei Hochrisiko-MDS sollten fortgeführt werden.
Bei myeloproliferativen Neoplasien sollten zytoreduktive Therapien fortgeführt werden, das beinhaltet auch Ruxolitinib. Ein Absetzen insbesondere bei COVID- 19-Infektion ist mit höheren Risiken des Erkrankungsprogresses bzw. dadurch ausgelösten Komplikationen (wie Nierenproblemen, Infektionen, Elektrolytentgleisungen etc.) bzw. Flare-ups verbunden. Eine Neueinstellung zur Zytoreduktion sollte jedoch wenn möglich vermieden werden. Bei manifester viraler Infektion sollte möglichst von Thrombozytenaggregationshemmern wie ASS auf niedermolekulares Heparin gewechselt werden.
ITP-Patienten sollten bei Exazerbation mit i.v. Immunglobulin-Gaben und TPO-Agonisten versorgt werden. Kortikosteroide sollten so niedrig dosiert wie möglich zum Einsatz kommen.
Empfehlungen zur Blutstammzelltransplantation
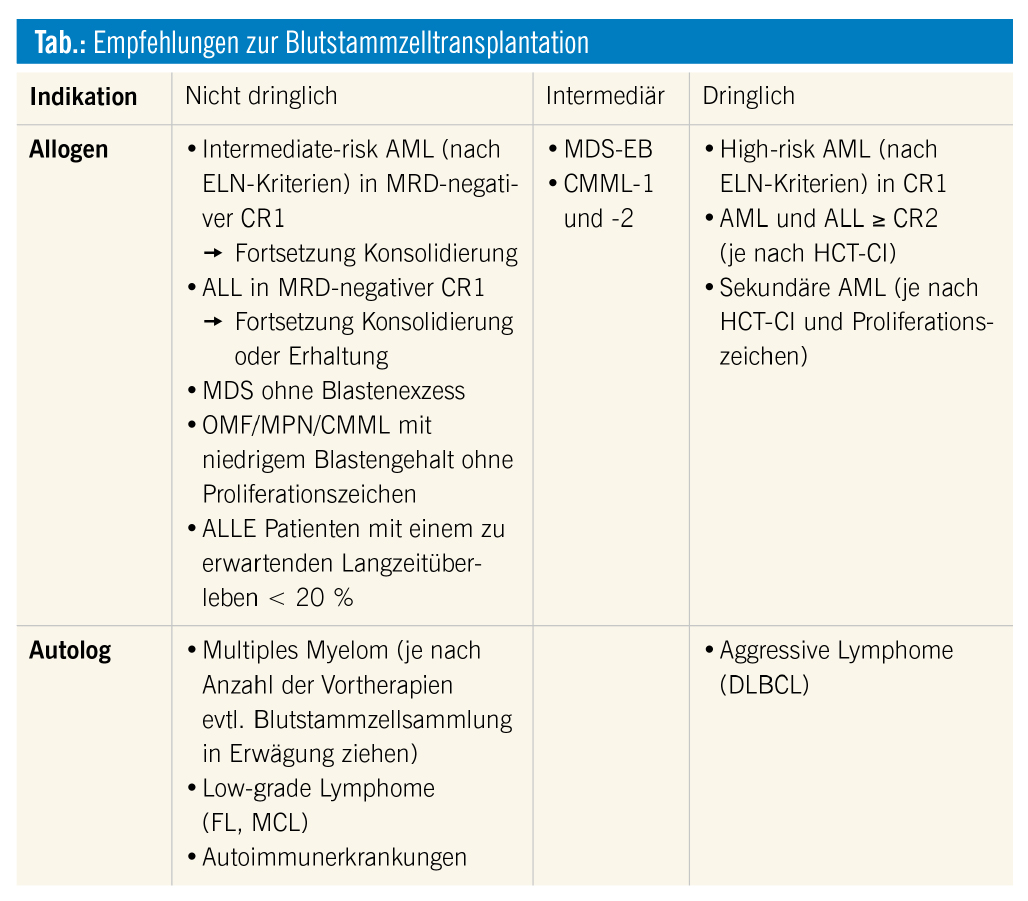
Alle autologen und allogenen Blutstammzelltransplantationen (SZT) sollten derzeit hinsichtlich ihrer Indikation nochmals beurteilt und nicht dringende SZT aufgeschoben werden (siehe Empfehlungen Tab.), um Patienten keinem zusätzlichen Infektionsrisiko auszusetzen. Weiters soll damit auch die Akutversorgung in den Spitälern nicht belastet werden. Zusätzlich sind logistische, organisatorische Überlegungen für allogene Spender zu berücksichtigen, da eventuell auch noch kurzfristig aufgrund von geschlossenen, internationalen Grenzen und/oder eingeschränkten Reisemöglichkeiten eine zeitgerechte Blutstammzellspende bzw. Anlieferung derselben unmöglich gemacht werden könnte (siehe Empfehlungen prä-Transplantation für dringliche Patienten).
Insbesondere sollten im Falle einer COVID-19-Infektion auch Patienten mit schwerwiegenden kardialen oder pulmonalen Komorbiditäten nach Möglichkeit verschoben werden, um ICU-Kapazitäten nicht zu belasten. Selbstverständlich obliegt aber die Letztverantwortung dem zuständigen Transplantzentrum.
Empfehlungen prä-Transplantation für dringliche Patienten
- Vor Start der Konditionierung sollten ALLE Patienten 14 Tage in Heimisolation sein, um das Infektionsrisiko zu minimieren. Kontrolltermine im Spital sollten auf ein Minimum reduziert werden.
- Alle Patienten (auch asymptomatische!) sollten 2 Tage vor der stationären Aufnahme auf SARS-CoV-2 getestet werden, die Konditionierung sollte nur bei Vorliegen eines negativen Testergebnisses gestartet werden.
- Kryokonservierung der Stammzellen VOR Start der Konditionierung (Stammzellprodukte aller Spender).
- Bei einer Diagnose von COVID-19 sollte die Transplantation nach Ausheilung (2x negative PCR) um mind. 3 Monate verschoben werden. Wenn das aus medizinischer Sicht nicht vertretbar ist, sollte bei Hochrisikopatienten die Behandlung zumindest so lange aufgeschoben werden, bis keine Symptome und zwei negative PCR-Ergebnisse im Abstand von mindestens einer Woche vorliegend sind.
- Im Falle eines Kontakts mit einer Person mit COVID-19-Diagnose sollte die Transplantation um 14 bis 21 Tage aufgeschoben werden.
Empfehlungen für Blutstammzellspender
- Im Falle einer Diagnose mit COVID-19 sollte der Spender nach Ausheilung für mind. 3 Monate ausgeschlossen werden.
- Im Falle eines Kontakts mit einer COVID-19-positiven Person sollte der Spender für 28 Tage ausgeschlossen werden. In dringenden Fällen, wenn der Spender asymptomatisch ist, ein negativer SARS-CoV-2-Test vorliegt bzw. keine anderen Spender verfügbar sind, ist eine Blutstammzellspende eventuell früher möglich.
- Im Falle einer Reise in ein Risikogebiet sollte der Spender für 28 Tage ausgeschlossen werden.
Antivirale Strategien für hämatologische Patienten
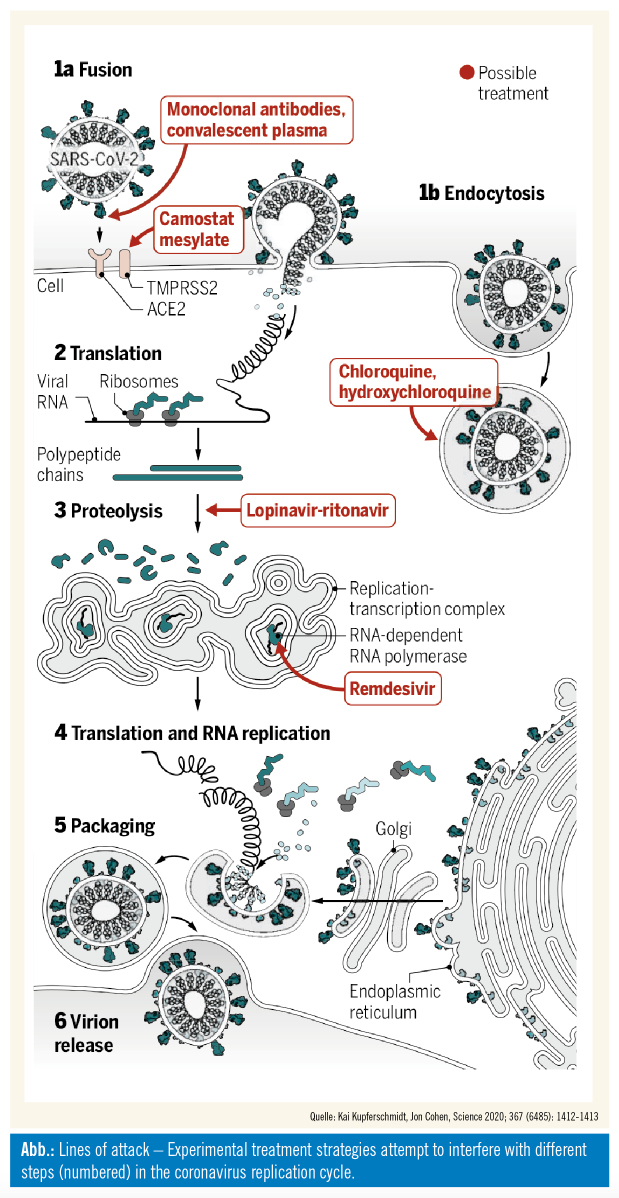
Monoklonale Antikörper oder Rekonvaleszentenplasma könnten freies Virus vor der Aufnahme in die Körperzellen binden und zerstören (passive Immunisierung). Die Aufnahme in die Zelle über Rezeptoren oder Endozytose könnte spezifisch gehemmt werden. Weitere Ziele stellen Proteolyse, Replikation sowie Transkription dar. Klinische Studien und individuelle Heilversuche mit verschiedenen Substanzen werden aktuell durchgeführt. Sollten diese positiv verlaufen, wäre eine Umsetzung eher rasch möglich (speziell, wenn es sich um bereits in anderen Indikationen etablierte Substanzen handelt). Die erfolgreiche Entwicklung einer Impfung wäre eine ebenfalls sehr wirkungsvolle Maßnahme zur Epidemiekontrolle, wobei hier der Zeithorizont jedoch länger zu sehen ist.
Fallberichte zu Medikamenten
Chloroquin: Das Malariamedikament Chloroquin hemmt die Virusaufnahme in die Zelle, was in präklinischen Studien auch für SARS-CoV-2 gezeigt werden konnte. Das Nebenwirkungsprofil ist durch den langjährigen Einsatz bei Malaria gut dokumentiert. Die positiven Effekte von Chloroquin können jedoch mit schweren Nebenwirkungen einhergehen. Im klinischen Einsatz bei mehr als 100 Patienten während der Epidemie in China zeigte Chloroquin Wirkung und akzeptable Sicherheit bei der Behandlung von COVID-19-assoziierter Pneumonie, deren Exazerbation gehemmt wurde, bei Besserung der Bildgebung begleitet von Virusclearance. Diese Therapie wurde in die chinesischen Therapieempfehlungen übernommen.
Als Alternative zu Chloroquin wurde Hydroxychloroquin vorgeschlagen, da es einen ähnlichen Effekt mit möglicherweise geringeren Nebenwirkungen aufweisen könnte. Einschränkend ist zu erwähnen, dass nun bereits vermehrt Arbeiten als Preprint veröffentlicht werden, aufgrund derer der Einsatz von Hydroxychloroquin außerhalb von klinischen Studien aktuell nicht empfohlen werden kann.
Als mögliche Kombinationspartner werden Remdesivir (für SARS und Ebola in Entwicklung) sowie Azithromycin diskutiert. In einer französischen Studie wurde die Wirkung von Hydroxychloroquin +/-Azithromycin mit unbehandelten Patienten (asymptomatisch oder Infektion oberer oder unterer Respirationstrakt) auf die Viruslast verglichen. Nach Tag 6 waren in der Kontrollgruppe 12,5 %, in der Monotherapie 70 %, in der Kombinationstherapie 100 % virenfrei. Der klinische Benefit bleibt zu zeigen. Auch dürfte Remdesivir auch als Monosubstanz eine signifikante Wirksamkeit gegen COVID-19 aufweisen, sehr ermutigende compassionate use-Ergebnisse wurden kürzlich vorgestellt, eine Phase-III-Studie rekrutiert derzeit.
Protease-Inhibitoren: SARS-CoV-2 benutzt den SARS-CoV-Rezeptor ACE2 für den Eintritt in die Wirtszelle. Das Bindungsprotein von SARS-CoV-2 wird durch TMPRSS2 geprimed. Antikörper gegen das SARS-CoV-Bindungsprotein könnten vor SARS-CoV-2 schützen. Die SARS-CoV-2-Infektion hängt von ACE2 und TMPRSS2 ab und könnte durch Protease-Inhibitoren blockiert werden. In Japan ist Camostat als derartiger Wirkstoff in den Indikationen chronische Pankreatitis sowie Refluxösophagitis zugelassen und sollte bei der SARS-CoV-2- Infektion geprüft werden. Der bei HIV-Infektionen aktive Proteaseinhibitor Lopinavir-Ritonavir wurde randomisiert als Add-On zur Standardtherapie bei 199 Patienten mit schwerem COVID-19 untersucht. Es zeigte sich kein Unterschied in der Zeit bis zur klinischen Besserung zwischen Lopinavir-Ritonavir-Therapie und Standard of care sowie kein Unterschied in der Mortalitätsrate zwischen den beiden Behandlungsgruppen.
Anekdotische Erfolge mit Rekonvaleszentenplasma wurden als „Proof of Principle“ berichtet und stellen eine weitere Therapieoption dar. Aus den dargestellten Daten ergibt sich, dass derzeit keine evidenzbasierte suffiziente Therapie für die schweren Verlaufsformen von COVID-19 zur Verfügung steht. Der Off Label-Einsatz verschiedener Substanzen wird kritisch diskutiert. Bedeutende Anstrengungen werden jedoch unternommen, um effektive Therapien zu entwickeln. Über 500 klinische Studien unterschiedlicher Sponsoren sind über die WHO regist- riert, eine COVID-19 Clinical Research Coalition wurde gebildet. Um Zeit zu gewinnen, wird versucht, vereinfachte Studienschemata, die rasch und breit ausgerollt werden können, zu etablieren. Als Beispiel sei die SOLIDARITY-Studie genannt, die randomisiert multizentrisch Remdesivir, Chloroquin oder Hydroxychloroquin bzw. Lopinavir-Ritonavir +/-Interferon-beta untersucht.
Tocilizumab: Im Rahmen schwerer Erkrankung durch COVID-19 kommt es zu mehr oder weniger schweren Zytokinfreisetzungen (Cytokine Release Syndrome), die im schlimmsten Fall durch massive exsudative Alveolarschädigung auch zum Tod führen können. Aus diesem Grunde wurde der Behandlung dieses Zytokinsturms bei schwerer Erkrankung (assistierte Beatmung, Intubation, ARDS) eine wesentliche Rolle zugemessen. Pathogen aktivierte T-Zellen und Monozyten initiieren den inflammatorischen Zytokinsturm über massive Freisetzung von IL-6.
Der aus der Rheuma-Therapie bekannte Interleukin 6-Antagonist Tocilizumab kann aufgrund der Blockade der Signaltransduktion im Pathway des IL-6 die überschießende Freisetzung der Zytokine wesentlich vermindern. Es zeigte sich im Rahmen der klinischen Erfahrungen mit diesem Antikörper eine rasche Verminderung des Fiebers und deutliche Verbesserung der Atemfunktion, weshalb nunmehr ein Named Patient Program zur breiteren Verfügbarkeit, Erweiterung der Erfahrung mit der Substanz und Gewinnung klinischer Daten aktiviert wurde.
Arzneimittelinteraktionen
Da die Behandlung von COVID-19 Patienten, insbesondere von schweren Fällen auf Intensivstationen, meist eine pragmatische Polypharmazie erfordert, wäre eine genaue Kenntnis des Effekts der Weiterführung bisheriger Therapien für Begleiterkrankungen sowie zur Therapie von Komplikationen wie Superinfektionen bei gleichzeitiger SARS-CoV-2-Infektion essentiell. Auch hierzu gibt es derzeit nur wenige Daten.
Intensiv und kontrovers diskutiert wird der Einsatz von Medikamenten, die auf das Renin-Angiotensin-System wirken. ACE2 ist, wie oben angeführt, der funktionale Rezeptor für SARS-CoV-2. RAAS-Hemmer könnten die ACE2-Expression steigern und möglicherweise bei COVID-19 nicht sicher sein. Ob dies auch in vivo der Fall ist, ist durch Daten nicht belegt und soll in klinischen Studien geprüft werden. Abruptes Absetzen derartiger Medikamente bei Herzinsuffizienz und nach Myokardinfarkt ist jedenfalls mit klinischer Instabilität und klinischer Verschlechterung verbunden und sollte nach einer im NEJM publizierten Empfehlung auch bei Personen mit Risiko für COVID-19 nicht erfolgen.
Antikoagulation: Bei Patienten mit Vorerkrankungen stellt sich die Frage einer Fortführung einer bestehenden Gerinnungstherapie, bei schwereren Verläufen spätestens zum Zeitpunkt der Hospitalisierung. Eine Störung der Gerinnung ist jedenfalls laut chinesischen Daten mit schlechterer Prognose verbunden, da im Rahmen des hochaktiven inflammtorischen Zytokin-Releases verbunden mit Hypoxie und Immobilisation ein deutlicher Anstieg thrombotischer Komplikationen (venöse/arterielle Gefäßverschlüsse, Pulmonalembolie, Myokardinfarkte, Apoplexie) beobachtet werden musste. Wenngleich derzeit noch keine genauen Inzidenzraten (in der Literatur auf ICUs in den Niederlanden bis zu 27 % venöse, 3,7 % arterielle Events beschrieben) zu diesen Komplikationen vorliegen, muss von einem wesentlichen Einfluss auf die Mortalitätsrate ausgegangen werden. Diesbezüglich ist in jedem Fall eine strenge Einhaltung der antithrombotischen Prophylaxe, u. U. auch in hochprophylaktischen, zweimal täglich zu applizierenden Dosen, vorzugsweise, mangels Erfahrungen mit DOAK/NOAKPräparaten, mit niedermolekularem Heparin s.c. anzustreben.
Die Gabe von Heparin war bei einer Serie von 449 chinesischen Patienten, von denen 99 Heparin erhielten, mit einer besseren Prognose (Endpunkt: 28-Tage- Mortalität) assoziiert.
Die American Society of Hematology empfiehlt bei Hospitalisierung und/oder Risiko durch Vorhofflimmern etc. niedermolekulares Heparin in der prophylaktischen Dosierung, solange keine Blutungen auftreten. Von DOAKs oder Plättchenaggregationshemmern wird wegen der fehlenden Steuerbarkeit und möglicher Interaktionen mit anderen (auch experimentellen) Therapien abgeraten.
Bei erforderlicher Polypragmasie und möglichem experimentellem Einsatz neuer oder Off Label-Produkte ist auf mögliche Medikamenteninteraktionen speziell zu achten. Eine gute Zusammenstellung der Liverpool Drug Interaction Group findet sich im Internet.
Therapie bei hämatologischen Erkrankungen und gleichzeitigem COVID-19
Es ist wichtig, dass Erfahrungen in der Therapie hämatologischer Patienten mit gleichzeitiger COVID-19-Infektion geteilt werden. Verschiedene Initiativen organisieren aktuell Fallsammlungen zu einzelnen Entitäten. In Ermangelung fachspezifischer klinischer Studien haben Fallberichte informative Bedeutung.
Zwei Beispiele seien dazu abschließend vorgestellt: Ein junger Patient mit massivem CLL-Befall wurde in China zytoreduktiv mit Chlorambucil und supportiver Therapie behandelt. Er überlebte COVID-19 interessanterweise auch durch Einsatz der eigentlich kontrovers diskutierten Steroide. Ebenfalls als Fallbericht wurde der erfolgreiche Einsatz von Tocilizumab bei einem Patienten mit Plasmozytom/Amyloidose (Zustand nach Primärtherapie mit Bortezomib-haltiger Induktion und Thalidomid-Erhaltung) beschrieben. Medikamente wie Tocilizumab, die einen positiven Einfluss sowohl auf die hämatologische Grunderkrankung als auch auf den Verlauf von COVID-19 haben können, sind von besonderem Interesse. BTK-Inhibitoren, hier Ibrutinib, könnten durch ihre antiinflammatorische Wirkung die pulmonalen Symptome von COVID-19 abmildern.
Abschließende Bemerkungen
Es ist zu hoffen, dass unser Informationsstand rasch zunimmt, um auch hämatologische Patienten in Zeiten von COVID-19 evidenzbasiert behandeln zu können. Prinzipiell ist es erforderlich und auch möglich, die Versorgung hämatologischer Patienten zu Zeiten der COVID-19-Pandemie an die neuen Erfordernisse anzupassen, jedoch muss unbedingt darauf geachtet werden, dass die Angst vor einer Infektion mit COVID-19 nicht die Bekämpfung einer bereits existierenden, lebensgefährlichen Erkrankung beeinträchtigt.