To treat or not to treat?
- Neue Daten, die eine eindrucksvolle Verbesserung der Prognose von SLiM-CRAB- positiven Patient:innen mit ≥ 60 % BMPC sowie von Patient:innen mit einer FLC- Ratio ≥ 100 zeigen, widerlegen die Empfehlung zur sofortigen Therapieeinleitung bei Patient:innen mit SLiM-CRAB-positivem Multiplem Myelom.
- Die dramatische Verbesserung der prognostischen Situation dieses Patientenkollektivs ist am ehesten auf ein sogenanntes Stadium-Migrationsphänomen zurückzuführen.
Primum non nocere
Der Spruch „primum non nocere“ vom römischen Arzt Scribomius Largus aus dem Jahr 50 nach Christus ist ein wesentlicher Grundsatz ärztlicher Ethik. Besonders relevant wird dieser Leitsatz, wenn es sich um symptomfreie Patient:innen handelt, von denen nicht gesagt werden kann, ob und, falls ja, zu welchem Zeitpunkt ihre Erkrankung behandlungsbedürftig wird. Diesem antiken Wahlspruch zufolge sollen sich Ärzt:innen bemühen, den ihnen anvertrauten Patient:innen zu helfen und darauf zu achten, diesen nicht zu schaden. Zweitens soll der oder die Ärzt:in genau ergründen, was mit dem oder der Patient:in tatsächlich los ist. Erst dann soll der oder die Ärzt:in drittens die für die Heilung erforderlichen Schritte unternehmen. Besonders relevant werden diese Überlegungen, wenn man Patient:innen in einem Vorstadium einer möglicherweise später behandlungsbedürftigen Erkrankung im symptomfreien Zustand einer sofortigen Behandlung unterziehen möchte. Eine derartige Strategie erscheint dann berechtigt, wenn erstens der vermeintliche Nutzen wissenschaftlich belegt ist und wenn zweitens der Zeitpunkt für die Behandlungseinleitung so gewählt werden kann, dass diese kurz vor der Transformation, und nicht schon Jahre davor, erfolgt.
SLiM-CRAB-positives Multiples Myelom
Situation in der Ära vor 2014
Im Jahr 2014 wurden von der International Myeloma Working Group (IMWG) neue diagnostische Kriterien mit weitreichenden Konsequenzen veröffentlicht.1 Für Patient:innen mit smoldering Multiplem Myelom (SMM), die entweder ≥ 60 % BMPC (Knochenmarkplasmazellen) oder eine FLC-Ratio ≥ 100 (Ratio von freien Leichtketten) oder mehr als eine fokale, mittels MR de- tektierte Knochenläsion von zumindest 5 mm Durchmesser aufweisen, wurde die Kategorie „SLiM CRAB MM“ oder auch „Biomarker definiertes“ Multiples Myelom (MM) geschaffen. Nach damaligem Wissensstand sind solche Patient:innen relativ rasch in ein aktives, behandlungsbedürftiges MM übergegangen. Die mediane Zeit bis zur Progression lag gemäß der damals verfügbaren Evidenz bei Patient:innen mit ≥ 60 % BMPC bei 9,2 Monaten, bei Patient:innen mit einer FLC-Ratio ≥ 100 bei 15,3 Monaten und bei jenen mit mehr als einer fokalen Skelettläsion bei 15,1 Monaten. Demzufolge wurde von der IMWG eine unmittelbare Therapieeinleitung empfohlen. Diese Therapieempfehlung erschien vielen in der Betreuung von Patient:innen mit MM erfahrenen Kolleg:innen zu apodiktisch, da dies mit ihren klinischen Erfahrungen nicht im Einklang stand. Ein beträchtlicher Teil der Patient:innen, die diese Kriterien erfüllen, zeigte oft über lange Jahre keine Krankheitsprogression, weswegen die Empfehlung einer frühzeitigen Therapieeinleitung für viele nicht nachvollziehbar war.
Situation bei der CLL: Würde man diese Empfehlung zur unmittelbaren Behandlungseinleitung auf Patient:innen mit chronischer lymphatischer Leukämie (CLL) übertragen, müssten heute Personen mit einer klonalen B-Zell-Zahl von > 5.000/μl einer sofortigen Behandlung unterzogen werden. In diesem Zusammenhang sind die im Juni diesen Jahres beim EHA-Kongress in Frankfurt vorgetragenen Ergebnisse der CLL 12-Studie relevant, die eben die Frage eines eventuellen Nutzens einer frühzeitigen Behandlung untersucht hat. Patient:innen mit asymptomatischer CLL mit mittlerem und hohem Risiko wurden doppelt verblindet in eine Gruppe mit Ibrutinib oder Placebo randomisiert. Die frühzeitig eingeleitete Behandlung führte zu einer Verlängerung des progressionsfreien (PFS), jedoch nicht zu einer Verlängerung des Gesamtüberlebens (OS). Naturgemäß war die Therapie mit Ibrutinib mit den bekannten, manchmal erheblichen Nebenwirkungen verbunden, sodass an der bestehenden Empfehlung, die Behandlung erst bei Auftreten von Symptomen bzw. von allfälligen klinisch relevanten Progressionszeichen einzuleiten, festzuhalten ist.
Neue Daten – Situation seit 2014
Wir sind daher der Frage nachgegangen, ob die zuletzt nach 2014 publizierten Studien über die Prognose von Patient:innen, die die Kriterien für ein SLiM-CRAB-MM erfüllen, einen sofortigen Behandlungs- beginn rechtfertigen. Nach ausführlicher Literaturrecherche haben wir elf Publikationen, die insgesamt 3.482 Patient:innen inkludiert haben, identifiziert. Vier davon wurden bis inklusive 2014 publiziert und wurden zuvor als Grundlage für die IMWG-Konsensus-Empfehlungen herangezogen. Sieben Studien wurden danach veröffentlicht und haben naturgemäß vorwiegend Patient:innen, die nach modernen Standards diagnostiziert wurden, eingeschlossen. Letzteres ist insofern relevant, da in früherer Zeit nur konventionelle Skelettradiologie, jedoch keine modernen bildgebenden Maßnahmen (wie MR, PET/CT oder Ganzkörper-CT) für die Erfassung von Myelom-bedingten Skelettmanifestationen verfügbar waren, wodurch letztere nur selten erkannt und Patient:innen fälschlicherweise als SMM klassifiziert wurden. Der Anteil dieser Gruppe dürfte Schätzungen zufolge zwischen 20 % und 30 % liegen. Methodisch konnten wir durch Digitalisierung der veröffentlichten Überlebenskurven die Daten individueller in die jeweilige Studie eingebrachter Patient:innen eruieren. Dadurch waren wir in der Lage, verschiedene Analysen inklusive Metaanalysen vorzunehmen.2
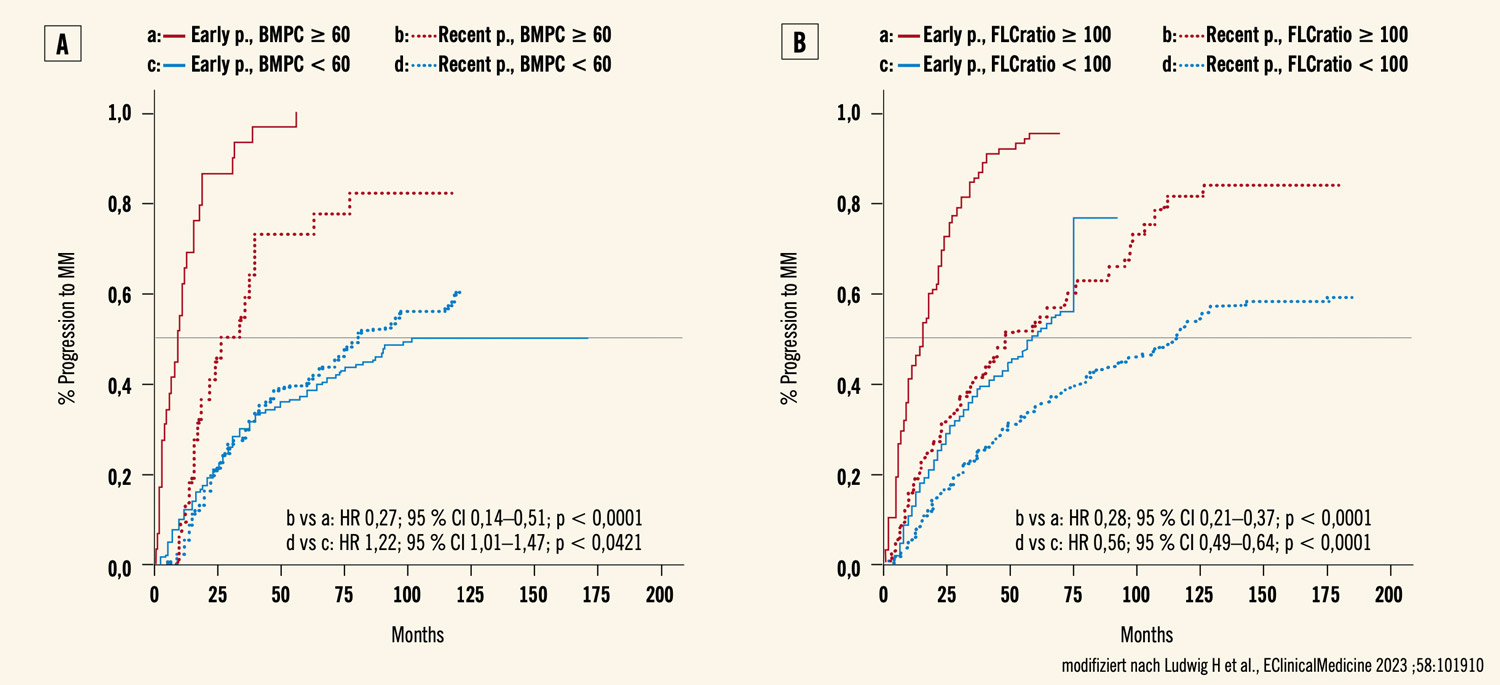
Abb. 1: KM-Kurven gemäß älterer (bis 2014) und rezenter Daten (nach 2014): A: Patient:innen mit ≥ 60 % vs. < 60 % Plasmazelleninfiltrati- on; B: Patient:innen mit freier Leichtketten-Ratio ≥ 100 vs. < 100
Verlängerung der Zeit bis zur Progression um das Dreifache: Unsere Untersuchungen zeigen eine eindrucksvolle Verbesserung der Prognose von SLiM- CRAB-positiven Patient:innen mit ≥ 60 % BMPC sowie von solchen mit einer FLC-Ratio ≥ 100 (Abb. 1). Die mediane Zeit bis zur Progression der erstgenannten Patientengruppe hat sich in den rezenten Studien von 9,2 auf 30,3 Monate verdreifacht (Abb. 2), während sich das Risiko für Progression zum Zeitpunkt 2 Jahre von 86,2 % in der frühen auf 45,5 % in der rezenten Periode reduzierte (Abb. 3). Eine ähnliche Veränderung wurde auch für Patient:innen mit einer FLC-Ratio ≥ 100 beobachtet. Die entsprechenden Zahlen liegen bei 15,3 vs. 48 Monaten bzw. bei 73 % und 31 % (Abb. 2 und 3). Interessanterweise wurden nach 2014 keine weiteren Analysen über die prognostische Relevanz von mittels MR detektierten fokalen Skelettläsionen veröffentlicht, weshalb wir diesbezüglich keine Vergleiche zwischen älteren und neueren Daten durchführen konnten.2
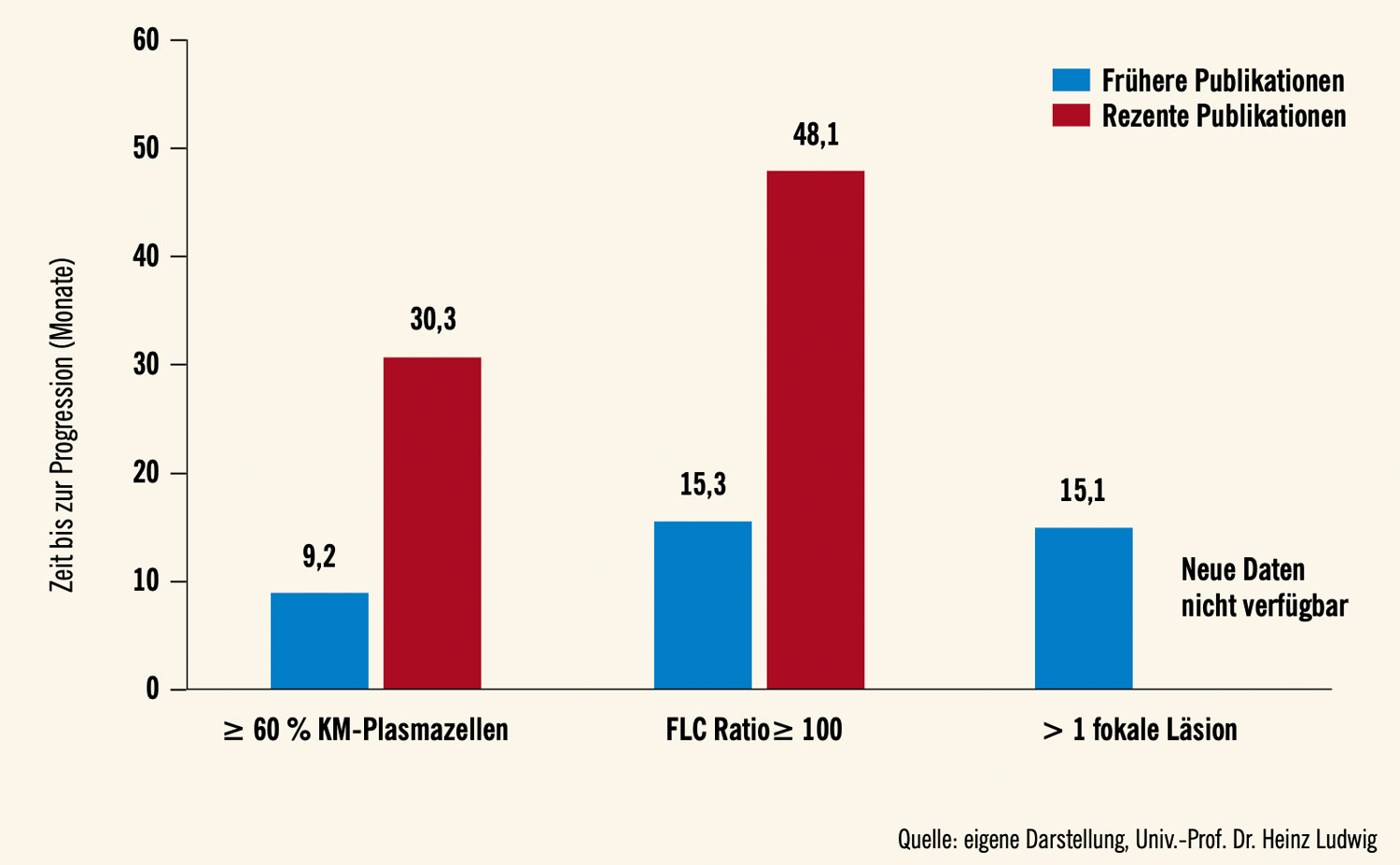
Abb. 2: Zeit bis zur Progression (Median) bei Patient:innen der verschiedenen diagnostischen Kategorien gemäß älterer (bis 2014) und rezenter Daten (nach 2014)
„Stage Migration“ über die Zeit ist die wahrscheinliche Haupterklärung für bessere Prognose: Die dramatische Verbesserung der prognostischen Situation von Patient:innen mit SliM-CRAB-positivem MM mit ≥ 60 % BMPC oder einer FLC-Ratio ≥100 in rezenten Studien ist am ehesten auf ein sogenanntes Stadium-Migrationsphänomen zurückzuführen.
Heute werden Patient:innen mit dieser Diagnose modernen Bildgebungsverfahren (MR, PET/CT oder low dose CT) unterzogen. Damit werden etwa 20–30 % mehr Patient:innen mit Skelettmanifestation diagnostiziert, als früher mittels konventioneller Radiographie möglich war. Somit verblieben in den älteren Publikationen viele Patient:innen mit nicht erkannten Skelettmanifestationen in der Gruppe der SMM, was die Prognose der jeweiligen Gesamtgruppe der einbezogenen Patient:innen deutlich verschlechtert hat. Weiters ist in der rezenten Periode die Leichtkettenuntersuchung in das Standardlaborspektrum aufgenommen worden, womit auch mehr good risk-Patient:innen diagnostiziert wurden.2
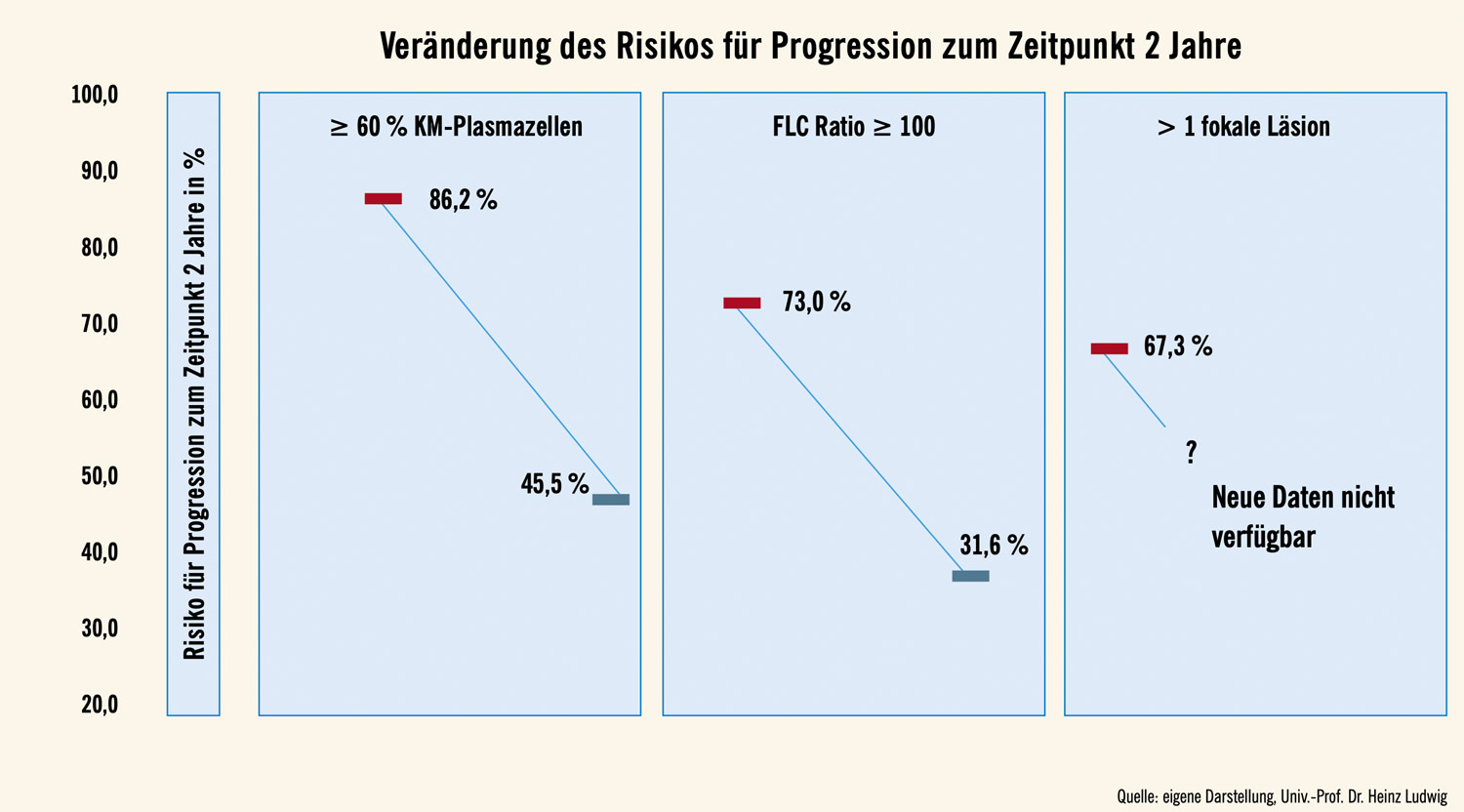
Abb. 3: Rate an Progressionen zum Zeitpunkt 2 Jahre bei Patient:innen der verschiedenen diagnostischen Kategorien gemäß älterer (bis 2014) und rezenter Daten (nach 2014)
Expertenreaktion auf die neue Datenlage
Interessanterweise wurden diese neuen Ergebnisse von Myelomexpert:innen sehr unterschiedlich aufgenommen. Viele Expert:innen begrüßen die Ergebnisse unserer Analyse, die nun endlich eine wissenschaftliche Grundlage für ihr intuitiv gewähltes Vorgehen in der klinischen Praxis liefern und bestätigen, dass ihre Empfehlungen im Einklang mit der neuen Datenlage stehen. Im Gegensatz zu diesen Kolleg:innen versuchen Vertreter:innen einer frühen Therapieeinleitung die neuen Fakten in Frage zu stellen bzw. zu negieren. Eine offene Diskussion der neuen Datenlage würde die Sinnhaftigkeit der laufenden Studien mit intensiven Therapiekonzepten oder langdauernden Behandlungen bei SLiM- CRAB-MM in Frage stellen, da aus heutiger Sicht eine Heilung unwahrscheinlich erscheint, wie auch die rezenten Ergebnisse bei der CLL nahelegen.
Verlängerung des PFS oder Heilung?
Unbestritten bleibt, dass mit einem frühzeitigen Behandlungsbeginn die Zeit bis zur Progression verlängert werden kann. Legt man die Ergebnisse bei der CLL diesen Überlegungen zugrunde, muss davon ausgegangen werden, dass dieser Vorteil einer längeren ersten progressionsfreien Überlebenszeit nach dem Auftreten einer Progression verloren geht, da bei vorbehandelten Patient:innen eine Rezidivtherapie mit einem kürzeren PFS verbunden ist als bei zuvor unbehandelten Patient:innen. Dies erklärt auch, warum das deutlich längere PFS nach autologer Stammzelltransplantation (ASZT) zu keinem längeren Überleben führt. Sowohl die französische IFM 20093 als auch die amerikanische Determination-Studie4 konnten keinen Überlebensvorteil zwischen einer Hochdosistherapie mit anschließender ASZT und einer konventionellen Myelomtherapie nachweisen. In beiden Studien konnte aber ein signifikant verlängertes PFS in der ASZT-Gruppe mit Beginn der Initialtherapie festgestellt werden. Das PFS2 war allerdings bei den transplantierten und nicht-transplantierten Patient:innen gleich. Anders ausgedrückt war nach Rezidiv das PFS bei den transplantierten Patient:innen kürzer als bei der konventionell behandelten Gruppe und damit auch das OS beider Gruppen fast identisch.
Symptomfreiheit macht den Unterschied
Die wesentlichen Unterschiede zwischen Patient:innen mit MM und jenen mit SLiM-CRAB-MM liegen darin, dass letzt- genannte Gruppe symptomfrei ist und manchmal über lange Zeit keine und ein kleiner Teil sogar überhaupt keine Myelomtherapie benötigt. Hier kommt die ethische Verantwortung jener Ärzt:innen, die zu einem frühzeitigen Behandlungsbeginn raten, zum Tragen. Mit welcher vermeintlichen Perspektive versuchen sie, Patient:innen mit SLiM-CRAB-MM die Notwendigkeit einer Therapieeinleitung zu erläutern oder sie zur Teilnahme an Behandlungsstudien zu motivieren? Sollte hier eine mögliche Heilung als Therapieziel angeführt werden, so fehlt dafür die wissenschaftliche Grundlage.
Bedeutung der neuen Fakten für Patient:innen
Für viele Patient:innen mit SLiM-CRAB- positivem MM bedeuten die neuen Erkenntnisse eine massive Erleichterung, da z. B. im Falle einer erhöhten FLC-Ratio ≥ 100 die mediane Zeit bis zur Progression 4 Jahre beträgt, wobei bei etwa 20 % solcher Patient:innen die befürchtete Progression im Laufe ihres Lebens überhaupt nicht eintritt. Den Betroffenen bleiben somit die frühe Stigmatisierung als Tumorpatient:in und die oft beträchtlichen Nebenwirkungen einer intensiven Behandlung erspart, sie verbleiben in ihrem gewohnten Lebensumfeld bzw. im Arbeitsprozess und können ihrem Tätigkeitsspektrum voll nachkommen. Last, but not least kommt es zu einer Reduktion der Therapiekosten, wodurch das Gesundheitssystem entlastet wird.
Fazit für die Praxis
Aufgrund der neuen Datenlage sollen Patient:innen, die den diagnostischen Kriterien eines SLiM-CRAB-positiven MM sowie jene mit SMM zum Diagnosezeitpunkt nach modernen Kriterien evaluiert werden. Dies inkludiert zusätzlich zu den bei monoklonalen Gammopathien üblichen serologischen Befunden (Elektrophorese, freie Leicht- ketten, Immunglobuline quantitativ) eine Untersuchung auf 24-Stunden-Proteinurie (und gegebenenfalls eine Urinelektrophorese), eine Knochenmarkbiopsie inklusive Immunphänotypisierung, FISH-Analyse an CD138- selektionierten Plasmazellen sowie ein modernes bildgebendes Verfahren zum Nachweis von Skelettläsionen (am besten Ganzkörper-MR; alternativ PET/ CT oder Ganzkörper-low dose CT). Im Falle eines Hochrisiko-SMM oder eines SLiM-CRAB-positiven MM sollte der oder die Patient:in sorgfältig nachkontrolliert werden. Dabei ist besonderes Augenmerk auf „evolving“ Parameter – wie ansteigende M-Komponente, abfallendes Hb und Anstieg der GFR – zu legen. Sollte eine kontinuierliche Dynamik erkennbar sein, so ist dies als klarer Hinweis für eine Therapieeinleitung zu interpretieren.






















































































