Künstliche Intelligenz in der Urochirurgie
Der Begriff künstliche Intelligenz (KI) hat sich in den letzten Jahren als Schlagwort in allen Bereichen des täglichen Lebens, so auch in der Medizin, etabliert. Insbesondere in der Wissenschaft zeigt sich seit circa Anfang der Jahrtausendwende ein nahezu exponentieller Anstieg der Publikationen auf MEDLINE zu diesem Thema. Gleichzeitig ist eine klare Abgrenzung zu verwandten Themen mitunter schwierig, sodass eine Vielzahl an Begriffen wie z. B. neuronale Netze, Machine Learning, Automatisierung oder Deep Learning oftmals (zu Unrecht) als Synonyme verwendet werden. In der kürzeren Vergangenheit hat sich daher der Terminus „intelligent systems“ (intelligente Systeme) etabliert. Hierbei werden alle Systeme subsumiert, die sich dadurch auszeichnen, dass sie mit ihrer Umgebung interagieren können, über kognitive Eigenschaften verfügen und die Fähigkeit haben, sich durch Erfahrung anzupassen.1
Die verschiedenen Applikationen der KI haben entlang des gesamten Behandlungspfades Einzug gehalten (Abb. 1). Dies umfasst v. a. die präoperative Bildgebung z. B. mittels Radiomics2, die histopathologische Befundung3 oder die Vorhersage eines Tumorrezidivs basierend auf Machine-Learning-Modellen4. Während in diesen Bereichen beachtliche Fortschritte erzielt wurden, hinkt die Implementierung der KI im perioperativen Bereich hinterher.
Um die besonderen Herausforderungen und Grundlagen für eine KI-gestützte Urologie und Urochirurgie soll es im Folgenden gehen.
Herausforderungen der KIin der Urochirurgie
Gründe für die erfolgreiche Implementierung der KI in den Bereichen Bildgebung und Histopathologie sind, dass die erforderlichen Daten im Rahmen der Routineversorgung erhoben werden und als nichtdynamische Daten in Form von Bilddaten oder histologischen Schnitten vorliegen. Diese Daten können dann genutzt werden, um Modelle basierend auf unterschiedlichen Algorithmen (Random Forests, neuronale Netze, Support Vector Machines) zu trainieren und zu optimieren.6 Im Vergleich dazu werden wertvolle perioperative Daten im Operationssaal nicht standardmäßig aufgezeichnet. Hinzu kommt, dass der Operationssaal nach wie vor ein besonderes Arbeitsfeld darstellt, mit potenziell stress-beladenen Situationen, Interaktionen der verschiedenen Teammitglieder und dem sterilen OP-Feld. Zudem hat der Operationssaal in den letzten Dekaden an Komplexität durch die Integration moderner Medizinprodukte deutlich zugenommen (Abb. 2A). Um die anfallenden Daten all dieser Komponenten im OP nun nutzen zu können, müssen diese nicht mehr als voneinander unabhängige Entitäten verstanden, sondern jeweils als einzelner Sensor aufgefasst werden, und diese Sensoren bilden ganzheitlich den Ablauf der Operation ab (Abb. 2B). Exemplarisch kann hier der intraabdominelle Druck im Rahmen minimalinvasiver Operationen angeführt werden. Ein höherer Druck kann als Surrogat für eine Blutung dienen, da zur besseren Blutungskontrolle passager der Druck auf 20 mmHg angehoben werden kann. Ebenso können die Neigung des OP-Tisches oder die Saalbeleuchtung einen Einfluss auf die aktuelle Operationsphase haben. Analog zur Nutzung der Daten aus der Radiologie und Histopathologie können diese Daten nun in die Modelle eingespeist werden.
Durch dieses Vorgehen entstehen erneut Herausforderungen sowohl aus medizinischer als auch technischer Sicht. Aus medizinisch-chirurgischer Perspektive ist anzuführen, dass eine Vergleichbarkeit aufgrund verschiedener chirurgischer Techniken sowohl zwischen verschiedenen Kliniken als auch zwischen Chirurg:innen nur eingeschränkt möglich ist. Zudem ist eine langfristige Nachsorge und somit eine vollständige und hohe Datenqualität im klinischen Alltag nicht einfach umzusetzen. Aus technischer Perspektive muss evaluiert werden, wie gewährleistet wird, dass die Daten überhaupt abgegriffen und aufgezeichnet und zudem standardisiert und sicher gespeichert werden können. Die abschließende Prozessierung der Daten, um sie in die Modelle einzulesen, stellt einen weiteren ressourcenintensiven Schritt dar. Für diese Herausforderungen hat sich mit „Surgical Data Science“ mittlerweile ein eigener Forschungszweig etabliert.7, 8 Damit eine interdisziplinäre Zusammenarbeit zwischen Chirurgie und Computerwissenschaften ermöglicht wird, müssen zunächst Datensätze generiert werden, die als Arbeitsgrundlage zur Erstellung dienen können.9
Sollten sich die gegenwärtigen Limitationen überwinden lassen, haben vorige Arbeiten aus Simulationsstudien das Potenzial und die Effektivität der KI auch für die operative Versorgung belegt. So konnte gezeigt werden, dass durch die Integration von Sensoren an den chirurgischen Instrumenten eine Aufzeichnung von metrischen Parametern wie z. B. der Geschwindigkeit der Instrumente oder der Bewegungskurven mitsamt Pfadlänge möglich ist.10 Basierend auf diesen Parametern konnte zudem eine eindeutige Zuordnung in eine Erfahrungsgruppe (Beginner, Intermediate, Experte) für einfache chirurgische Fertigkeiten wie das Nähen und Knoten getroffen werden. In einer weiteren Studie wurde die Muskelaktivität von Operierenden mithilfe eines EMG der Unterarme gemessen.11 Ziel war die Vorhersage der aktuellen Operationsphase basierend auf den EMG-Daten. Hierbei haben sich initial unter Nutzung der Rohdaten ernüchternde Ergebnisse gezeigt. Nachdem die Daten durch Methoden aus dem Bereich „Surgical Data Science“ weiter prozessiert wurden (z. B. mittels Dynamic Time Warping), um die Aufnahmen vergleichbarer zu machen und für unterschiedliche Aufnahmegeschwindigkeiten zu adjustieren, konnte eine verlässliche Vorhersage der aktuellen Operationsphase erreicht werden.
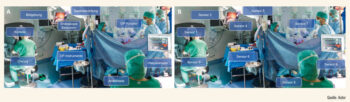
Abb. 2: Urologischer OP Mannheim: Sensorerfassung der einzelnen Medizinprodukte während der Operation
Fazit: (arbeitsintensives) Potenzial
Abschließend lässt sich konstatieren, dass die KI in der Urochirurgie auch im perioperativen Bereich ein großes Potenzial birgt. Dennoch liegt für eine flächendeckende Integration viel Arbeit vor uns, und grundlegende Voraussetzungen im Bereich Datenstandardisierung und -sicherheit sowie bei der Definition klinischer und patientenrelevanter Endpunkte müssen geschaffen werden.