Primär- und Sekundärprävention
Lipidstoffwechselstörungen gehören neben arterieller Hypertonie, Rauchen, Adipositas und Glukosestoffwechselstörungen zu den wichtigsten Risikofaktoren für die Entstehung von atherosklerotischen Erkrankungen.
Ab dem 40. Lebensjahr sollen ein Lipidstatus und ein kardiovaskuläres Risikoscreening durchgeführt werden, bei Verdacht auf Diabetes mellitus oder familiäre Hypercholesterinämie (FH) schon früher. Ein Lipidstatus besteht aus Gesamtcholesterin, Low-Density-Lipoprotein-Cholesterin (LDL-C), High-Density-Lipoprotein-Cholesterin (HDL-C) und Triglyzeriden (TG). Es soll auch zumindest einmal im Leben Lipoprotein(a) (Lp[a]) bestimmt werden. Die Cholesterinzielwerte ergeben sich aus dem kardiovaskulären Gesamtrisiko.
Risikostratifizierung
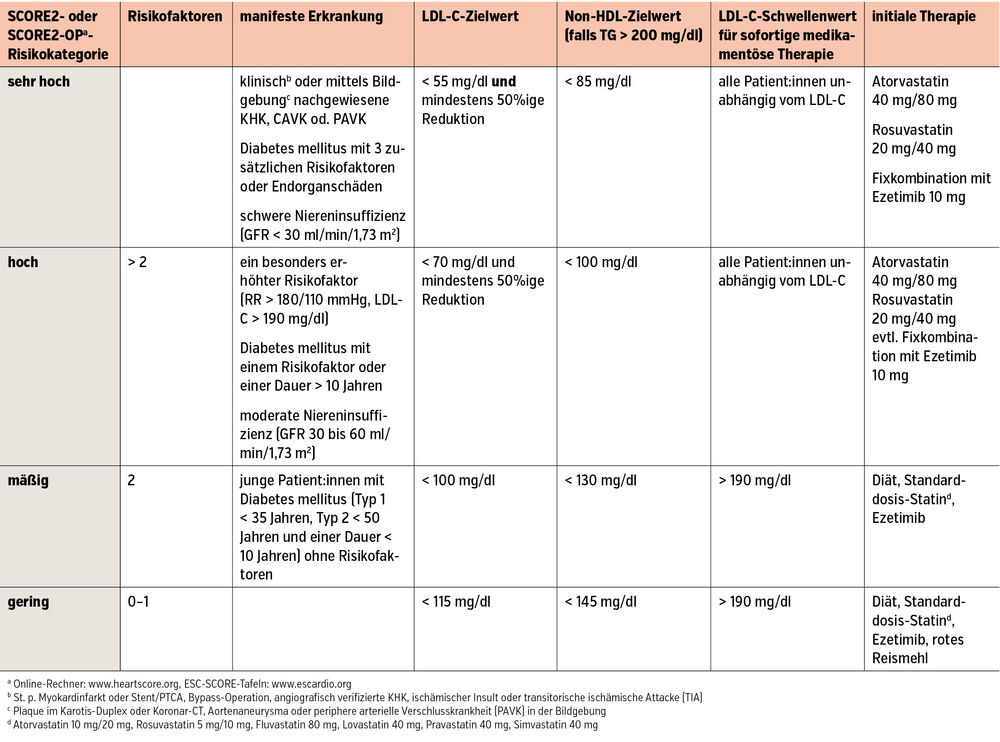
Patient:innen mit kardiovaskulärer Erkrankung in der Anamnese oder atherosklerotischen Plaques in der Bildgebung (Karotis-Duplex, Koronar-CT) haben ein sehr hohes, Patient:innen mit Diabetes mellitus oder chronischer Niereninsuffizienz haben ein sehr hohes oder hohes kardiovaskuläres Risiko (Tab. 1) und somit einen LDL-C-Zielwert von < 55 mg/dl bzw. < 70 mg/dl. Falls das LDL-C >190 mg/dl oder der Blutdruck > 180/100 mmHg ist, besteht auch ein hohes Risiko und somit ein LDL-C-Zielwert < 70 mg/dl. Bei allen anderen Personen soll das individuelle kardiovaskuläre Risiko mittels der SCORE2- und der SCORE2-OP-Tabellen bestimmt werden. Eine positive Familienanamnese, eine chronische inflammatorische Erkrankung, Schlafapnoe oder eine psychiatrische Erkrankung erhöhen das kardiovaskuläre Risiko. Bei intermediärem Risiko kann ein Karotis-Duplex oder ein koronares Kalzium-Scoring durchgeführt werden. Falls der Agatston-Score über der 75. Altersperzentile oder > 100 ist, besteht eine Indikation zur Statin-Therapie.
Zielwerte
Bei den Zielwerten ist primär das LDL-C wichtig (Tab. 1), bei TG > 200 mg/dl oder bei Diabetiker:innen das Non-HDL-C (Gesamtcholesterin minus HDL-C), da bei hohen TG auch das Cholesterin der TG-reichen Lipoproteine atherogen wirkt. Der Zielwert des Non-HDL-C liegt immer 30 mg/dl über dem Zielwert für das LDL-C. HDL-Ratios dürfen nicht mehr zur Risikostratifizierung oder als Therapieziel herangezogen werden. Bei allen Hochrisiko-Patient:innen muss das LDL-C um zumindest 50 % gesenkt werden. Dies bedeutet z. B., dass Patient:innen mit koronarer Herzerkrankung unabhängig vom LDL-C zumindest ein Hochdosis-Statin erhalten müssen.
Ernährung
Bei Hochrisiko-Patient:innen muss sofort mit einer medikamentösen Therapie begonnen werden. Bei Patient:innen mit intermediärem oder geringem Risiko sollen primär Diät und körperliche Aktivität empfohlen werden. Cholesterin ist nur in tierischen Produkten enthalten. Der Konsum von gesättigten Fettsäuren (Wurst, fettes Fleisch, Vollmilchprodukte, fette Käsesorten, Palm- und Kokosnussöl) soll reduziert und jener von ungesättigten Fettsäuren (Fisch, pflanzliche Fette, Nüsse) sowie von Ballaststoffen (Vollkornprodukte, Hülsenfrüchte, Gemüse, Obst) soll gesteigert werden. Auch Nahrungsergänzungsmittel mit rotem Reismehl (ca. 2,5 mg bis 10 mg Monacolin K pro Tag) können bei Patient:innen mit niedrigem Risiko als Bestandteil der Diät verwendet werden und das LDL-C um 10 % bis 20 % senken. Falls nach drei Monaten weiterhin die angegebenen Schwellenwerte (Tab.1) überschritten werden, soll eine medikamentöse Therapie eingeleitet werden.
Medikamentöse Therapie
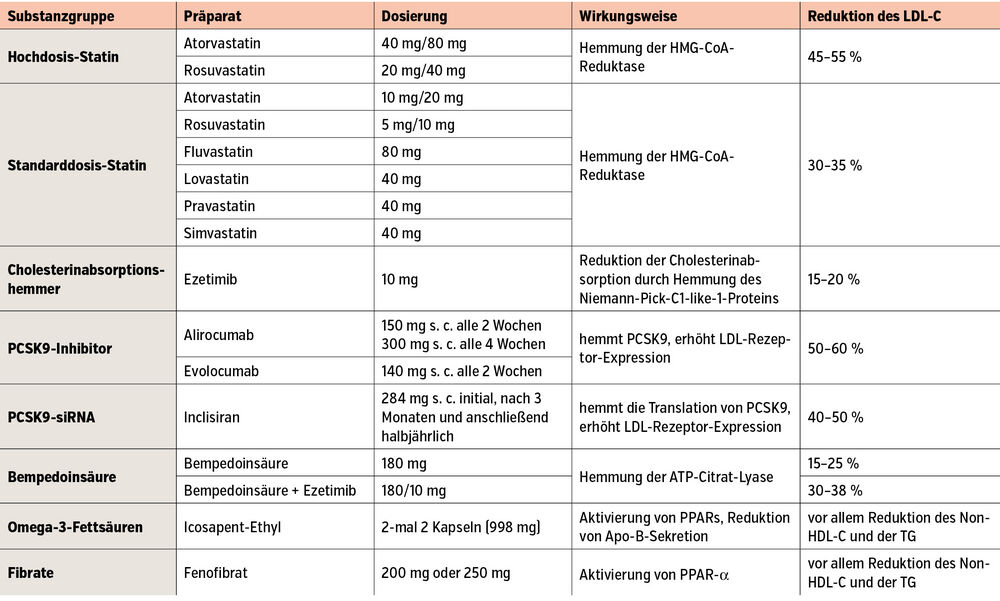
Statine. Statine hemmen die Cholesterinsynthese der Leber. Hochdosis-Statine (Tab.2) senken den LDL-C-Wert im Mittel um 45 % bis 55 % und sind Erstlinientherapie bei Patient:innen mit hohem oder sehr hohem kardiovaskulärem Risiko. Eine Reduktion des LDL-C um 40 mg/dl führt zu ca. 23 % relativer Reduktion der kardiovaskulären Ereignisrate. Bei 0,5 % bis 2 % kommt es zu einem Anstieg der Leberenzyme, weshalb empfohlen wird, die Leber- und Cholesterinwerte 8 Wochen nach Beginn einer Statintherapie zu kontrollieren.
Ezetimib. Ezetimib ist ein nebenwirkungsarmer Hemmer der Cholesterinresorption in der Darmwand und senkt das LDL-C in der Monotherapie und in Kombination mit Statinen um ca. 15 % bis 20 %. Studien haben gezeigt, dass bei Patient:innen mit hohem oder sehr hohem Risiko meist eine Kombinationstherapie aus Hochdosis-Statin und Ezetimib notwendig ist. Ein primärer Beginn mit der Fixkombination erhöht die Compliance und ist meist sehr gut verträglich.
Bempedoinsäure. Die Bempedoinsäure hemmt die Cholesterinsynthese einen Schritt oberhalb der Statine und senkt das LDL-C um ca. 15 % bis 25 % als Monopräparat und um bis zu 38 % in Kombination mit Ezetimib. Im CLEAR Outcomes Trial führte die Behandlung mit Bempedoinsäure zu einer signifikanten Reduktion des kardiovaskulären Endpunktes. Im Gegensatz zu den Statinen ist die Bempedoinsäure ein Prodrug und wird nur in den Hepatozyten aktiviert. Dies führt zu einer geringeren Inzidenz an muskulären Nebenwirkungen. Eine Nebenwirkung ist der Anstieg der Harnsäure, da Bempedoinsäure-Metaboliten mit dieser um renale Transporter konkurrieren. Bempedoinsäure wird bei Patient:innen mit hohem oder sehr hohem kardiovaskulärem Risiko erstattet, wenn der Zielwert nicht erreicht wird.
PCSK9-hemmende Substanzen. Die PCSK9-Hemmer Alirocumab (150 mg alle zwei oder 300 mg alle vier Wochen s. c.) und Evolocumab (140 mg alle zwei Wochen s. c.) sind monoklonale Antikörper gegen PCSK9, senken das LDL-C um 50 % bis 60 %, haben in Studien die Rate von kardiovaskulären Ereignissen signifikant reduziert und sind sehr nebenwirkungsarm. Inclisiran ist eine kleine interferierende RNA (siRNA), welche die Translation des Proteins PCSK9 spezifisch in den Hepatozyten hemmt. Inclisiran senkt das LDL-C um ca. 40 % bis 50 % und ist auch sehr gut verträglich. Nachdem die erste und zweite Dosis in einem Abstand von 3 Monaten verabreicht werden, ist nur alle 6 Monate eine subkutane Injektion notwendig, dadurch kann möglicherweise die langfristige Adhärenz optimiert werden. Die Erstverordnung der PCSK9-hemmenden Substanzen erfolgt in Österreich in speziellen Zentren, und sie werden bei Patient:innen mit manifester atherosklerotischer Erkrankung und einem LDL-C > 70 mg/dl unter einer Kombinationstherapie aus maximal verträglichem Statin und Ezetimib erstattet.
Spezielle Patientengruppen
Lipoprotein(a)-Erhöhung. Der Lp(a)-Spiegel ist genetisch determiniert und kann nicht durch Diät oder Statintherapie reduziert werden. Ab Werten > 50 mg/dl (> 125 nmol/l) kommt es zu einer kontinuierlichen Erhöhung des kardiovaskulären Risikos. Abhängig vom gesamten kardiovaskulären Risiko soll bei einer Erhöhung des Lp(a) durch Reduktion des LDL-C das lipidabhängige Risiko reduziert werden. Der EAS Consensus empfiehlt, bei Patient:innen mit niedrigem oder moderatem Risiko und einem Lp(a)-Wert von > 100 mg/dl (> 250 nmol/l) eine Statin-Therapie einzuleiten. Subgruppen-Analysen konnten zeigen, dass Patient:innen mit kardiovaskulärer Erkrankung und Erhöhung des Lp(a) von einer Therapie mit PCSK9-Hemmern besonders profitieren. Zurzeit sind mehrere moderne Substanzen mit Antisense- bzw. siRNA-Technologie zur Lp(a)-Senkung in klinischer Erprobung.
Erhöhung der Triglyzeride. Im Gegensatz zu einer Erhöhung des LDL-C ist eine Erhöhung der TG oft sekundär bedingt und kann durch Diät, Gewichtsabnahme, Alkoholabstinenz und Sport bzw. durch Verbesserung einer diabetischen Stoffwechsellage verbessert werden. Bei Hochrisiko-Patient:innen mit TG > 200 mg/dl soll versucht werden, mit einer Statintherapie ein Non-HDL-C-Ziel von < 85 mg/dl bzw. < 100 mg/dl zu erreichen. Hochdosierte Fischöl-Supplemente (2–4 g/Tag) beeinflussen die TG-Konzentration.
Ob Omega-3-Fettsäuren kardiovaskuläre Ereignisse reduzieren, ist umstritten. Icosapent-Ethyl ist ein stabiler Ethylester der Omega-3-Fettsäure Eicosapentaensäure. In der REDUCE-IT-Studie konnte bei Patient:innen mit erhöhten TG und kardiovaskulärer Erkrankung oder Diabetes mellitus der kardiovaskuläre Endpunkt reduziert werden. Für Fibrate konnte zuletzt keine sichere kardiovaskuläre Risikoreduktion nachgewiesen werden. Fenofibrat kann bei TG > 200 mg/dl und Non-HDL über dem Zielbereich zu Rosuvastatin oder Atorvastatin kombiniert werden, wenn diese nicht in der Höchstdosis verabreicht werden. Gemfibrozil soll nicht mit Statinen kombiniert werden.
Heterozygote FH. Bei Patient:innen mit positiver Familienanamnese und einem LDL-C > 190 mg/dl oder > 100 mg/dl unter Hochdosis-Statin muss an eine heterozygote FH gedacht werden. Die FH ist die häufigste monogenetische Erbkrankheit (1 : 200 bis 1 : 500) und mit einem massiv erhöhten kardiovaskulären Risiko assoziiert. Patient:innen mit Verdacht auf FH müssen zumindest einen LDL-C-Zielwert von < 70 mg/dl erreichen und sollen an ein spezialisiertes Zentrum überwiesen werden.
Statinunverträglichkeit. Studien haben gezeigt, dass nur 5 % bis 10 % der Patient:innen eine echte Statinunverträglichkeit haben. Die klinischen Manifestationen einer Statinunverträglichkeit sind sehr heterogen und reichen von leichter Schwäche, Krämpfen und Muskelschmerzen bis hin zur extrem seltenen schweren Rhabdomyolyse. Die häufigste Form sind Muskelschmerzen mit oder ohne leichte Erhöhung der Kreatinkinase. Das dauerhafte Absetzen des Statins in der Sekundärprävention ist einer der wichtigsten Risikofaktoren für ein neuerliches kardiovaskuläres Ereignis, weshalb klinisch beobachtet werden soll, ob sich die Muskelbeschwerden nach Absetzen des Statins wirklich bessern und nach Therapie mit mindestens einem weiteren modernen Statin in mittlerer Dosierung neuerlich auftreten. Außerdem wird empfohlen, Ezetimib mit einer niedrigeren Statindosis und mit Bempedoinsäure zu kombinieren. Wenn in der Sekundärprävention Atorvastatin und Rosuvastatin nicht vertragen werden und der LDL-C-Wert trotz Ezetimib über 55 bis 70 mg/dl liegt, sollten die Patient:innen an ein Zentrum zur Verordnung einer PCSK9-hemmenden Substanz überwiesen werden.