Die Therapie der Herzinsuffizienz ist derzeit stark durch die linksventrikuläre Auswurffraktion bestimmt. Für die Herzinsuffizienz mit reduzierter Auswurffraktion (HFrEF, LVEF ≤ 40%) ist die so genannte Vier-Säulen-Therapie mit Sacubitril/Valsartan, Betablocker, Mineralokortikoidrezeptor-Antagonist und SGLT2-Inhibitor vorgesehen. Für Patient:innen mit erhaltener Auswurffraktion (HFpEF, LVEF ≥50%) hat sich bislang nur der SGLT2-Inhibitor durchgesetzt und für die Zwischengruppe mit leicht reduzierter Auswurffraktion (HFmrEF, LVEF 41–49%) ebenfalls der SGLT2-Inhibitor sowie mit schwachem Empfehlungsgrad die drei anderen Säulen der HFrEF-Therapie. Diese Basistherapie ist vor allem zur Reduktion der Sterberate und der hohen Spitalsaufnahmerate vorgesehen. Da Herzinsuffizienz eine Sterberate ausweist, die höher als bei den meisten Krebserkrankungen ist, liegt hier der Hauptfokus. Die Lebensqualität ist jedoch ebenfalls bei Herzinsuffizienz deutlich niedriger als zum Beispiel bei anderen kardialen Erkrankungen. Hier spielen Komorbiditäten und deren spezifische Aspekte bei Herzinsuffizienz eine große Rolle. Eisenmangel bei Herzinsuffizienz ist ein gutes Beispiel dafür.
Folgen des Eisenmangels
30–50 % aller Herzinsuffizienzpatient:innen haben einen Eisenmangel, je schwerer die Herzinsuffizienz, desto wahrscheinlicher wird das Auftreten eines Eisenmangels. Der Eisenmangel hat Auswirkungen einerseits in Verbindung mit einer Anämie und den damit assoziierten reduzierten Sauerstofftransport durch die roten Blutkörperchen, und andererseits wirkt sich der Eisenmangel über eine verminderte Sauerstoffverwertung in den Mitochondrien der Skelettmuskulatur negativ aus. Dadurch verstärken sich Symptome wie reduzierte Leistungsfähigkeit und Atemnot bei Belastung – und zwar unabhängig vom Vorhandensein einer Anämie.
Was sind die Ursachen?
Die Hauptursachen für Eisenmangel bei Herzinsuffizienz sind chronische Inflammation, verminderte gastrointestinale Resorption, medikamentös induzierter chronischer enteraler Blutverlust (Plättchenhemmer, orale Antikoagulation) und Mangelernährung. Die ersten beiden Mechanismen hängen stark miteinander zusammen. Vor allem durch gastrointestinale Stauung kommt es zur Permigration von Darmbakterien in den Blutkreislauf mit nachfolgender Aktivierung der Zytokin-Kaskade. Im Rahmen dessen wird unter anderem auch Hepcidin hochreguliert, das die weitere Eisenresorption im Darm blockiert. Daraus ergibt sich nicht nur der Eisenmangel selbst, sondern auch die Konsequenz, dass eine orale Eisensubstitution bei chronischer Herzinsuffizienz ohne Effekt bleiben muss.
Welche Form der Eisensubstitution?
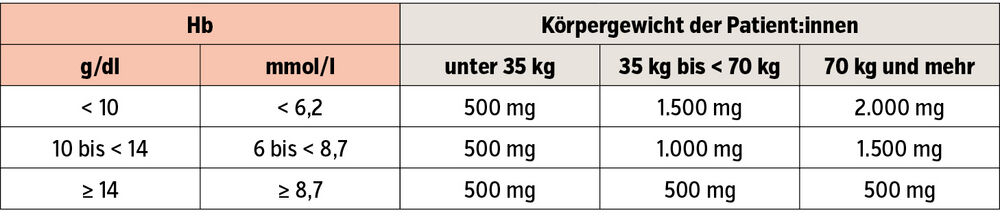
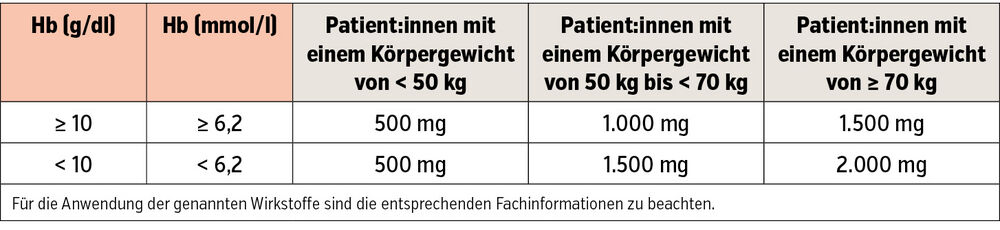
Aufgrund der beschriebenen Ursachen für den Eisenmangel ist die Eisentherapie bei Herzinsuffizienz eine Domäne der Eiseninfusionen. Hier haben sich zwei Eisenpräparationen durchgesetzt: Eisencarboxymaltose und Eisen(III)-Derisomaltose. Beide Substanzen haben den Vorteil, dass hohe Einzeldosen (bis zu 1g) innerhalb von 15 Minuten verabreicht werden können, die Dosierung der i. v. Eisengabe wird anhand von Hämoglobin-Wert und Körpergewicht bestimmt (Tab. 1, 2).
Herzinsuffizienz und i. v. Eisentherapie
Die meiste Evidenz gibt es für Herzinsuffizienz mit reduzierter Auswurffraktion, zumindest < 50 %. Für Eisencarboxymaltose gibt es Studien, die eine deutliche Verbesserung der NYHA-Klasse, der Lebensqualität und der Gehstrecke im 6-Minuten-Gehtest gezeigt haben. Seit circa 10 Jahren wird darüber spekuliert, ob eine i. v. Eisentherapie bei Herzinsuffizienz auch Hospitalisierungen oder Todesfälle reduzieren kann. Dies konnte jedoch bislang nicht überzeugend nachgewiesen werden. Im AFFIRM-HF Trial wurde der primäre Endpunkt, bestehend aus allen Hospitalisierungen aufgrund von Herzinsuffizienz und dem kardiovaskulären Tod erst signifikant, nachdem der Anteil der Studienperiode, der in die Zeit der COVID-19-Pandemie fiel, ausgeklammert wurde. Im IRONMAN Trial verfehlte Eisen(III)-Derisomaltose beim gleichen Endpunkt ebenfalls knapp die Signifikanz. Im HEART-FID Trial mit über 3.000 Patient:innen konnte Eisencarboxymaltose ebenfalls den kombinierten Endpunkt aus kardiovaskulärem Tod und Hospitalisierungen aufgrund von Herzinsuffizienz nicht signifikant senken. Aufgrund von positiven Subanalysen ist die Senkung der Hospitalisierungsrate durch i. v. Eisen in den aktuellen Guidelines dennoch erwähnt.
Fazit
Eine i. v. Eisen-Therapie bei Herzinsuffizienz mit einer Auswurffraktion von < 50 % kann deutliche Effekte auf die Lebensqualität und Leistungsfähigkeit haben. Bezüglich Effekte auf traditionelle Endpunkte wie Spitalsaufnahmerate oder Sterberate besteht derzeit Unsicherheit.