Neue Management-Empfehlungen
Die neue KDIGO-(Kidney-Disease-Improving-Global-Outcomes-)Guideline basiert auf mehreren hochwertigen prospektiven Studien, die den Nutzen neuer pharmakologischer Interventionen belegen. Diese Studien zeigen nicht nur ein deutliches nephroprotektives Potenzial neuer Substanzen, sondern auch, dass sie zur signifikaten Reduktion des kardiovaskulären Risikos bei Patient:innen mit chronischer Nierenerkrankung (CKD) beitragen. Neu sind auch eine individuelle, risikobasierte Prognoseabschätzung sowie eine verbesserte CKD-Diagnostik, die unter anderem die Empfehlung zur Verwendung von Cystatin C sowie der Albumin-Kreatinin-Ratio (ACR) insbesondere für Screening, Diagnose und Management der CKD einschließt.
Risikogruppen identifizieren
Maßgebend ist ein ganzheitlicher Betreuungsansatz, indem eine Vielzahl von Empfehlungen, Praxisempfehlungen und Kommentaren vorgestellt werden. Besondere Aufmerksamkeit gilt der differenzierten Betrachtung von Risikogruppen, Patientensubgruppen und dem Patientenfluss. Hauptziel ist es, Ärzt:innen eine praxisnahe Orientierung zu bieten, um CKD-Patient:innen individuell und bestmöglich in ihrem Krankheitsverlauf zu begleiten.
Bei der Evaluation einer chronischen Nierenerkrankung (CKD) sollten die Ursache (Cause), die glomeruläre Filtrationsrate (GFR) und die Albuminurie (CGA) individuell bestimmt werden. Besondere Aufmerksamkeit sollte dabei Risikogruppen gelten, darunter Menschen mit Diabetes, erhöhtem kardiovaskulärem Risiko oder familiärer Vorbelastung für CKD. Weitere Risikofaktoren umfassen vorangegangene akute Nierenschäden, Präeklampsie sowie bestimmte Systemerkrankungen wie etwa SLE.
Cystatin C zur Bestimmung der GFR
Eine wesentliche Neuerung ist die klare Empfehlung zur Nutzung von Cystatin C, das von allen Zellen des Körpers produziert wird und eine deutlich höhere Sensitivität für die Erfassung der GFR hat als Serum-Kreatinin. In Kombination mit Kreatinin liefert es daher eine viel präzisere GFR-Berechnung als die alleinige kreatininbasierte eGFR. Dies kompensiert die bekannten Schwächen der Kreatininmessung, wie die Abhängigkeit von der Muskelmasse und das tubuläre Handling, das durch Medikamente beeinflusst werden kann. Trotz der zusätzlichen Kosten einer Cystatin-C-Bestimmung überwiegt deren diagnostische Aussagekraft deutlich den potenziellen Mehraufwand. Leider wird die Bestimmung von Cystatin C noch nicht von den Kassen übernommen, sodass Patient:innen im niedergelassenen Bereich dafür selbst aufkommen müssen.
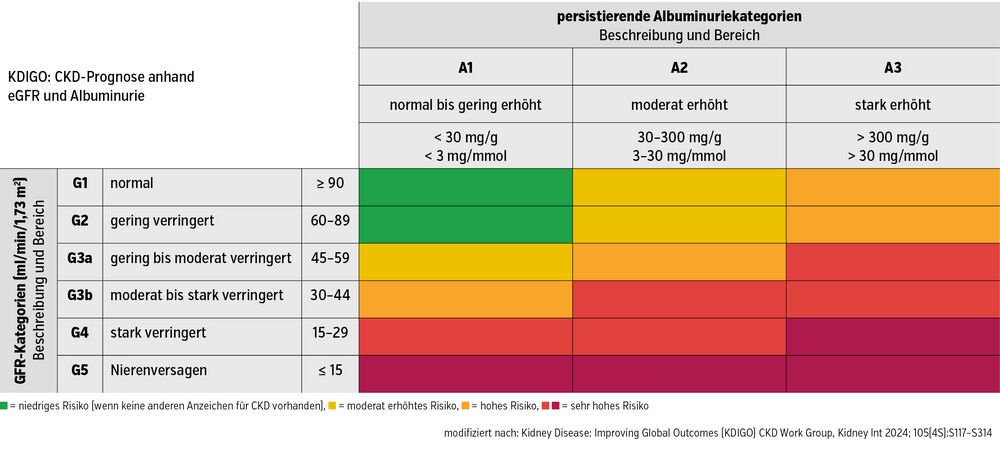
Bestimmung des CKD-Schweregrades
Nach einmaliger Bestätigung der eGFR und Albuminurie sollte der CKD-Schweregrad mithilfe der KDIGO-Heat-Map bestimmt werden (Abb.). Sie basiert auf Daten von über 26 Millionen Patient:innen und ermöglicht eine Risikoeinschätzung sowohl für renale als auch für kardiovaskuläre Komplikationen. Die Einführung der Cystatin-C-basierten eGFR hat zudem zur Klärung der kontroversen Frage beigetragen, ob das CKD-Stadium G3 A1 – insbesondere bei älteren Menschen – tatsächlich mit einem erhöhten Risiko einhergeht. In der Heat Map wird dieses Stadium daher nicht mehr als „grün“ und damit risikoarm dargestellt. Die bekannten Sammelurinmessungen, wie die 24-Stunden-Kreatinin-Clearance, sowie die meisten nuklearmedizinischen Tests werden mittlerweile nicht mehr generell empfohlen.
Die empfohlenen Überwachungsintervalle für GFR und Albuminurie nach einer diagnostizierten CKD lassen sich der KDIGO-Heat-Map entnehmen und richten sich weiter nach dem individuellen Risiko. Insbesondere bei einer GFR-Abnahme von mehr als 20–30 % nach Beginn einer Therapie mit z. B. ACE-Hemmern oder Sartanen oder einer Verdopplung der Albuminurie werden die Kontrollintervalle entsprechend verkürzt. Besonders wichtig ist neuerdings die individuelle Risikoprognose mit Einsatz der sog. KFRE (Kidney Failure Risk Equation). Ein 5-Jahres-Risiko von 3–5 % gilt als Schwellenwert für eine nephrologische Überweisung, während ein Risiko von über 40 % innerhalb von zwei Jahren bereits den Beginn der Diskussion über mögliche Nierenersatztherapien einleiten sollte. Die ÖGN hat eine entsprechende App entwickelt, in der diese und viele andere nützliche Tools der CKD-Diagnose und -Prognose kalkuliert werden können.
Empfehlungen zur Therapie
Im Rahmen der aktuellen CKD-Management-Empfehlungen wird das Blutdruckziel von 120mmHg zur Senkung des kardiovaskulären Gesamtrisikos betont. Aufgrund der Fülle qualitativ hochwertiger Studien zu den beeindruckenden nephroprotektiven und kardiovaskulären Vorteilen von SGLT2-Hemmern wird deren Einsatz im CKD-Management unabhängig vom Diabetesstatus empfohlen. Der Beginn einer SGLT2i-Therapie ist bis zu einer eGFR von > 20 ml/min indiziert und kann bis zur Einleitung einer Nierenersatztherapie fortgesetzt werden. Hinsichtlich der medikamentösen Nephroprotektion spricht KDIGO eine starke Empfehlung für nichtdiabetische CKD-Patient:innen mit hoher Albuminurie aus. Bei Patient:innen ohne Diabetes und ohne nachweisbare Albuminurie fehlt es jedoch an ausreichend langen, qualitativ hochwertigen prospektiven Studien, sodass die Empfehlung derzeit nicht so stark ausfällt.
Für Patient:innen mit Diabetes und Albuminurie wird der Einsatz von RAS-Blockern befürwortet. Als neues nephroprotektives Medikament wird Finerenon als Vertreter der nichtsteroidalen MRA bei Patient:innen mit CKD und Typ-2-Diabetes als wichtige Therapiesäule empfohlen. Es sollten jene Patient:innen therapiert werden, die ein hohes progressions- und kardiovaskuläres Risiko haben, womit Handlungsspielraum für Betreuer:innen geschaffen wird, etwa bei Albuminurie. Die in viele Domänen der Medizin vordringenden GLP-1-RA haben auch bei CKD und Diabetes konsistent günstige Effekte auf das kardiovaskuläre Risiko gezeigt, nun wurden zudem im Rahmen der FLOW-Studie nephroprotektive Effekte gezeigt, womit jetzt zumindest für Diabetes und CKD 4 Therapiesäulen existieren.
Kardiovaskuläres Risiko senken
Für alle Patient:innen mit einer GFR < 60 ml/min und einem Alter über 50 Jahre soll eine Therapie mit Statinen oder einer Kombination aus Statin und Ezetimib erfolgen. Bei Patient:innen unter 50 Jahren richtet sich die lipidsenkende Therapie nach dem individuellen kardiovaskulären Risiko. Für Personen mit sehr hohem kardiovaskulärem Risiko wird zudem der mögliche Einsatz von PCSK9-Hemmern empfohlen. Angesichts der hohen Prävalenz von nichtvalvulärem Vorhofflimmern bei CKD wird generell der Einsatz von NOAK gegenüber Vitamin-K-Antagonisten bevorzugt, da diese ein günstigeres Nutzen-Risiko-Profil aufweisen.
Multidisziplinäre Betreuung
Essenziell ist sicher die rechtzeitige Überweisung zu einer nephrologischen Fachbetreuung, da CKD-Patient:innen hinsichtlich Morbidität und Mortalität von dieser nachgewiesenermaßen profitieren. Dies gilt ab einer 3–5%-Schwelle durch die KFRE oder einer GFR < 30 ml/min sowie einem mehr als 20–30%igen Abfall der GFR unter einer aktiven hämodynamischen Therapie neben anderen klinischen Auffälligkeiten wie therapierefraktärer Hypertonie oder Hyperkaliämie bei CKD. Letztlich ist die Lebensqualität von CKD-Patient:innen zentral, weshalb umfassend u.a. standardisierte Fragebögen nach z. B. urämischen Symptomen (Pruritus, „restless legs“, Schlafstörungen, Malnutrition etc.) eingesetzt werden sollten.
Für die Nephrologie ist es ein zentrales Anliegen, eine integrierte Versorgung von CKD-Patient:innen entlang ihres Behandlungspfades einzufordern, da nur eine abgestufte multidisziplinäre Betreuung ein optimales ganzheitliches Ergebnis garantieren kann. Dazu zählen die zeit- und stadiengerechte Überweisung, effektive Patientenschulungsprogramme, standardisierte Behandlungsabläufe und die reziproke Kommunikation zwischen multidisziplinären Spezialist:innen und Allgemeinmediziner:innen. Insbesondere sollten klar verständliche Schulungsmaterialien zum Einsatz kommen, damit Betroffenen ein optimales „informed decision-making“ ermöglicht wird, zudem sollten zeitnahe innovative Telehealth-Tools für eine kontinuierliche Betreuung eingesetzt werden.
Zusammenfassend stellen die aktuellen Leitlinien evidenzbasierte Empfehlungen und praxisnahe Handlungsanweisungen dar, die alle beteiligten Behandelnden dabei unterstützen, CKD-Patient:innen bestmöglich zu betreuen. Besonders hervorzuheben ist die Notwendigkeit einer integrierten Versorgung von CKD-Patient:innen. Die spezifische Umsetzung der CKD-Management-Strategien für Diagnose und Therapie in Österreich wird 2025 veröffentlicht und sowohl auf der ÖGN-Website als auch in der Nieren-App verfügbar sein.