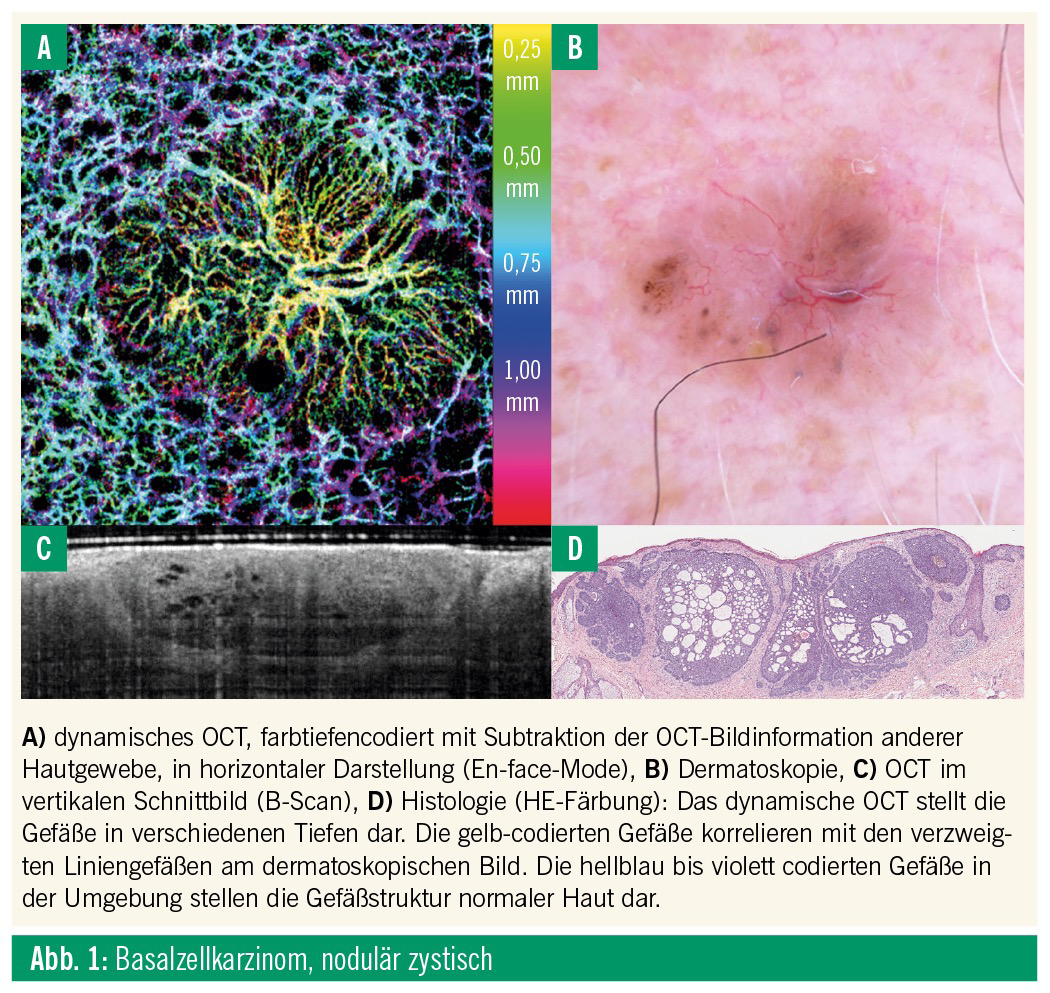
Innovative Methoden mit Potenzial für die Praxis: Nichtinvasive In-vivo-Diagnostikin der Dermatologie
Die Vorteile einer nichtinvasiven Untersuchungstechnik gegenüber der konventionellen Histologie sind breit gefächert: Die zu untersuchende Haut wird ohne vorherige Manipulation (bioptische Entnahme und histologische Aufarbeitung) und ohne daraus resultierenden künstlichen Veränderungen (z. B. Gewebeschrumpfung) nichtinvasiv und in vivo dargestellt. Das Untersuchungsergebnis liegt meist innerhalb einer relativ kurzen Zeitspanne – bis hin zu wenigen Sekunden – vor, sodass lange Wartezeiten für die Patienten vermieden werden können. Die Messungen können nicht nur dynamische Vorgänge, wie z. B. den Blutfluss darstellen, sondern auch beliebig oft an derselben Stelle wiederholt werden, was z. B. für ein Therapiemonitoring von Vorteil sein könnte. Zusätzlich bietet sich die Möglichkeit, nicht nur optische, sondern auch andere physikalische Eigenschaften von Geweben, wie z. B. die Elastizität, zu messen.
Nichtinvasive Diagnosetechniken
Die folgende Auflistung beschränkt sich auf in der Routine nicht regelmäßig bzw. zu Forschungszwecken eingesetzte nichtinvasive Untersuchungstechniken. Zu Informationen bezüglich Dermatoskopie, Verlaufsdermatoskopie, Ganzkörperfotografie, konfokaler Lasermikroskopie (KLM) und optischer Kohärenztomografie (OCT) darf auf vorangegangene Ausgaben verwiesen werden.
Hochfrequenz-Ultraschall (HF-US)
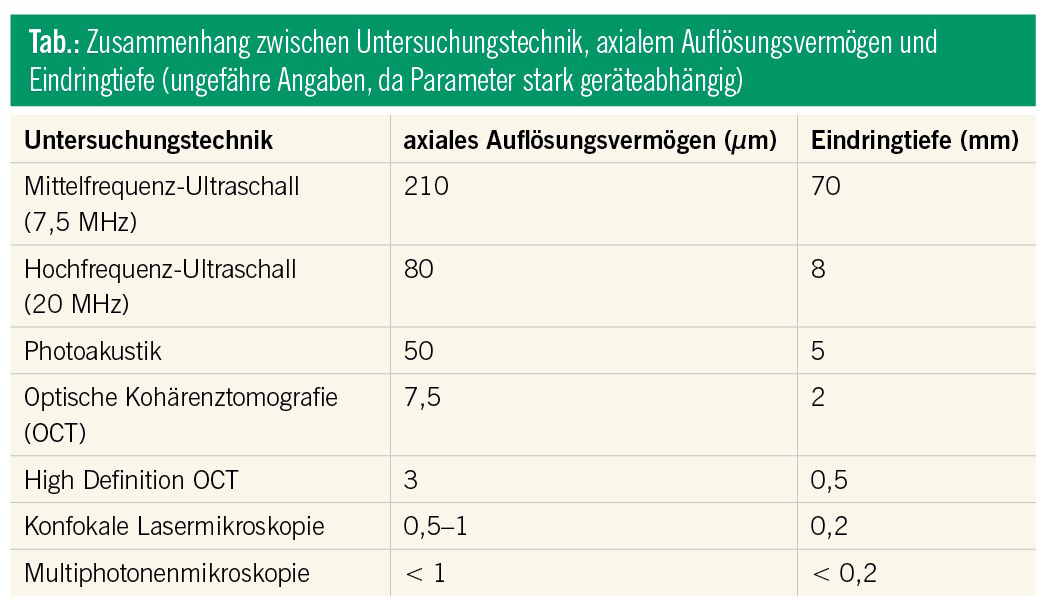
Das vereinfachte Prinzip dieser relativ bekannten Untersuchungstechnik liegt in dem Aussenden und Empfangen von Schallwellen, die oberhalb der menschlichen Hörschwelle (20 kHz) liegen. Epidermales Keratin, dermales Kollagen und in der Subkutis vorhandene Faszien und Bindegewebe stellen sich als besonders echoreich dar.1 Im Gegensatz zur Mittelfrequenz-Sonografie (7,5–18 MHz), welche im Allgemeinen zur Untersuchung von subkutanen Raumforderungen oder von regionalen Lymphknoten bei malignen Hauttumoren Verwendung findet2, kann der HF-US (20–50 MHz) aufgrund der höheren Auflösung (Tab.) bei geringerer Eindringtiefe zur Messung der Hautdicke, der Tumordicke, der Tumorrandbestimmung von Basalzellkarzinomen und zur Detektion lokaler Tumorrezidive eingesetzt werden.3, 4 Die Unterscheidung zwischen gutartigen und bösartigen melanozytären Läsionen stellt die HF-US weiterhin vor eine große Herausforderung.5
Zusätzlich wurde auch die Anwendbarkeit bei anderen dermatologischen Erkrankungen, in erster Linie als reproduzierbare und quantitative Untersuchungstechnik zur Diagnose und zur Abschätzung des Therapieansprechens z. B. bei kutanen Lymphomen6, systemischer Sklerodermie7 oder atopischer Dermatitis8, in klinischen Studien beschrieben.
Sonoelastografie: Hierbei wird mittels Ultraschalls die Elastizität einer Struktur im Vergleich zu ihrer Umgebung gemessen: Je härter eine Struktur zur Darstellung kommt, desto wahrscheinlicher ist deren Malignität. Das Ergebnis wird mit Hilfe einer Farbskala dem B-Scan des Ultraschalls in Echtzeit überlagert. Einzelne Studien fanden heraus, dass die Anwendung der Kompressionssonoelastografie zusätzlich zur konventionellen Ultraschalldiagnostik inkl. Farbdoppler die Sensitivität für die Erkennung einer metastatischen Absiedelung bei klinisch suspekten Lymphknotenvergrößerungen erhöht.9 Andere Pilotstudien beschreiben mögliche Anwendungen in der Beurteilung der Fibrose bei systemischer Sklerose, der Evaluierung von Kompressionsulcera oder in der Dignitätsbeurteilung kutaner Tumoren.10 Die Elastographie findet derzeit keine routinemäßige klinische Anwendung.
Photoakustische Tomografie
Die Photoakustik (PA) beruht auf dem Prinzip der thermoelastischen Expansion: Nach Bestrahlung mit kurzwelligem kohärenten Licht erfahren absorbierende Moleküle einen Temperaturanstieg, welcher in der Emission akustischer Wellen resultiert.11 Diese können mittels Ultraschalls (Focused Scanning-based photoakustische Mikroskopie) bzw. mittels Interferometer-Detektoren (Reconstruction-based photoakustische Tomografie) in ein dreidimensionales Bild umgerechnet werden.12 Beiden Techniken dienen unter anderem Hämoglobin und Melanin als endogene Absorber und können dadurch insbesondere zur Darstellung von Gefäßstrukturen bis auf eine Tiefe von ca. 5 mm eingesetzt werden (Abb. 2c).13 Auch wurden erste Hinweise zur präoperativen Dickenmessung bis auf 10 mm bei Melanomen publiziert.14
Dynamische optische Kohärenztomographie (dOCT)
Bei der dOCT handelt es sich um ein nichtinvasives Verfahren, welches sich ohne Einsatz von Kontrastmitteln zur Darstellung superfizieller Gefäßstrukturen bis auf eine Tiefe von ca. 1,5 mm eignet (Abb. 1). Das Prinzip der Technik beruht auf der Aussendung und dem Empfang von niedrig kohärentem Laserlicht, dessen Wellenlänge sich nach der Interaktion mit Gewebestrukturen ändert. Mit der Hilfe eines Interferometers werden diese Änderungen mit einem Referenzstrahl verglichen und in einen Bildpunkt umgewandelt.15 Zur Gefäßdarstellung werden mehrere Messungen an derselben Stelle innerhalb weniger Sekunden durchgeführt, und die sich in einem Gefäß bewegenden Erythrozyten führen im Vergleich zu der statischen Umgebung zu einem unterschiedlichen Reflexionsmuster.16 Die Implementierung der dynamischen OCT in ein kommerziell erhältliches, CE-zertifiziertes OCT-Gerät gründet sich auf die Veröffentlichung zahlreicher Studien, welche superfizielle Gefäßmuster verschiedenster dermatologischer Dignitäten beschreiben, wie z. B. die sich mit zunehmender Tumordicke verändernde Gefäßstruktur von keratinisierenden Hauttumoren (aktinische Keratosen, Morbus Bowen, Plattenepithelkarzinom)17, Basalzellkarzinomen18 und Melanomen (Abb. 1).19
Multiphotonenmikroskopie
Die Multiphotonenmikroskopie (MPT) bzw. die Frequenzverdoppelung („second harmonic generation“, SHG) bedient sich wie die konfokale Lasermikroskopie eines Lasers, um die zu untersuchende Probe abzutasten. Die horizontal dargestellte und hochauflösende Bildgebung (laterales Auflösungsvermögen < 1 µm, Darstellungstiefe < 200 µm) resultiert allerdings aus nichtlinearen Licht-Materie-Interaktionen: In der Haut vorkommende Fluorophore, wie z. B. NADH/NADPH, Flavoproteine, Melanin, Lipofuszin, Elastin oder Kollagen werden mittels unterschiedlich langwelligem Laserlicht zur Autofluoreszenz angeregt (Multiphotonenfluoreszenz) bzw. können bestimmte Molekülstrukturen (z. B. Kollagenfasern) zu einer harmonischen Frequenzverdoppelung des eingestrahlten Lichtes (SHG) führen. Auf Basis der Kombination beider physikalischer Effekte, welche sich auf ähnliche Weise messen lassen, ist es möglich, nichtinvasiv und ohne zusätzliche Fluoreszenzfarbstoffe dreidimensionale In- und Ex-vivo-Darstellungen intra- und extrazellulärer Strukturen der Epidermis und der Dermis zu generieren.20
Auch wenn die MPM/SHG derzeit vom routinemäßigen Einsatz in der dermatologischen Praxis weit entfernt ist, beschreiben zahlreiche klinische Studien vielfältige mögliche Anwendungen: angefangen vom Nachweis transkutaner Transportvorgänge21, 22 über die Beschreibung der epidermalen Morphologie und Prozessen der Hautalterung und Wundheilung23, der Differenzierung zwischen elastischen und kollagenen Fasern24 bis zur Diagnostik bullöser, entzündlicher und allergischer Hauterkrankungen.25 Durch das hohe Auflösungsvermögen könnte sich dieses Verfahren auch in der Differenzierung von benignen und malignen melanozytären Tumoren26 sowie bei der Diagnose von Basalzellkarzinomen27 als hilfreich erweisen.
Raman-Spektroskopie
Die Raman-Spektroskopie (RS) wurde von dem indischen Physiker C. V. Raman 1928 erstbeschrieben.28 Bei dieser Technik wird die Haut mit monochromatischem Licht (vorwiegend nahe dem Infrarot-Spektrum) bestrahlt und das Streulicht spektroskopisch analysiert. Auffällig ist, dass neben dem Auftreten von Streulinien in der Anregungswellenlänge (elastische Rayleigh-Streuung) auch Licht mit höheren und niedrigeren Frequenzen messbar ist (inelastische Stokes-Raman-Streuung bzw. Antistokes-Ram
an-Streuung).29 Diese Frequenzverschiebungen sind für verschiedene Molekülstrukturen spezifisch und lassen sich mittels eines Spektroskops messen und darstellen.
Mit Hilfe dieser Technik war es erstmalig möglich, Antioxidanzien wie Karotinoide in vivo in der Haut zu messen30, und in weiterer Folge konnte eine Korrelation zwischen der Abnahme der Karotinoid-Konzentration und der Abnahme der minimalen Erythemdosis hergestellt werden.31 Zusätzlich zeigte sich, dass eine verringerte Lycopin-Konzentration mit einer erhöhten Rauigkeit der Haut – einem Indikator der Rückschlüsse auf die Hautalterung zulässt – einhergeht.32 Neben der quantitativen Messung unterschiedlichster Molekülstrukturen, wie z. B. des Natural Moisturizing Factors33, bietet sich mit dieser Technik auch eine objektive Methode zur Erfassung der Haut-Hydratation an sowie zur Erfassung der Hautpenetration verschiedenster exogen applizierbarer Substanzen.34
Weitere klinische Studien beschäftigten sich mit dem Einsatz der RS in der Diagnose verschiedenster Hauttumoren. Eine rezent veröffentliche Studie, die 518 Hautläsionen beinhaltete (u. a. maligne Veränderungen wie Melanome, Basalzellkarzinome, Plattenepithelkarzinome und benigne Läsionen wie Nävi und seborrhoische Keratosen) erreichte in der Differenzierung gut- und bösartiger Hautveränderungen eine Fläche unter der Kurve (AUC) von 0,879. Das bedeutet, dass bei einem festgesetzten Sensitivitätslevel von 90 % eine Spezifität von 64 % erreicht werden konnte.35 Trotz vielversprechender Ergebnisse ist die RS aber noch weit von der routinemäßigen Applikation in der dermatologischen Praxis entfernt.
Elektrische Impedanz-Spektroskopie (EIS)
Elektrische Eigenschaften von Geweben basieren auf deren zellulärer und extrazellulärer Zusammensetzung. Diese beeinflusst deren Fähigkeit, Elektrizität zu leiten und zu speichern. Die EIS misst den Gewebswiderstand bei Wechselströmen verschiedener Frequenzen bis auf eine Tiefe von 2,5 mm. Ein medizintechnisches Gerät, welches dieses Prinzip zur Dignitätsbeurteilung melanozytärer Läsionen einsetzt, erreichte in einer multizentrischen Studie in der Erkennung von Melanomen in einer Gruppe von melanomverdächtigen melanozytären Hautveränderungen eine Sensitivität von 97 % sowie eine Spezifität von 34 %.36 Eine rezent veröffentlichte Pilotstudie brachte jedoch keinen zusätzlichen Nutzen in der additiven Anwendung zur Dermatoskopie bei der Untersuchung melanomverdächtiger melanozytärer Hautveränderungen und beschrieb Bedenken bezüglich der Reproduzierbarkeit der Messungen.37
Multispektral-Analyse
Hierbei werden Lichtstrahlen verschiedener Wellenlängen des sichtbaren bis Infrarot-Spektrums verwendet und deren Reflexion an Oberflächen bzw. Gewebestrukturen detektiert. Ein CE-zertifiziertes und für die Beurteilung von melanomverdächtigen pigmentierten Nävi zugelassenes computerunterstütztes Diagnosegerät erreichte in ersten klinischen Studien eine Sensitivität von 98,4 % bei einer Spezifität von ca. 9 %.38 Das Ergebnis basiert auf dem Vergleich mit dem Reflexionsmuster von ca. 10.000 validierten melanozytären Hautläsionen und ist demnach stark von dem verwendeten Testset abhängig. Außerdem wurden in die Studie nur bereits zu Biopsie ausgewählte Läsionen eingeschlossen.39 Die klinische Bedeutung im dermatologischen Alltag ist weiterhin nicht ganz geklärt.40
Multimodale Bildgebung
Wie in der Tabelle ersichtlich, existiert ein direkter Zusammenhang zwischen dem Auflösungsvermögen und der Eindringtiefe bei der Visualisierung von Hautstrukturen. Auch eignen sich bestimmte Techniken nur zur Darstellung ausgewählter Bereiche der Haut. Die multimodale Bildgebung bietet mit der Kombination von zwei bzw. mehreren nichtinvasiven Diagnosetools eine vielversprechende Lösung an.
Mögliche Kombinationen
OCT mit Multiphotonentomographie oder konfokaler Lasermikroskopie: Während die hochauflösende MPT bzw. KLM auf die Epidermis und superfizielle Dermis beschränkt bleibt, kann mittels OCT die Darstellung um tieferer Strukturen bis auf 1,5 mm Eindringtiefe erweitert werden, in weiterer Folge ergeben sich hierbei 3D-Bildgebungen des untersuchten Hautareales.41, 42 Ein erstes medizintechnisches Gerät, das RCM und OCT kombiniert, ist bereits kommerziell erhältlich. Erste Studienergebnisse beschränken sich auf die Diagnose und Tumordickenmessung von Basalzellkarzinomen.
Raman-Spektroskopie mit Multiphotonentomographie: Diese in klinischen Studien eingesetzte Kombination ermöglicht die Darstellung von Autofluoreszenz endogener Fluorophoren der Epidermis durch die MPT sowie die Visualisierung der Verteilung interzellulärer Lipide, topisch applizierter Substanzen und von Wasser durch die RS.43
OCT, dynamische OCT und Photoakustik: Hierbei nutzt man die Vorteile dreier verschiedener nichtinvasiver bildgebender Verfahren. So erreicht man eine hochauflösende 3D-Darstellung epidermaler und dermaler Strukturen mittels OCT sowie die Darstellungen des superfiziellen Gefäßplexus mittels dynamischer OCT und des tiefen dermalen Gefäßplexus durch die photoakustische Tomografie (Abb. 2).44, 45
ologie. 2016. Springer-Verlag Berlin Heidelberg