Indikation, Technik und Zeitpunkt der Orchidopexie
Ist der Hoden bis zum Abschluss des ersten Lebensjahres nicht deszendiert, ist es nicht sinnvoll, weiter auf einen spontanen Deszensus zu warten. Zusätzlich ist von einer weiteren Schädigung der Keimzellen bei persistierendem Hodenhochstand auszugehen. Laut den EAU-Leitlinien von 2011 sollte die Therapie vor dem Alter von 12-18 Monaten abgeschlossen sein. Es häufen sich jedoch Empfehlungen z.B. im “Nordic Consensus” der skandinavischen Länder 2007 oder in den aktuellen AWMF-Leitlinien, wo der Abschluss der Behandlung des Hodenhochstandes bereits mit Vollendung des 1. Lebensjahres gefordert wird. In den ersten 6 Monaten wird dementsprechend auf den spontanen Deszensus gewartet, dann wird die präoperative Hormontherapie begonnen und die Operation sollte vor Vollendung des 12. Lebensmonats stattfinden2-4. Ein intraabdominaler Hoden sollte ab einem Alter von 10 Jahren bei normalem kontralateralem Hoden entfernt werden5.
Klassifikation: Klinisch ist die von Kaplan 1993 eingeführte Klassifikation in palpablen und nichtpalpablen Hoden am gängigsten. Die klinische Untersuchung sollte in Rückenlage und im Schneidersitz (zur Ausschaltung des Cremasterreflexes) in warmer und ruhiger Umgebung erfolgen. Es wird bimanuell untersucht, wobei eine Hand inguinal liegt und die andere Hand skrotal palpiert. Ein palpabler Hoden liegt in etwa 80% der Fälle vor und kann als Leistenhoden, Gleithoden, ektoper Hoden und auch als so genannter Peeping testis vorliegen. Dabei handelt es sich eigentlich um einen intraabdominalen Hoden, der zwischen Bauchhöhle und Leistenkanal hin und her pendeln kann und damit intermittierend auch in der Leiste tastbar ist.
Ein ektoper Hoden vollzieht zwar den transinguinalen Deszensus regelrecht, wird dann jedoch unter dem äußeren Leistenring fehlgeleitet. Die häufigste ektope Lage ist ein zwischen der Aponeurose des M. obliquus externus und der Scarpaschen Faszie epifaszial hinaufgeschlagener Hoden (sog. Denis Brown Pouch). Weiters kann der Hoden an der Peniswurzel, skrotal im Bereich der Gegenseite, an der Oberschenkelinnenseite oder perineal zu palpieren sein. Ein Gleithoden (sog. gliding testis) liegt im Bereich des Skrotaleinganges, kann auch manuell nach distal ins Scrotum mobilisiert werden, rutscht jedoch aufgrund eines zu kurzen Samenstranges nach Loslassen gleich wieder nach kranial zurück.
Eine Sonderform ist der Pendelhoden (sog. retractile testis), der sich dadurch auszeichnet, dass er manuell leicht nach distal ins Scrotum mobilisiert werden kann und dort auch verbleibt. Durch einen überaktiven Cremasterreflex steigt er jedoch immer wieder in Richtung des äußeren Leistenrings auf. Er wird als Normvariante angesehen, ist primär nicht behandlungsbedürftig, jedoch kontrollbedürftig (1-mal jährlich bis zur Pubertät bzw. bis der Hoden dauerhaft im Scrotum bleibt), da das Risiko einer sekundären Aszension bei 32%6 liegt.
Die bedeutendsten mit dem Hodenhochstand verbundenen Risiken sind zum einen die In- oder Subfertilität und zum anderen das erhöhte Malignomrisiko. Ein unilateraler Hodenhochstand hat gegenüber einem beidseitigen Befund eine bessere Fertilitätsprognose. In publizierten Studien zeigen sich Paternitätsraten von 80-90% für Männer mit einem ehemals einseitigen Hodenhochstand, während bei einem bilateralen Hodenhochstand Vaterschaften nur in 45 bis 65% nachgewiesen wurden7.
Das Risiko einer malignen Entartung bei einem ehemals undeszendierten Hoden schätzt man heute auf das 5-10-Fache gegenüber einem normalen Hoden erhöht. In früheren Publikationen wurde immer berichtet, dass eine operative Verlagerung das Hodentumorrisiko nicht vermindert. Diese Erkenntnisse wurden aber bei Patienten erhoben, bei denen aus heutiger Sicht die Orchidopexie nicht rechtzeitig durchgeführt wurde. Es gibt nun Daten aus Metaanalysen, in denen ein verringertes Tumorrisiko bei früherer Orchidopexie im Vergleich zur verspäteten Orchidopexie festgestellt wurde8,9. Interessant ist auch, dass unbehandelte nichtdeszendierte Hoden eher ein Seminom (74%) entwickeln, während orchidopexierte Hoden eher nichtseminomatöse Hodentumoren (63%) entwickeln10.
Orchidopexie nach Shoemaker
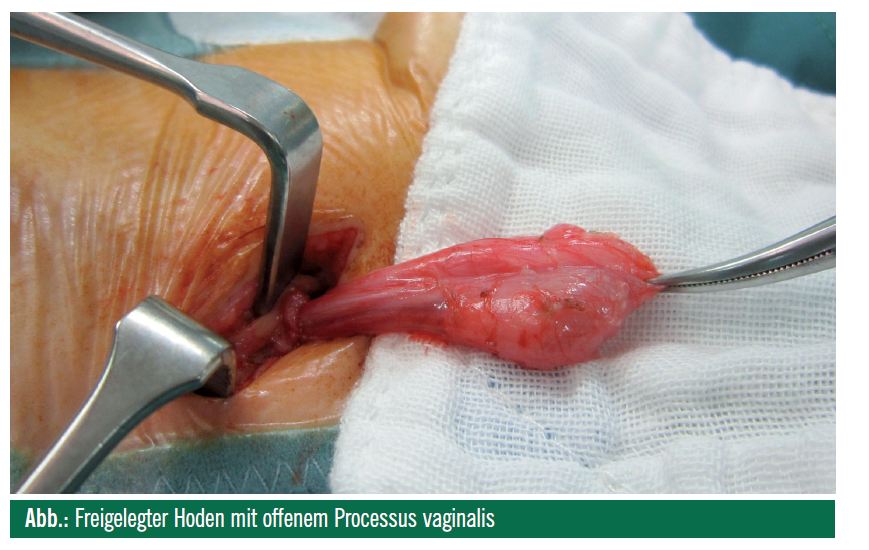
Die chirurgische Standardtherapie beim palpablen Hoden ist die Orchidopexie nach Shoemaker. Die Erfolgsraten betragen bei Hodenlage im Bereich des äußeren Leistenringes 92% und bei einem Abdominalhoden 81%11. Seit mehreren Jahren wird in Publikationen auch der primär skrotale Zugang für ausgewählte Fälle propagiert (“Scrotal single incision orchidopexy”), wobei die adäquate Versorgung eines offenen Processus sicher deutlich schwieriger ist12.
Bei der Orchidopexie nach Shoemaker wird aus kosmetischen Gründen eine quere inguinale Inzision entlang der Hautspannungslinien durchgeführt. Nach Freilegung des Hodens mit Durchtrennung des Gubernaculums und Eröffnung der Externusaponeurose wird eine sorgfältige Funikulolyse mit Durchtrennung der Cremasterfasern unter Schonung der Gefäße und des Ductus deferens durchgeführt (Abb.). Im Bereich des inneren Leistenringes wird der peritoneale Umschlag nach Durchtrennung des obliterierten bzw. nach Verschluss des offenen (ca. 25% der Fälle) Processus vaginalis testis abpräpariert. Es wird sodann der Ductus von den Samenstranggefäßen am inneren Leistenring separiert. Dann erfolgt die Bildung eines Dartos-Pouch am jeweiligen Hemiskrotum. Der Hoden wird unter Beachtung der torsionsfreien Lage dorthin spannungsfrei verlagert. Es können entweder so genannte Einengungsnähte am skrotalen Neohiatus oder Fixierungsnähte an Reste der Fascia spermatica externa oder an Kremasterfasern gesetzt werden, um eine unruhebedingte postoperative Reaszension des Hodens zu verhindern. Eine eigentliche Pexie, d. h. transparenchymatöse Nähte, wird nur in Ausnahmefällen durchgeführt (z. B. zur testikulären Fixation des ipsilateralen und kontralateralen Hodens nach Torsion), da unabhängig von Fadenstärke und -material eine Hodenschädigung durch Entzündung ausgelöst wird. Es sei hier nochmals betont, dass somit eine Orchidopexie keinesfalls eine spätere Hodentorsion ausschließt. Bei zu kurzem Samenstrang kann ein Prentiss-Manöver durchgeführt werden. Dabei wird der Samenstrang nach Eröffnen der Fascia transversalis unter den epigastrischen Gefäßen durchgezogen. Dies ermöglicht einen direkten Verlauf der Samenstranggefäße und damit eine Abkürzung des Weges bis ins Scrotum.
Sollte der Samenstrang auch dafür zu kurz und der Hoden erhaltungswürdig sein, kann eine ein- oder zweizeitige Fowler-Stephens-Operation mit Durchtrennung der Spermaticagefäße bzw. eine mikrovaskuläre Autotransplantation durchgeführt werden.
Komplikationen: Eine schwerwiegende Komplikation der Orchidopexie ist die Hodenatrophie, wobei die Häufigkeit bei 1% für die Standard-OP angegeben wird. Ursachen können eine unsachgemäße Präparation des Funiculus, eine Einengung der Gefäße beim Leistenverschluss oder eine iatrogene Torsion bei der Verlagerung und Pexie des Hodens sein. Bei nicht erhaltungswürdigem Hoden erfolgt eine Orchiektomie mit eventueller simultaner Hodenprothesenimplantation im Pubertätsalter. Bei einem Leistenhodenrezidiv, das in der Literatur mit 1-5% angegeben wird, erfolgt die Reorchidopexie frühestens nach 6 Monaten. Ursachen können ein ungenügendes Abpräparieren der Cremasterfasern, ein nicht abpräparierter Processus vaginalis oder auch ein kleiner Pouch in einem hypoplastischen Scrotum sein.
Wenn der N. ilioinguinalis beim Wundverschluss eingenäht wird, können Neuralgien entstehen, die mitunter auch revisionsbedürftig sein können.
Um Komplikationen vorzubeugen, sollte eine möglichst sorgfältige Präparationstechnik unter obligater Verwendung einer bipolaren Koagulation und einer Lupenbrille erfolgen.
Fazit: Die Orchidopexie nach Shoemaker ist der operative Standardeingriff beim nicht deszendierten, palpablen Hoden und ist sicher und komplikationsarm. Es sollte die Therapie (inklusive präoperativer Hormontherapie) spätestens bis zum 12.-18. Lebensmonat abgeschlossen sein.
1 Berkowitz GS et al., Pediatrics 1993; 92(1):44-9
2 Ritzen et al., Acta Paediatr 2007; 96:638-43
3 AWMF Leitlinie Hodenhochstand – Maldescensus testis Register Nr 006/022
4 Kollin C et al., J Urol 2007; 178:1589-93
5 European Association of Urology Guidelines 2011 Edition
6 Agarwal PK et al., J Urol 2006; 175:1496-9
7 Lee PA, Coughlin MT, Horm Res; 55:28-32
8 Wood HM, Elder JS, J Urol 2009; 181:452-61
9 Walsh TJ et al., J Urol 2007; 178:1440-6
10 Pettersson A et al., N Engl J Med 2007; 356(18):1835-41
11 Docimo SG, J Urol 1995; 154:1148-52
12 Cloutier J et al., J Urol 2011; 185:1088-92