Hypertonie und Niere
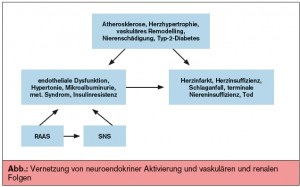
Zwischen Niere und Hochdruck bestehen vielfältige wechselseitige Beziehungen. Erkrankungen der Niere führen zur Erhöhung des Blutdrucks, Hypertonie fördert den Funktionsverlust der Nieren. Eine zentrale Rolle in der Verflechtung von Niere, Blutdruck und Herz spielen das Renin-Angiotensin-Aldosteron-System (RAAS) und das sympathische Nervensystem (SNS), die einander ebenfalls beeinflussen.Die neuroendokrine Aktivierung kann sowohl von den Nieren wie vom Herz ihren Ausgang nehmen. Das klassische Konzept geht von der Reninsynthese und -freisetzung in juxtaglomerulären Zellen aus und mündet in die Bildung von Angiotensin II (AT II). Dieses wirkt vasokonstriktorisch und stimuliert die Aldosteronsekretion aus der Nebennierenrinde. Nach heutigem Verständnis ist AT II nicht nur ein zirkulierendes Hormon, sondern wird in zahlreichen Organen gebildet und ist somit auch auto- und parakrin wirksam. Zusammen mit Aldosteron fördert es die Bildung kardialer, vaskulärer und renaler Schäden. In diesem Kontext wurde die Hypothese des kardiorenalen Kontinuums entwickelt. Die Blockade dieses Systems an verschiedenen Angriffspunkten, zuerst in Endstadien getestet, zuletzt in immer früheren Stadien, erwies sich als außerordentlich erfolgreich und ist heute Teil der Standardbehandlung verschiedener kardiovaskulärer und renaler Erkrankungen. Die Aktivierung des SNS einerseits im Rahmen einer Hypertonie, andererseits durch renale Erkrankungen ist wegen der metabolischen Auswirkungen, insbesondere der Förderung von Adipositas, metabolischem Syndrom, Hyperinsulinämie und damit von Diabetes von speziellem Interesse.
Ein viel zitierter Befund der letzten Jahre zur Genese der primären Hypertonie ist die Assoziation von niedrigem Geburtsgewicht und einer verstärkten Neigung zu Hypertonie. Als Ursache wurde eine gegenüber Kontrollen verminderte Zahl an Glomeruli festgestellt. Renal bedingte Drucksteigerung erfolgt über Na-Retention, Volumenzunahme, Aktivierung des sympathischen Nervensystems und des RAS und Störungen des Phosphathaushalts. 90 % der sekundären Hypertonien werden durch renoparenchymatöse Erkrankungen verursacht, nach ihnen ist daher bei jedem Hochdruckkranken zu fahnden. Umgekehrt ist seit der MRFIT-Studie bekannt, dass die Höhe sowohl des systolischen wie auch des diastolischen Drucks die Entwicklung und das Fortschreiten einer Niereninsuffizienz bestimmt. Typ-2-Diabetes und vaskuläre Erkrankungen, beides Hypertonie-assoziierte Erkrankungen, machen 50 % der Patienten mit Nierenersatztherapie aus, ihr Anteil nimmt laut Österreichischem Dialyse- und Transplantationsregister seit Jahren kontinuierlich zu.
In den vergangenen Jahren haben Parameter zur besseren Prognoseeinschätzung und Konzepte der Renoprotektion Fortschritte gemacht, aber auch Rückschläge erlebt. Diese sollen hier skizziert werden.
Prognoseparameter
Von renaler Seite wurden Eiweißausscheidung und glomeruläre Funktionseinbußen als eigenständige und vom Blutdruck unabhängige Prognoseparameter gesichert, von hypertensiologischer Seite ist es die gestörte zirkadiane Rhythmik mit fehlendem nächtlichen Druckabfall.
Mikroalbuminurie und Proteinurie: Je ausgeprägter die Albuminurie, umso schlechter die Prognose. Als Mikroalbuminurie (MAU) wird eine Eiweißausscheidung von 30 bis 300 mg/24 Stunden (oder eine Albumin-Kreatinin- Ratio von 30–300 mg/g Kreatinin) bezeichnet. Sie ist Folge einer gesteigerten transglomerulären Durchlässigkeit und damit Ausdruck einer generalisierten Schädigung der Endothelfunktion bzw. der Mikrozirkulation. Sie gilt als Indikator einer hypertensiven Organschädigung (hypertensive Nephrosklerose), im Gegensatz zu einer Proteinurie von über 300 mg/24 Stunden, wie sie für renoparenchymatöse Erkrankungen typisch ist. Das Risiko steigt allerdings schon ab einer Albumin-Kreatinin- Relation von 10 mg/g. Wegen der eingeschränkten Reproduzierbarkeit wird die 2-fache Bestimmung empfohlen. MAU ist ein häufiges Frühzeichen einer diabetischen Nephropathie und geht mit einer erhöhten kardiovaskulären Morbidität und Mortalität einher. Ein Rückgang der Mikroalbuminurie unter Therapie wurde in Studien in Zusammenhang mit einer verbesserten, das Neuauftreten mit einer verschlechterten Prognose beobachtet. Andere Studien fanden allerdings eine Dissoziation von Albuminurie und Prognose bzw. Nierenfunktion unter RAS-Hemmung. Albuminurie nimmt ab, wenn der Blutdruck gut gesenkt wird – oder unter ACE-Hemmer und AT-II-Blockern auch bei suboptimaler Blutdrucksenkung. Beide wirken auf das Vas efferens der Glomeruli und verringern damit den transglomerulären Filtrationsdruck, was andererseits – besonders bei bereits eingeschränkter Nierenfunktion oder Sklerose der Nierengefäße – zu einer Abnahme der Filtrationsleistung und Anstieg des Serumkreatinins führt. Die Beurteilung ist kontrovers. Ein leichter bis mäßiger Anstieg des Serumkreatinins zu Beginn einer Behandlung mit einem ACE-Hemmer oder AT-II-Blocker gilt jedenfalls als Hinweis auf eine wirksame Therapie, hat sich doch in mehreren Studien gezeigt, dass in den folgenden Jahren die Abnahme der Nierenfunktion langsamer vonstatten geht als in Kontrollkollektiven.
Glomeruläre Filtrationsrate: Schon leichte Einschränkungen der eGFR von 59–45 ml/ min/1,73 m2 lassen das Risiko für kardiovaskuläre Erkrankungen unabhängig vom Blutdruck und anderen Risikofaktoren ansteigen. Sobald die eGFR unter 45 sinkt, nimmt das Risiko für Tod aus jeder Ursache und für kardiovaskuläre Ereignisse steil zu und erreicht das 5- bis 10-Fache der Patienten mit normaler GFR. Gemeinsames Auftreten von MAU und eingeschränkter Nierenfunktion addiert das Risiko. In der ADVANCE-Studie erhöhte das gemeinsame Bestehen einer eGFR von unter 60 ml/ m2 Körperoberfläche und Proteinurie das Risiko für kardiovaskuläre Ereignisse um das 3,2-Fache, das für kardiovaskuläre Mortalität um das 5,9-Fache und das für renale Ereignisse um das 22-Fache. Hypertonie zusammen mit subklinischer Nierenschädigung katapultiert Patienten in den Hochrisikobereich mit etwa 20 % kardiovaskulären Ereignissen in 10 Jahren. Wie die TAKE-CARE-Studie (Slany, WMW 2011) in Österreich vor kurzem gezeigt hat, wird dieses erhöhte Risiko von niedergelassenen Ärzten nur selten erkannt.
24-Stunden-Blutdruckmessung: Bei etwa 80 % der Patienten mit renoparenchymatöser Hypertonie fällt der Blutdruck während der Schlafphase gegenüber der Wachperiode nicht ab oder steigt sogar an, die Patienten sind „Non-Dipper“ oder sogar „reversed Dipper“; das bedingt eine gegenüber Patienten mit normalem zirkadianen Druckverhalten schlechtere Prognose. Es findet sich eine hohe Assoziation des Nicht-Dipper-Status mit Albuminurie, Linkshypertrophie und erhöhter Gefäßsteifigkeit („Stiffness“).
Blutdruckzielwerte, Therapie
Leitlinien der großen Hochdruckgesellschaften (ESH, ISH, AHA, JSH) haben bei Patienten mit Nierenerkrankung oder Diabetes oder Herzerkrankungen empfohlen, eine Blutdrucksen- kung schon bei Werten von 130–139/85–89 mmHg zu beginnen mit einem Zielwert von unter 130/80 mmHg. Die 2009 revidierten Leitlinien der ESH nehmen diese Empfehlungen für Diabetiker und Herzkranke zurück, da sie durch Studiendaten nicht belegt sind. Die neuen Empfehlungen raten, den Blutdruck von Hochrisikopatienten in den unteren Bereich von 130– 140/85–89 mmHg zu senken. Zu den
Blutdruckzielwerten von Patienten mit Nierenerkrankungen wird keine definitive Stellung genommen; möglicherweise, weil in die Studien weder Patienten mit so niedrigen Ausgangswerten eingeschlossen, noch Blutdruckwerte unter 130 mmHg erreicht wurden und überdies wegen mangelnder Power keine verlässlichen Daten zu kardiovaskulären und harten renalen Endpunkten zu erzielen waren. Eine Metaanalyse kam 2011 zu dem Schluss, dass Blutdruckwerte von unter 125/75 bis 130/80 mmHg nicht günstiger waren als solche unter 140/90 mmHg. De facto ist es bei Patienten mit eingeschränkter Nierenfunktion schwieriger den Blutdruck zu senken als im Vergleich zu solchen mit normaler Nierenfunktion. Die meisten Untersuchungen zeigen, dass Nierenkranke mehr Antihypertensiva benötigen oder höhere mittlere Blutdruckwerte aufweisen als Kontrollkollektive. Von nephrologischer Seite wird häufig empfohlen, bei Patienten mit Niereninsuffizienz und großer Proteinurie > 1 g/d den Blutdruck auf unter 125/75 mmHg zu senken. Auch dafür fehlen harte Endpunkte.
Renoprotektion durch RAAS-Hemmung: In mehreren Studien wurde gefunden, dass ACEHemmer und AT-II-Blocker die Mikroalbuminurie und die Abnahme der eGFR nicht nur im Vergleich zu Placebo günstig beeinflussen können, was nicht verwundert, sondern auch im Vergleich zu anderen Antihypertensiva, vornehmlich Atenolol als Betablocker und Amlodipin als Kalziumkanalblocker. Damit war das Konzept einer besonderen Renoprotektion durch Hemmung des RAAS aus der Taufe gehoben. Studienkollektive waren zunächst Patienten mit diabetischer Nephropathie, später auch solche ohne Diabetes. Das Konzept der Renoprotektion geriet ins Wanken, als 24-Stunden-Blutdruckmessungen im Gegensatz zu den Office-Messungen (die eine nahezu gleiche Blutdrucksenkung ergaben und die der Originalpublikation zugrunde lagen) in der HOPE-Studie zeigten, dass unter dem ACE-Hemmer viel tiefere Blutdruckwerte erreicht wurden als in der Kontrollgruppe. Mit dem direkten Reninhemmer Aliskiren wurde eine noch stärkere Reduktion von Albuminurie festgestellt. Weiters fand man in kleineren Studien, dass mit möglichst kompletter Hemmung des RAAS durch Doppel- oder Tripletherapie mit ACE-Hemmern, AT-II Rezeptorblockern und direkten Reninhemmern die renale Eiweißausscheidung besser als mit den Einzelsubstanzen vermindert wurde. Das nährte die Hoffnung, die Nierenfunktion auch bei schon eingetretener Schädigung völlig stationär halten zu können. Große kontrollierte randomisierte Therapiestudien haben indessen enttäuschende Ergebnisse geliefert. In ONTARGET erwies sich die Kombination des ACE-Hemmers Ramipril mit dem AT-IIAntagonisten Telmisartan trotz stärkerer Senkung der renalen Albuminausscheidung in keinem der kardiovaskulären und renalen Endpunkte den Einzelsubstanzen überlegen, im Gegenteil, unter der Kombination waren mehr Nebenwirkungen und eine, statistisch allerdings nicht signifikante, Tendenz zu mehr Todesfällen zu verzeichnen. Im Dezember 2011 wurde die groß angelegte ALTITUDE-Studie, in der die duale RAS-Hemmung mit Aliskiren und einem ACE-Hemmer oder AT-II-Blocker geprüft wurde, vorzeitig wegen fehlendem Vorteil bei vermehrten Nebenwirkungen abgebrochen.
Nicht vergessen werden sollte, dass die Reduktion der Na+-Zufuhr weiterhin ein integrierender Bestandteil der Behandlung von Hochdruckpatienten mit eingeschränkter Nierenfunktion (und nicht nur dieser) sein sollte. Empfohlen wird die Beschränkung der täglichen Na+-Zufuhr auf 50–80 mmol. Ein spezielles Problem sämtlicher Studien mit Patienten mit eingeschränkter Nierenfunktion ist, dass sie nur mit Office-Blutdruckmessungen durchgeführt wurden. Unter Behandlung ist gerade bei diesen Patienten jedoch der Anteil mit maskierter nächtlicher Hypertonie (70 %) extrem hoch. Die Häufigkeit einer fehlenden Nachtabsenkung hat zuletzt zu dem Konzept geführt, einen Teil der Blutdruckmedikation am Abend einnehmen zu lassen. Tatsächlich haben einige kleinere Studien damit nicht nur eine bessere Senkung des nächtlichen Blutdrucks zeigen können, sondern auch eine Reduktion von Albuminurie. Hermida berichtete indessen 2011 über eine nahezu unglaubliche Reduktion kardiovaskulärer Endpunkte um etwa 70 % in einer offenen, randomisierten Studie mit 661 Patienten mit eingeschränkter Nierenfunktion durch Einnahme von mindestens einem Blutdruckmittel am Abend vs. der Einnahme aller Medikamente am Morgen. Prinzipiell ist es keine schlechte Idee, einen Teil der Blutdruckmedikation am Abend zu verordnen, besonders bei Patienten mit ungenügender Nachtabsenkung. Ob und in welchem Ausmaß sich damit tatsächlich renale und kardiovaskuläre Folgeerkrankungen vermeiden lassen, werden hoffentlich weitere Studien zeigen.
Nierenarterienstenosen: Hier herrscht die Meinung vor, eine Katheterintervention bei jüngeren Personen mit engen fibromuskulären Stenosen durchzuführen, falls diese einer Intervention zugänglich sind. Bei arteriosklerotischen Stenosen neigt man nach enttäuschenden Ergebnissen großer randomisierten Studien dazu, es nur in ausgesuchten Fällen zu versuchen, etwa wenn der Blutdruck medikamentös unbeherrschbar ist und Komplikationen wie rezidivierendes Lungenödem aufgetreten sind.
Katheter-Ablation des sympathischen Nervengeflechts: Mit der Katheter-Ablation des sympathischen Nervengeflechts, das die Nierenarterien umgibt, wurde über erste vielversprechende Ergebnisse bei therapierefraktären Hochdruckpatienten berichtet. Kritisch anzumerken ist allerdings, dass die in diesen Studien verwendeten Office-Blutdruckmessungen keine zuverlässige Erfolgsbeurteilung erlauben. In Österreich ist ein Register eingerichtet worden, in dem der Blutdruck von Ablations-Patienten nun auch mit ambulantem Blutdruck- Monitoring (24 h) erfasst wird.
FACT-BOX
Schon geringe Einschränkungen der Nierenfunktion und/oder Eiweißausscheidung erhöhen das kardiovaskuläre Risiko von Hochdruckpatienten erheblich. eine konsequente Blutdrucksenkung deutlich unter 140/90 mmHg ist geboten. so gut wie immer ist eine Kombinationsbehandlung mit einem Hemmer des RAAS zusammen mit einem Kalziumantagonisten oder/und einem Diuretikum notwendig. der Behandlungserfolg sollte mittels ambulantem Blutdruckmonitoring kontrolliert und bei ungenügender Nachtabsenkung eine abendliche Medikamenteneinnahme verordnet werden. Für therapierefraktäre Fälle kommt die renale Sympathikusablation in Betracht.