Palliative Therapie
 Da das HCC in über 90 % der Fälle in einer zirrhotischen Leber jedweder Ursache entsteht, wird die Prognose des Patienten nicht nur durch den Tumor, sondern auch durch das Ausmaß der zu Grunde liegenden Lebererkrankung signifikant beeinflusst. Jede Therapieentscheidung sollte daher immer in Zusammenschau von Tumorlast und Leberfunktion getroffen werden.
Da das HCC in über 90 % der Fälle in einer zirrhotischen Leber jedweder Ursache entsteht, wird die Prognose des Patienten nicht nur durch den Tumor, sondern auch durch das Ausmaß der zu Grunde liegenden Lebererkrankung signifikant beeinflusst. Jede Therapieentscheidung sollte daher immer in Zusammenschau von Tumorlast und Leberfunktion getroffen werden.
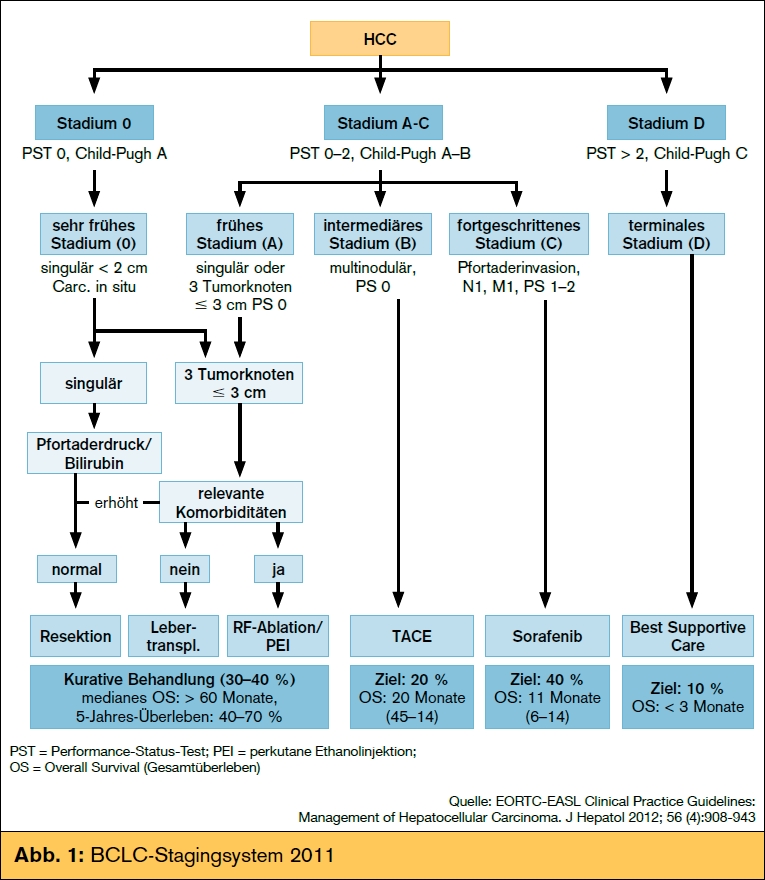
Ein Therapiealgorithmus, der diesen Anforderungen weitestgehend entspricht, ist das BCLC-Stagingsystem (Barcelona Clinic Liver Cancer Classification)1, 2, welches das Tumorstadium (Größe/Zahl der Tumorknoten, Gefäßinvasion, Metastasen), die Leberfunktionseinschränkung (Child-Pugh-Score) sowie den Allgemeinzustand (ECOG-Performance- Status) berücksichtigt und direkt mit evidenzbasierten Therapieoptionen verbindet. Abb. 1 gibt einen Überblick über das BCLC-Stagingsystem. Im folgenden Text wird speziell auf die palliativen Therapieoptionen eingegangen.
Behandlung des intermediären HCC (BCLC-Stadium B): Ein Patient mit einem intermediären HCC ist in einem sehr guten Allgemeinzustand, hat eine gute bis mittelmäßige Leberfunktion (Child-Pugh A bzw. B) und einen nicht resezierbaren bzw. transplantierbaren Tumor (1 Tumorknoten > 5 cm oder 3 Tumorknoten > 3 cm) ohne Hinweis auf extrahepatische Streuung bzw. Gefäßinvasion.
Die Behandlung der Wahl für diese Patienten ist die transarterielle Chemoembolisation (TACE). Die TACE von Ästen der A. hepatica ist möglich, da das HCC fast ausschließlich arteriell versorgt wird, während das Leberparenchym auch wesentlich von der Pfortader mitversorgt wird. Aus diesem Grund ist bei dieser Behandlung die Durchgängigkeit der Pfortader absolute Bedingung.
Nach interventionell-radiologischer Darstellung der tumorversorgenden Gefäße wird ein Doxorubicin- Lipiodol-Gemisch lokal ins Tumorgefäß appliziert und das Gefäß mit Embolisationsmaterial (z. B. Gelfoam u. a.) verschlossen („konventionelle“ TACE).
In einer der beiden positiven randomisierten TACE-Studien3 wurde Doxorubicin in Bilirubinadjustierter Dosierung (mg/dl) (< 1,5: 75 mg/ m2; > 1,5 < 3: 50 mg/m2, > 3: 25 mg/m2) zu den Zeitpunkten Baseline, Woche 2, Woche 24 und alle weiteren 24 Wochen bei Bedarf verwendet. In der 2. Studie4 kam Cisplatin (30 mg) zu den Zeitpunkten Baseline und danach alle 8–12 Wochen bei Bedarf zum Einsatz. Der „Bedarf“ richtete sich nach dem Vorhandensein von Kontrastmittel-aufnehmenden Resttumorknoten.
Bei optimaler Patientenselektion ist mit TACE im Vergleich zu supportiver Therapie eine Steigerung des medianen Gesamtüberlebens von 16 auf ca. 20 Monate möglich.5 Als häufige nebenwirkung tritt ein sog. „Postembolisationssyndrom“ bestehend aus Fieber, Erhöhung der Transaminasen, Übelkeit und Schmerzen auf, welches jedoch einerseits meist transient (1–3 Tage) und andererseits symptomatisch gut behandelbar ist. Seltenere, aber gefürchtete Komplikationen sind Leberabszesse bzw. ischämische Komplikationen anderer Organe durch retrograden Fluss von Embolisationsmaterial. Aufgrund der manchmal schwer vermeidbaren Mitembolisation von nicht-tumorösen Lebergewebe sind hepatale Dekompensationen nach TACE möglich. Diesbezüglich ist das Risiko besonders hoch, wenn Patienten mit fortgeschrittener Leberdysfunktion (Child-Pugh B > 7 Punkte) oder großen (≥ 10 cm) bzw. bilobulären Tumoren (mehrmals) behandelt werden. Eine a priori bestehende höhergradige Dekompensation mit Aszites und Ikterus ist ebenso wie eine massive bilobuläre Tumorlast als absolute Kontraindikation für TACE anzusehen.6
Zur Reduktion des hepatalen Dekompensationsrisikos sollte zumindest bei Patienten mit Risikofaktoren (Child-Pugh B, bilobuläre Tumorlast, ECOG 1) eine TACE mit Drug-eluting Beads (DEB-TACE) durchgeführt werden. Hier wird pharmazeutisch eine fixe Chemotherapie- Dosis (z. B. Doxorubicin) an das Embolisationsmaterial („beads“) gekoppelt und appliziert. Dies führt zu einer deutlich geringeren systemischen Doxorubicin-Resorption und somit zu weniger nebenwirkungen und zu höherer Effektivität bei Risikopatienten.7 Die aktuelle Forschungstätigkeit im Bereich des intermediären HCC fokussiert sich auf die Entwicklung von Kombinationstherapien mit TACE (z. B. Sorafenib plus TACE) bzw. die Erprobung neuer Interventionsformen wie SIRT (Selective Internal Radiation Therapy). Andere Initiativen testen diverse „Downstaging“-Protokolle, um Patienten mit intermediären HCC „transplantabel“ zu machen. Keine der erwähnten Innovationen können derzeit außerhalb von Studien routinemäßig empfohlen werden.
Patienten mit fortgeschrittenem HCC (BCLCStadium C): Patienten mit fortgeschrittenen HCC haben einen guten bis mäßigen Allgemeinzustand (ECOG 1–2), eine gute bis mittelmäßige Leberfunktion (Child-Pugh A bzw. B) bzw. einen Tumor jedweder Größe mit Hinweis auf extrahepatische Streuung bzw. Gefäßinvasion. Bei diesen Patienten kommt eine Therapie mit dem Multi-Tyrosinkinasen-Inhibitor Sorafenib als neuer therapeutischer Standard in Frage. Sorafenib inhibiert mehrere Signaltransduktionswege wie Raf/MEK/ERK, VEGFR, PDGFR-β, KIT, FLT-3 oder RET, die für Tumorzellproliferation und Angiogenese wichtig sind. Sorafenib wurde unter Beteiligung von 602 Patienten mit gut erhaltener Leberfunktion (Child-Pugh A) in der SHARP-Studie8 getestet, welche nach der zweiten Zwischenanalyse wegen eines signifikanten Überlebensvorteils unter Sorafenib gegenüber Placebo vorzeitig beendet wurde (median: 10,7 vs. 7,9 Monate; p = 0,00058, Abb. 2). Der positive Effekt auf 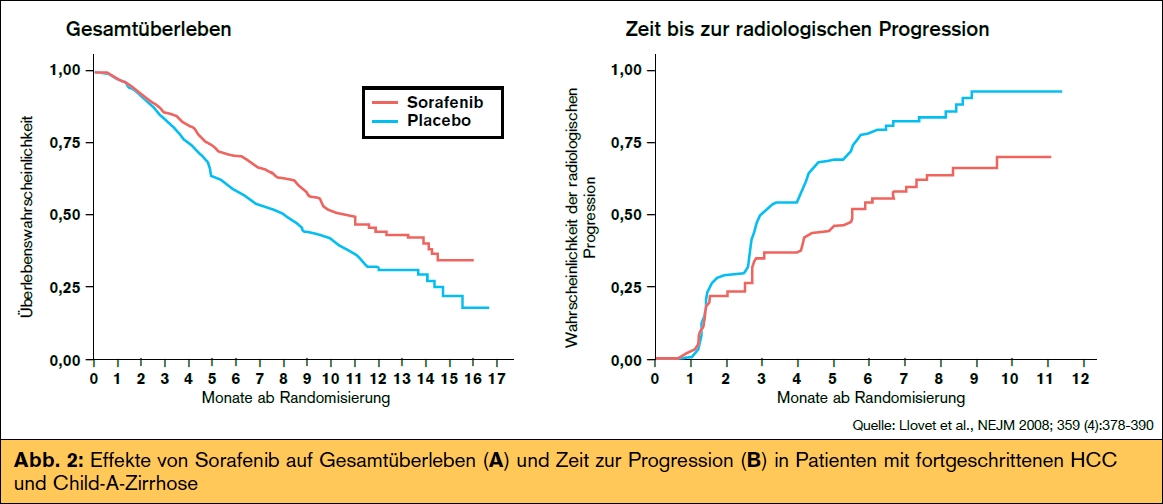 das Gesamtüberleben lag vermutlich an der Verdopplung der Zeit bis zur radiologischen Tumorprogression (2,8 auf 5,5 Monate, p = 0,000007; Abb. 2). Ähnliche Ergebnisse konnten in einer placebokontrollierten Studie in der Asien-Pazifik- Region erzielt werden.
das Gesamtüberleben lag vermutlich an der Verdopplung der Zeit bis zur radiologischen Tumorprogression (2,8 auf 5,5 Monate, p = 0,000007; Abb. 2). Ähnliche Ergebnisse konnten in einer placebokontrollierten Studie in der Asien-Pazifik- Region erzielt werden.
Die häufigste nebenwirkung einer Sorafenib- Behandlung ist Diarrhö, die durch die Gabe von Loperamid bzw. durch die Reduktion der Tagesdosis von 2 x 400 mg auf 1 x 400 mg kontrolliert werden kann. Auch Hand-Fuß-Syndrome und Hautausschläge werden beobachtet, allerdings seltener als bei Patienten mit nierenzellkarzinomen, für welche Sorafenib schon etwas länger zugelassen ist.
In einer Analyse österreichischer HCC-Patienten9 konnte eine enge Assoziation von Überlebenszeit unter Sorafenib mit dem Child-Pugh- Stadium gefunden werden. Patienten im Child- Pugh-Stadium B unter Sorafenib-Therapie haben in dieser Analyse ein deutlich schlechteres Überleben als Patienten mit gut erhaltener Leberfunktion (Child-Pugh A), nämlich 5,5 vs. 11,3 Monate, wobei eine GOT < 100 U/l ein unabhängiger Prädiktor (GOT < 100 vs. GOT > 100: 6,5 vs. 2,1 Monate) für das Überleben von Child-Pugh-B-Patienten unter Sorafenib war. Bei Child-Pugh-C-Patienten bzw. bei Patienten im BCLC-Stadium D war kein klinisch relevanter Therapieeffekt mehr nachweisbar (Gesamtüberleben < 3 Monate), sodass diese Patienten derzeit nur supportiv behandelt werden sollten (Abb. 1).
Die aktuelle Forschungstätigkeit im Bereich des fortgeschrittenen HCC liegt in der Evaluation neuer molekular gezielter Erst- und Zweitlinientherapien – als Mono-, aber auch als Kombinationstherapien. Substanzen wie Sunitinib und Linifanib (Erstlinie, Phase III) bzw. Brivanib in Zweitlinientherapie sind bereits gescheitert. Weitere Substanzen wie Ramucirumab, Everolimus und BIBF-1120 werden in internationalen Studien getestet, an denen auch österreichische Zentren teilnehmen.
HCC-Studienzentrum am AKH Wien: An der Universitätsklinik für Gastroenterologie und Hepatologie in Wien konnte diesbezüglich unter der Leitung von Prof. Peck-Radosavljevic ein HCC-Studienzentrum aufgebaut werden. Patientenvorstellungen zur Teilnahme an Studien, zur Therapieübernahme oder zur Einholung einer Zweitmeinung sind per E-Mail unter wolfgang.sieghart@meduniwien.ac.at bzw. tele fonisch unter 01-40400-4750 jederzeit herzlich willkommen.
FACT-BOX
- Das HCC entsteht in > 90 % der Falle in einer zirrhotischen Leber.
- Unter Berucksichtigung von Tumorlast und Leberfunktion werden im palliativen HCC-Management ein intermediares, ein fortgeschrittenes und ein terminales Stadium unterschieden.
- Das intermediare HCC wird mit transarterieller Chemoembolisation behandelt.
- Das fortgeschrittene HCC wird mit Sorafenib behandelt.
1 Forner A. et al., Semin Liver Dis 2010; 30 (1):61-74
2 EASL‚ EORTC Clinical Practice Guidelines: Management of hepatocellular carcinoma. Journal of Hepatology 2012; 56 (4):908-943
3 Llovet J.M. et al., The Lancet 2002; 359 (9319):1734-1739
4 Lo C.-M. et al., Hepatology 2002; 35 (5):1164-1171
5 Llovet J.M., Bruix J., Hepatology 2003; 37 (2):429-442
6 Raoul J.L. et al., Cancer Treatment Reviews 2011; 37 (3):212-20
7 Lammer J. et al., Cardiovasc Intervent Radiol 2009; 33 (1):41-52
8 Llovet J.M. et al., N Engl J Med 2008; 359 (4):378-390
9 Pinter M. et al., Alimentary Pharmacology & Therapeutics 2011; 34 (8):949-959























































































