ÖGN 2012: Muskel, Muskelerkrankungen und Alter
Sarkopenie
Als Sarkopenie bezeichnet man das physiologische Altern des Muskeln, das durch eine Abnahme der Muskelmasse und der Muskelkraft unabhängig von anderen Begleiterkrankungen charakterisiert ist. Die Sarkopenie muss streng unterschieden werden von der Kachexie multimorbider alter PatientInnen. Physiologischerweise vermindert sich die Muskelmasse vom 20. bis zum 70. Lebensjahr um etwa 40 %. Die Muskelkraft nimmt vom 30. bis zum 80. Lebensjahr um 30 % bis 50 % ab. Im Tierexperiment konnte gezeigt werden, dass im alten Muskel sowohl die Maximalkraft als auch die Geschwindigkeit der Kraftentwicklung geringer sind als beim adulten Muskel. Die verminderte Muskelkraft geht mit einer geringeren Muskelmasse im Alter einher. Das Körperfett ist invers assoziiert mit der Kraft1.
Gleichwohl ist die Kraft der Handmuskulatur und der Quadrizepsmuskulatur ein besserer Indikator für das Mortalitätsrisiko im Alter als die Muskelmasse. Es konnte auch gezeigt werden, dass die Masse und der Fettgehalt der Wadenmuskulatur keine Risikofaktoren für die erhöhte Mortalität im Alter darstellen. Vielmehr ist die Gehgeschwindigkeit des alten Menschen ein starker Prädiktor für die Mortalität, da diese offenbar die sarkopeniebedingte Sturzgefahr widerspiegelt2.
Zur Pathogenese der Sarkopenie gibt es verschiedene Hypothesen: So wird eine progrediente Denervation mit möglicherweise reduzierter kollateraler Reinnervation diskutiert, eine reduzierte Zahl motorischer Einheiten mit vergrößerten motorischen Einheiten, eine verminderte Proteinsynthese myofibrillärer Proteine, die Inaktivitätsatrophie und schließlich ein verändertes Äquilibrium trophischer Faktoren.
Systemische trophische Faktoren der Sarkopenie umfassen Testosteron und Präkursoren, Wachstumshormon, Insulin und Insulin- like growth factors, Thyroidhormone, Katecholamine, Zytokine und Entzündungsmediatoren.
Intrinsische trophische Faktoren der Sarkopenie sind Myogenic regulatory factors (MRF) und MRF-Koregulatoren (HLH-Proteine, MyoD, Myogenin, MYF5, MRF4), weiterhin der Notch-Signalweg, Myostatin sowie die interzelluläre Kalziummyostase3.
Eine besondere Bedeutung in der Entstehung der Sarkopenie kommt offenbar den Mitochondrien zu. So wird eine gestörte mitochondriale Proliferation beobachtet, die zu einem altersbedingten Auftreten von „ragged red fibres“ (RRF) führt, ein Anstieg des mtDNA-Gehaltes sowie ein Anstieg von „nuclear-mitochondrial cross-talk“-Faktoren (TFAM und NRF-1). Ebenso kommt es im Alter zur Akkumulation von großen Deletionen der mtDNA und zu einem muskelspezifischen Auftreten von Punktmutationen der mtDNA-Replikationskontrollregion. Tatsächlich konnte gezeigt werden, dass der Prozentsatz von RRF im alten, normalen Muskel deutlich höher ist als im jungen Muskel4. Gleichwohl ist die Häufigkeit von RRF im Alter geringer als die, die man bei mitochondrialen Myopathien findet. Bislang gibt es keine Medikamente, die das Auftreten der Sarkopenie wirksam verhindern können. Allerdings gibt es die Meinung, dass in nicht allzu ferner Zukunft entweder bereits bekannte Medikamente oder Neuentwicklungen gezielt gegen die Entwicklung der Sarkopenie eingesetzt werden können, wobei insbesondere Medikamente gegen neurodegenerative Erkrankungen in Frage kommen5.
Medikamentös-toxische Myopathien
Aufgrund der Tatsache, dass ältere Menschen auch vermehrt eine Vielzahl von Medikamenten einnehmen, ist das Risiko von Myopathien in Folge von Medikamentennebenwirkungen im Alter deutlich erhöht. An erster Stelle sind hier die Lipidsenker und insbesondere die Statine zu nennen. Andere, im Alter häufig verordnete Medikamente mit muskulären Nebenwirkungen sind u. a. Fibrate, Barbiturate, Laxanzien, Diuretika und Zyklosporin.
Myopathien und Statine: Nebenwirkungen der Statine am Skelettmuskel können in 5 Kategorien klassifiziert werden, die in unterschiedlichem Ausmaß auch kombiniert auftreten können (Tab.). Hinsichtlich der am häufigsten beobachteten CK-Erhöhung muss sorgfältig analysiert werden, ob es sich um eine klinisch asymptomatische oder symptomatische Hyper-CKämie handelt. Eine asymptomatische CK-Erhöhung unter Statintherapie ist in der Regel kein Grund, diese Therapie abzusetzen. Hier sind Verlaufsuntersuchungen sinnvoll. Schwerwiegender sind demgegenüber Attacken von Rhabdomyolyse oder eine nekrotisierende Myopathie unter Statineinnahme. Beide Komplikationen sind jedoch sehr selten.

Die nekrotisierende Myopathie unter Statingabe ist erst seit Kurzem bekannt und stellt einen interessanten pathogenen Autoimmunmechanismus dar: Man nimmt an, dass durch die Hemmung der HMG-CoA-Reduktaseaktivität durch Statine eine vermehrte Expression des Enzymproteins einen antigenen Reiz ausübt, was dann zu einer Autoimmunreaktion führen kann, die auch nach Absetzen der Statine weiter wirksam ist6.
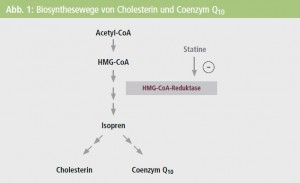
Die Pathogenese der statininduzierten muskulären Symptome (mit Ausnahme der nekrotisierenden Myopathie) ist letztlich noch nicht geklärt. Eine Hypothese beruht darauf, dass sowohl Cholesterin als auch Coenzym Q bis zum Isopren über einen gemeinsamen Syntheseweg laufen, der auch die HMG-CoAReduktase benötigt (Abb. 1). Eine Hemmung dieses Enzyms durch Statine führt deshalb auch zu einer deutlichen Erniedrigung des Coenzym-Q-Serumspiegels. Hinsichtlich der Coenzym-Q-Konzentration im Muskel unter Statintherapie gibt es hingegen widersprüchliche Studien, die von einer leichten, nicht signifikanten Erniedrigung bis zu einer Erniedrigung um 34 % reichen. In anderen Studien konnte eine substanzabhängige Veränderung des mtDNA/nDNA-Quotienten im Muskel unter Statintherapie beobachtet werden. Andere Hypothesen zum Pathomechanismus sind eine veränderte Membranfluidität und elektrische Erregbarkeit aufgrund der Cholesterinsenkung, eine verminderte isoprenabhängige Glykosylierung von Membranproteinen (alpha- Dystroglycan, Lamin A/C) sowie die Provokation einer latenten Myopathie durch Statine (z. B. Minicore-Myopathie, CPT-IIMangel, Glykogenose McArdle).
Bemerkenswerterweise scheint für Simvastatin das Risiko einer Myopathie von einem Polymorphismus in einem organische Anionen transportierenden Polypeptid abhängig zu sein, welches die hepatische Aufnahme von Statinen ermöglicht7.
Zyklosporininduzierte Myopathie: Neben einer akuten Form mit Rhabdomyolyse, für die besonders in Kombination von Statinen und Zyklosporin ein erhöhtes Risiko besteht, gibt es eine chronische Form, die von Myalgien und Paresen gekennzeichnet ist, nach 5–25 Monaten unter Zyklosporintherapie auftreten kann und nach Absetzen reversibel ist. Myopathologisch finden sich hierbei u. a. auch RRF, die leicht zur Fehldiagnose einer genetisch bedingten mitochondrialen Erkrankung verleiten können.
Myopathien mit spätem Manifestationsalter
Sowohl erworbene als auch genetisch determinierte Myopathien können sich erstmals im hohen Erwachsenenalter manifestieren.
Okulopharyngeale Muskeldystrophie (OPMD): Diese autosomal dominante, häufig auch sporadisch auftretende Myopathie ist durch eine beidseitige Ptose, Dysphagie und proximale Paresen gekennzeichnet. Molekulargenetisch handelt es sich um eine GCGRepeat- Expansion im PABP2-Gen. Charakteristisch ist, dass sich diese Erkrankung erst jenseits des 50. Lebensjahres manifestiert (Abb. 2).
Mitochondriale Myopathien: Obgleich sich die verschiedenen gut bekannten Syndrome mitochondrialer Enzephalomyopathien (z. B. CPEO-plus, MELAS, MERFF) meist im Jugendalter manifestieren, gibt es auch mitochondriale Erkrankungen, die nahezu ausschließlich die Skelettmuskulatur betreffen und erst im höheren oder hohen Lebensalter auftreten. Hier lässt sich die Diagnose neben den typischen histopathologischen Veränderungen molekulargenetisch durch den Nachweis von Punktmutationen der mtDNA sichern (Abb. 3).
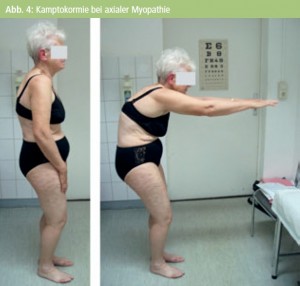
Kamptokormie: Bei einer häufig erst im Alter deutlich werdenden Kamptokormie muss zwar in erster Linie an eine Parkinson‘sche Erkrankung gedacht werden, andererseits gibt es aber auch verschiedene genetisch determinierte Myopathien, die sich erst im späten Erwachsenenalter als Kamptokormie manifestieren oder als isolierte axiale Myopathie bislang noch nicht genauer eingeordnet werden können (Abb. 4).
Fazit
Erst die Kenntnis der verschiedenen ursächlichen Möglichkeiten, die im Alter zu einer behindernden Funktionseinschränkung des Muskels führen, erlaubt im Einzelfall eine Einschätzung, ob eine verminderte Muskelfunktion im Alter Krankheitswert hat und gegebenenfalls behandelt werden kann.
1 Newman AB, Haggerty CL, Goodpaster B, Harris T, Kritchevsky S, Nevitt M, Miles TP, Visser M, Strength and muscle quality in a well-functioning cohort of older adults. J Am Geriatr Soc 2003; 51:323–330
2 Cesari M, Pahor M, Lauretani F, Zamboni V, Bandinelli S, Bernabei R, Guralnik JM, Ferrucci L, Skeletal muscle and mortality results from the InCHIANTI study. J Gerontol A Biol Sci Med Sci 2009; 64:377–384
3 Ryall JG, Schertzer JD, Lynch GS, Cellular and molecular mechanisms underlying age-related skeletal muscle wasting and weakness. Biogerontology 2008; 9:213–228
4 Rifai Z, Welle S, Kamp C, Thornton CA, Ragged red fibers in normal aging and inflammatory myopathy. Ann Neurol 1995; 37:24–29
5 Lynch GS, Update on emerging drugs for sarcopeniaage related muscle wasting. Expert Opin Emerg Drugs 2008; 13:655–673
6 Mammen AL, Chung T, Christopher-stine L, Rosen P, Rosen A, Doering KR, Casciola-Rosen LA, Autoanti bodies against 3-hydroxy-3-methylglutaryl-coenzyme A reductase in patients with statin-associated autoimmune myopathy. Arthritis Rheumatism 2011; 63:713–721
7 SEARCH Collaborative group, SLCO1B1 variants and statin-induced myopathy – A genomewide study. N Engl J Med 2008; 359:789–799 Zierz S, Jerusalem F, Muskelerkrankungen. Thieme-Verlag Stuttgart (4. Aufl. in Vorbereitung)