[DGPPN 2010] Die Zukunft der Depressionsforschung
Die heutigen Diagnoseschemata sind für die Grundlagen- und Therapieforschung unbrauchbar, da der kategoriale Ansatz durch die Erkenntnisse der Neurowissenschaften nicht gestützt wird“, betonte Holsboer. In humangenetischen Untersuchungen haben sich mehrere nahezu identische Genvarianten sowohl bei Patienten mit Schizophrenie als auch bei bipolaren Störungen finden lassen. Heute werde kontrovers diskutiert, ob sich bei dieser Befundlage die Dichotomisierung noch aufrechterhalten ließe. Gemeinsame Genvarianten finden sich auch zwischen unipolarer und bipolarer Depression. Wie wenig sinnvoll es sei zwischen uni- und bipolarer Depression zu unterscheiden, zeige auch die Langzeitstudie von Angst, die eine konstante Konversionsrate von unipolar zu bipolar von 1,25 % pro Jahr nachwies, „was nichts anderes bedeutet, als dass alle unipolar depressiven Patienten einmal bipolar werden, wenn sie nur lange genug leben“.
Validität diagnostischer Kategorien? Besser wäre es, psychiatrische Krankheiten dimensional und nicht kategorial zu charakterisieren. Bei der Depression erstreckt sich das Spektrum von der depressiven Persönlichkeit bis zur wahnhaften Depression. Diese Vorgehensweise sei zwar plausibler als das Festhalten an Kategorien, allerdings löse sie nicht das Problem fehlender Spezifität bezüglich krankheitsverursachender Mechanismen. „Das Ziel zukünftiger Kausalforschung muss sein, mit Hilfe von Gentests und Biomarkern die heute noch weit gefassten Diagnosegruppen in homogene Patientenuntergruppen aufzuteilen“, so Holsboer. „Patienten, die einer solchen Subgruppe angehören, werden auf ein spezifisch auf ihren persönlichen Krankheitsmechanismus gerichtetes Antidepressivum (AD) besser ansprechen als auf ein Einheitsmedikament.“
Biomarker sind erforderlich: Allein auf der Grundlage von Gentypisierung und DNA-Sequenzierung könne dies nicht gelingen, da der Phänotyp bei einer so komplexen Erkrankung wie der Depression immer das Ergebnis der Wechselwirkung von genetischer Disposition und Umwelteinflüssen sei, die von frühkindlichen oder späteren Traumatisierungen bis hin zu Ernährung und Erkrankung reichen. Derartige exogene Faktoren können zu bleibenden Veränderungen der Aktivierbarkeit einzelner Gene führen, deren Nukleinbasensequenz bleibt dabei unverändert. „Diese erworbenen zellbiologischen ‚Narben‘ stehen derzeit im Mittelpunkt der psychiatrischen Epigenetik“, sagte Holsboer.
„Wir beginnen erst allmählich zu verstehen, wie die transgenerationale Weitergabe epigenetischer Modifikation, also die ‚Vererbung von Erfahrungen‘ unser Erkrankungsrisiko prägt. Auf epigenetische Prozesse gerichtete pharmakologische Interventionen, etwa nach einem Trauma, bekommen hier nicht nur für den Betroffenen selbst, sondern auch für die Nachkommen eine bis vor kurzem noch nicht erkannte Bedeutung.“
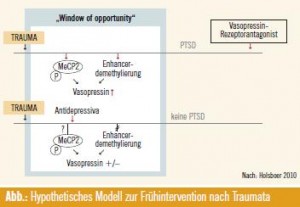
Personalisierte Depressionstherapie: Beispielsweise wäre es heute schon denkbar einem Menschen, der ein schweres Trauma erlebt hat, frühzeitig ein AD zu geben, das die biochemischen Effekte aufhält, damit es nicht zur Erhöhung des Risikos einer PTSD oder Depression kommen kann (Abb.). „Die Entwicklung von Biomarkern und Gentests muss daher höchste Priorität haben, die uns erlauben, schon lange bevor subjektiv wahrnehmbare klinische Symptome auftreten, das Erkrankungsrisiko zu bewerten und gezielt präventiv zu intervenieren.“
2020 werde die personalisierte Depressionstherapie neben komplexen Biomarkern wie dem Dexamethason/CRH-Test oder dem Schlaf-EEG auch auf Genexpressionsprofile gestützt sein. „Global wirksame AD – Blockbuster – werden dann durch spezifische Medikamente sowie deren Kombinationen abgelöst werden.“ Auch heute unterscheiden sich die zur Verfügung stehenden AD bereits hinsichtlich vieler pharmakologischer Effekte erheblich. Dies könne aber bislang aufgrund fehlender Entscheidungshilfe aus dem Labor nicht genutzt werden. Quelle: DGPPN-Kongress, Plenarvortrag „Die Zukunft der Depressionsforschung“, 25. 11. 2010, Berlin