SGLT-2-Inhibitoren: Was kann man sich erwarten?
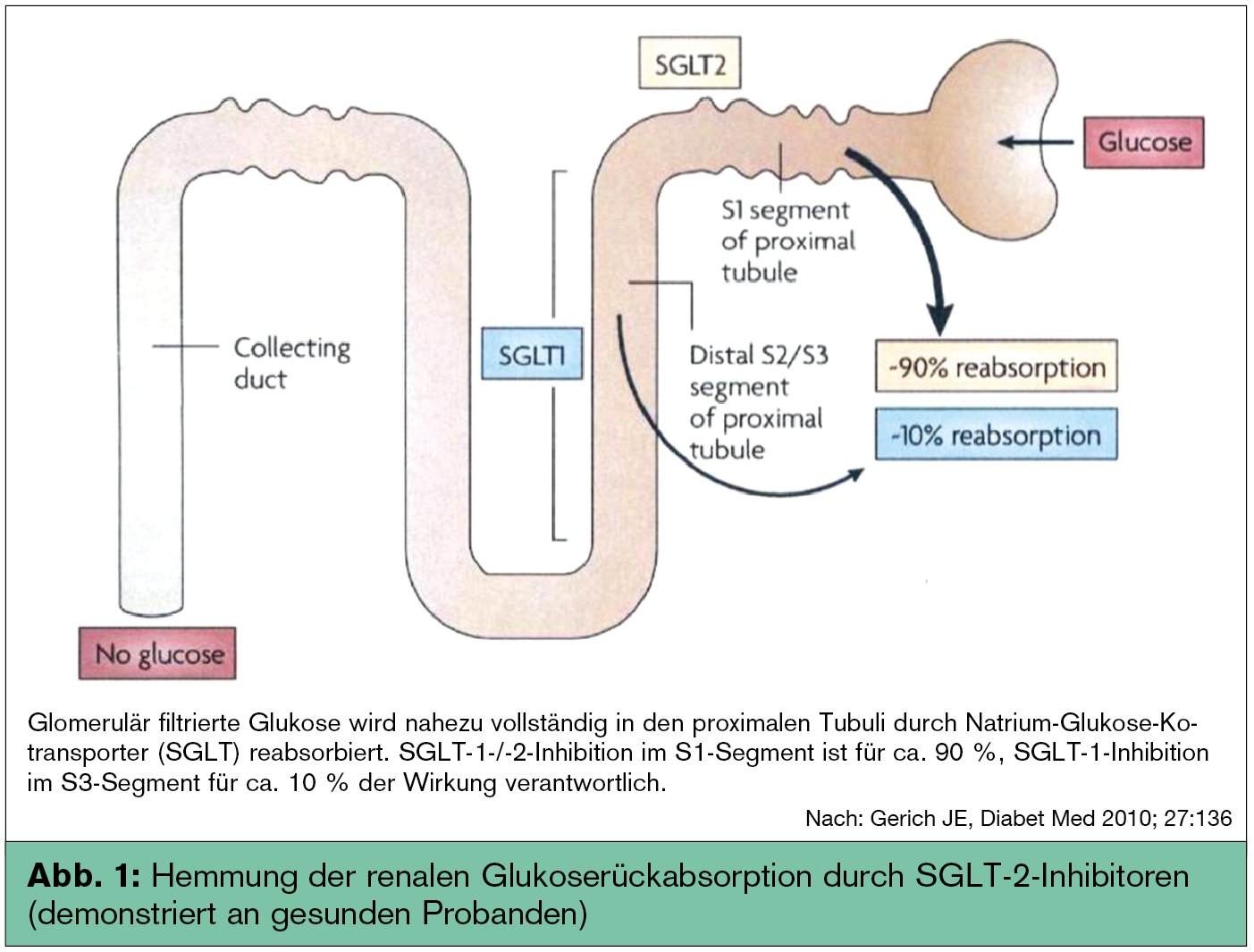
Die Niere spielt eine zentrale Rolle in der Glukoseregulation. Bei gesunden Menschen werden mehr als 99 % der in der Niere filtrierten Glukose durch aktive Transportmechanismen rückresorbiert. Diese Rückresorption wird im Wesentlichen durch das Transportsystem der Natrium-Glukose-Kotransporter („sodium-glucose co-transporter“, SGLT) bewerkstelligt. SGLT sind eine große Familie von Membranproteinen, allen voran die SGLT-1- und SGLT-2-Transporter, die für den aktiven Transport durch Epithelien, z. B. des Darms und der Niere wichtig sind. Neben dem Transport der Glukose werden durch SGLT-1 und SGLT-2 auch Aminosäuren, Vitamine und Ionen über das Darmepithel oder über das Epithel des proximalen Tubulus rückresorbiert. SGLT-1-Transporter sind vornehmlich im Gastrointestinaltrakt aktiv, während die SGLT-2-Transporter mit einer hohen Kapazität und einer niedrigen Affinität vorwiegend in der Niere aktiv sind. Daneben gibt es auch noch andere Transporter (SGLT-3 bis SGLT-6), deren Funktion derzeit noch nicht restlos geklärt ist.
Die für die Rückresorption der Glukose aus dem proximalen Tubulussystem wichtigen SGLT-2-Rezeptoren sind für ca. 90 % der Glukosereabsorption der Niere verantwortlich. Die ebenfalls in der Niere gefundenen, weiter distal lokalisierten SGLT-1-Rezeptoren sind nur für ca. 10 % der Glukose-Rückresorption verantwortlich (Abb. 1). Obwohl ca. 180 g Glukose/d von einer normalen Niere filtriert werden, werden nur ungefähr 500 mg Glukose während einer 24-Stunden-Periode ausgeschieden. Der Rest wird aktiv durch das Transportsystem der SGLT-1- und SGLT-2-Transporter rückresorbiert.
Familiäre renale Glukosurie
Genmutationen im Bereich des SGLT-2-Rezeptors haben eine seltene hereditäre Erkrankung, nämlich die familiäre renale Glukosurie zur Folge. Patienten mit dieser Erkrankung scheiden bis zu 170 g Glukose/Tag ab. Sie sind üblicherweise asymptomatisch und weisen keine weiteren Abnormalitäten des Glukosestoffwechsels oder der Nierenfunktion auf. Bei familiärer renaler Glukosurie gibt es keine Häufung von Diabeteserkrankungen oder chronischen Nierenerkrankungen. Auch Harnwegsinfekte kommen nicht häufiger vor als in der Normalpopulation. Diese Patienten haben üblicherweise eine normale Lebenserwartung. Familiäre renale Glukosurie wird als Modell für die therapeutische SGLT-2-Hemmung angesehen.
Entwicklung der SGLT-Inhibitoren
Der Wirkstoff Phlorizin wurde 1835 erstmals durch französische Chemiker aus der Rinde von Apfelbäumen isoliert und in den Merck-Index von 1887 als Glukosid aus der Wurzelrinde des Apfelbaumes eingetragen. Tierversuche haben gezeigt, das Phlorizin eine vermehrte Glukoseausscheidung im Harn induziert und dass es dadurch zu einer Normalisierung von Nüchtern- und postprandialen Blutzuckerwerten kommt. Ebenso wurde unter dem Medikament eine Normalisierung der Insulinsekretion, sowohl der ersten als auch der zweiten Phase beobachtet. Später wurde entdeckt, dass der Wirkmechanismus von Phlorizin auf eine reversible Hemmung des SGLT-2-Rezeptors zurückzuführen ist, der eine Reabsorption der Glukose aus dem proximalen Tubulus der Niere verhindert. Die therapeutische Anwendung von Phlorizin war aber durch mehrere erhebliche Nachteile limitiert: Grundsätzlich war die Wirkung von Phlorizin nicht selektiv. Neben einer Hemmung von SGLT-2-Transportern wurden auch die im Magen-Darm-Trakt wichtigen SGLT-1-Transportaktivitäten gehemmt.
In den letzten Jahren wurden selektive SGLT-2-Inhibitoren entwickelt, die zu einer teilweise selektiven Blockade der SGLT-2-Aktivität im proximalen Tubulus der Niere führen. Dadurch kommt es zu einer vermehrten Glukosurie und damit verbunden zu einem Absinken der Blutzuckerspiegel. Derzeit sind mehrere selektive SGLT-2-Inhibitoren in der Entwicklung, das sind vor allem Dapagliflozin, Empagliflozin und Canagliflozin (Abb. 2).
Klinische Daten
Dapagliflozin ist in der Entwicklung am weitesten fortgeschritten und hat bereits eine positive Opinion der Europäischen Arzneimittelbehörde (EMA) für die Zulassung bekommen. Dapagliflozin ist ein hochselektiver Hemmer der SGLT-2-Rezeptoren. In In-vitro-Studien war Dapagliflozin ungefähr 30-mal wirksamer als Phlorizin. Im Tierversuch bei Ratten führte Dapagliflozin zu einem Anstieg der Glukosurie auf das Doppelte, was ein Absinken sowohl der Nüchtern- als auch der postprandialen Blutzuckerspiegel zur Folge hatte. In Dosisfindungsstudien bei Menschen wurde nach 12 Wochen ein Abfall des HbA1c-Wertes in der Größenordnung von –0,55 bis –0,9 Prozentpunkten unter einer Dosis von 2,5–20 mg beobachtet. Ebenso wurde eine Gewichtsabnahme in der Größenordnung von –2,5 % bis –3,4 % gemessen.
In einer 24-wöchigen Studie wurde die Kombination Metformin/Dapagliflozin mit einer Monotherapie von Metformin und Dapagliflozin verglichen. Dabei wurde unter der Kombinationstherapie ein signifikant größerer HbA1c-Abfall als in der jeweiligen Monotherapie beobachtet. Unter der Kombination Dapagliflozin/Metformin wurde eine Reduktion des HbA1c von 2,5 Prozentpunkten gesehen, während unter der jeweiligen Monotherapie HbA1c-Abfälle von 1,19 Prozentpunkten unter Dapagliflozin und 1,35 Prozentpunkten unter Metformin gesehen wurden.
Der Effekt von Dapagliflozin wurde auch bei mit Insulin behandelten Typ-2-Diabetikern mit schlechter Einstellung beobachtet. Auch hier sah man HbA1c-Abfälle in der Größenordnung von 0,8 bis 0,9 Prozentpunkten. Neben einer Blutzuckerreduktion in allen diesen Studien wurden auch signifikante Abfälle des Gewichtes gesehen. In der Kombination mit Metformin betrug der über zwei Jahre persistierende Gewichtsverlust –2,8 kg, verglichen mit nur –0,7 kg in der Placebogruppe. Bei Patienten, die mit Insulin behandelt wurden, wurden unter einer Dosierung von 10 mg Dapagliflozin deutlich größere Gewichtsabfälle (bis zu 4,5 kg) gesehen.
Sowohl für Canagliflozin als auch für Empagliflozin konnte in Dosis-Wirkungs-Studien nach 12 Wochen eine Abnahme der HbA1c-Werte in der Höhe von 0,7 bis 0,9 Prozentpunkten beobachtet werden. In diesen Untersuchungen wurde ebenfalls eine begleitende Abnahme des Nüchtern- als auch des postprandialen Blutzuckerspiegels gesehen und eine Zunahme der Glukosurie. Ebenso wurden Gewichtsreduktionen im Ausmaß von 1–2,5 kg beobachtet.
Nebenwirkungen und Sicherheit
Bei allen drei SGLT-2-Inhibitoren gibt es naturgemäß noch keine Langzeitdaten über potenzielle Nebenwirkungen. In allen bisherigen Studien wurden aber keine schweren Hypoglykämien beobachtet. Die verstärkte Glukosurie kann zu einem erhöhten Risiko für genitale Pilzinfektionen und Harnwegsinfekte dienen. Tatsächlich wurden in einigen Studien vermehrt vulvovaginale Infektionen bei Frauen und Balanitiden bei Männern im Vergleich zur Placebogruppe beobachtet. Die meisten dieser Infektionen waren aber mild und konnten leicht beherrscht werden. Bei wenigen Patienten führten diese Nebenwirkungen zu einem Absetzen der Präparate.
Unter SGLT-2-Inhibitoren wird ein leichter Abfall des Blutdruckes in der Größenordnung von 3–5 mmHg systolisch und 2 mmHg diastolisch beobachtet. Diese Blutdruckreduktionen sind auf den diuretischen Effekt dieser Substanzklasse zurückzuführen, weshalb eine vermehrte Anzahl von orthostatischen, hypotensiven Reaktionen beobachtet wurde.
Obwohl es durch die vermehrte Ausscheidung von Glukose unter SGLT-2-Inhibitoren auch zu einer vermehrten Natriumausscheidung kommt, wurden während der Studien keine signifikanten Änderungen des Serumnatriumspiegels beobachtet. Es wurde unter SGLT-2-Therapie lediglich leichte Anstiege des Serummagnesium- und des Phosphorspiegels, des Hämatokrits und des Blut-Harnstoff-Stickstoffs (BUN) gesehen, das Serumkreatinin hatte sich nicht verändert. Die Erhöhung des Hämatokrits ist jedenfalls mit der erhöhten diuretischen Wirkung dieser Substanzklassen verbunden. Ebenso wurden leichte Abfälle des Harnsäurespiegels und des hochsensitiven C-reaktiven Proteins (CRP) gesehen. Die klinischen Implikationen dieser Veränderungen sind bis dato nicht völlig geklärt.
Klinische Anwendung und unbeantwortete Fragen
Die Pathogenese des Typ-2-Diabetes mellitus ist multifaktoriell. Neben einer gestörten Insulinwirkung und einer gestörten Insulinsekretion beeinflussen eine Unzahl genetischer und Umweltfaktoren den Glukosestoffwechsel. Aufgrund des sehr heterogenen Krankheitsbildes des Typ-2-Diabetes mellitus können SGLT-2-Inhibitoren breit eingesetzt werden, da sie zu einem Absinken der Blutzuckerspiegel vor jedem pathogenetischen Hintergrund und bei jeder Vormedikation führen. Aufgrund der niedrigeren Nüchtern- und postprandialen Blutzuckerspiegel erreicht man sekundär eine Verbesserung der Insulinsekretion und Insulinwirkung. Darüber hinaus kann man diese Substanzklasse nicht nur bei Typ-2-Diabetikern, sondern auch bei Typ-1-Diabetikern einsetzen.
Neben der breiten Einsatzmöglichkeit der SGLT-2-Inhibitoren ist auch der mögliche therapeutische Effekt auf andere Komponenten des metabolischen Syndroms, wie Lipide, Hypertonie und Übergewicht ein sehr günstiger. Die Gewichtsabnahme könnte vor allem in Kombination mit Insulin ein großer Vorteil dieser neuen Substanzklasse sein.
Inwieweit mögliche urogenitale Infektionen oder bisher unentdeckte Langzeitnebenwirkungen den Einsatz der neuen Substanzklasse in der Praxis limitieren, lässt sich derzeit nicht abschätzen.
Resümee: SGLT-2-Inhibitoren sind eine vielversprechende neue therapeutische Option in der Behandlung des Typ-2-Diabetes. SGLT-2-Transporter sind für die Rückresorption von Glukose aus dem proximalen Tubulus der Nieren verantwortlich. Wird diese Rückresorption von Glukose bei Typ-2-Diabetes gehemmt, kommt es zu einer vermehrten Ausscheidung von Glukose durch den Urin und damit verbunden zu einem Absinken der Nüchtern- und postprandialen Blutzuckerwerte.
Zusätzlich wird durch die Steigerung der Glukosurie bei den meisten Patienten eine mäßige Gewichtsreduktion induziert. Das neue Wirkprinzip kann daher bei nahezu allen Typ-2-Diabetikern, ja sogar beim Typ-1-Diabetes angewendet werden und stellt eine zusätzliche therapeutische Möglichkeit in der Behandlung des Typ-2-Diabetes dar.