Das PCO-Syndrom (PCOS) zählt zu den häufigsten Endokrinopathien der Frau, wobei das komplexe Zusammenspiel von prädisponierenden genetischen Faktoren und exogenen Einflüssen zur sehr heterogenen phänotypischen Ausprägung führt.
Klinische Symptomatik
Hauptmerkmale des Syndroms sind die aufgrund der chronischen Anovulation auftretenden Zyklusstörungen (am häufigsten Oligomenorrhö), Hyperandrogenämie (biochemisch und/oder klinisch) sowie das typische namensgebende ultrasonografische Bild der polyzystischen Ovarien. Den „Rotterdam-Kriterien“ zufolge müssen zur Diagnosestellung mindestens 2 dieser 3 Kriterien erfüllt sein. Das PCOS wird häufig auch als „metabolisch-reproduktives Syndrom“ bezeichnet, wobei es im Laufe das Lebens einer Frau zum sog. Phenotype Drift kommt: In jungen Jahren bestehen häufig kutane Hyperandrogenisierungserscheinungen wie Akne und Hirsutismus sowie reproduktive Probleme (Zyklusunregelmäßigkeiten und unerfüllter Kinderwunsch). Mit fortschreitendem Lebensalter rückt zunehmend die metabolische Komponente des Syndroms – mit Erkrankungen des kardiovaskulären Formenkreises – in den Vordergrund.
Therapie nach Beschwerden
Interdisziplinäres Vorgehen und adäquates Einstellen von Blutdruck, Glukose- und Lipidstoffwechsel sind obligat. Je nach vorherrschender Beschwerdesymptomatik und individuellem Behandlungsziel stehen uns heute eine Reihe von therapeutischen Optionen zur Verfügung.
Hyperandrogenisierung
In jungen Jahren besteht häufig großer Leidensdruck wegen kutaner Hyperandrogenisierungserscheinungen, die fast immer durch die Gabe kombinierter oraler Kontrazeptiva (COC) gebessert werden können. Die Pille wirkt hierbei hauptsächlich über die Senkung der Testosteronproduktion und über vermehrte Androgenbindung an SHBG. Zusätzlich kommt es zu einer α-Reduktase-Hemmung und zur kompetitiven Blockade des kutanen Androgenrezeptors durch die Gestagene Cyproteronacetat, Dienogest, Drospirenon und Chlormadinonacetat, was COC mit diesen Komponenten besonders wirksam macht. Allerdings sollte die Patientin darüber aufgeklärt sein, dass es frühestens innerhalb von 3–6 Monaten zu einer Verbesserung des Hautbildes und der übermäßigen Behaarung kommt. Sinnvollerweise soll die systemische Therapie mit topischen und/oder mechanischen Therapieverfahren kombiniert werden. Kommt es nicht zur gewünschten Verbesserung, so ist die zusätzliche Antiandrogengabe der nächste therapeutische Schritt. Hier ist die additive Verabreichung von Cyproteronacetat, Spironolacton, Finasterid oder Flutamid eine Option. In jedem Fall ist bei Anwendung all dieser potenziell teratogenen Substanzen eine sichere Kontrazeption erforderlich.
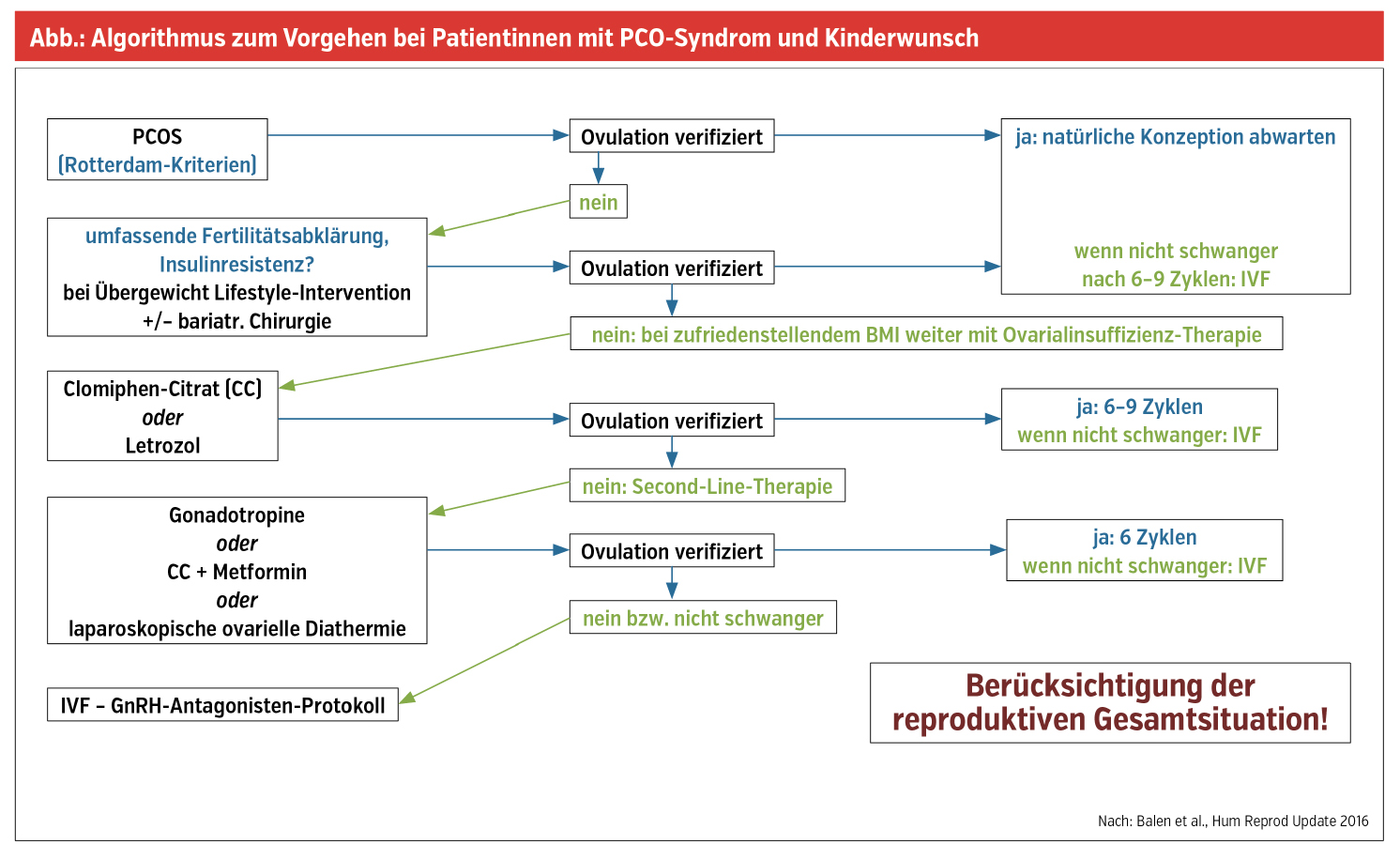
Stufenweises Vorgehen bei unerfülltem Kinderwunsch
Steht die anovulatorische Infertilität im Vordergrund, so soll primär bei übergewichtigen Patientinnen eine Lifestyle-Modifikation mit dem Ziel der moderaten Gewichtsreduktion angestrebt werden. Häufig kommt es allein dadurch zu ovulatorischen Zyklen und zum Eintritt von Spontanschwangerschaften. In jedem Fall aber kann mit besserem Ansprechen auf die medikamentöse Ovulationsinduktion und mit einer niedrigeren Komplikationsrate in der Schwangerschaft gerechnet werden. Bei bestehender oder beginnender Insulinresistenz ist zusätzlich Metformin von Vorteil. Zur besseren Verträglichkeit soll dieses immer niedrig dosiert begonnen und einschleichend (zum Essen!) verabreicht werden. Neueren Daten zufolge sind die ausreichende Vitamin-D-Supplementation und der großzügige Einsatz von Inositol gerade in diesem Patientinnenkollektiv sinnvoll und wichtig. Unter Inositol wurde neben der Verbesserung einer vorhandenen Insulinresistenz und der effektiven Senkung der Testosteronspiegel auch eine deutliche Verbesserung der Oozytenqualität beobachtet.
Hinsichtlich der medikamentösen Ovulationsinduktion war lange Jahre Clomifen-Citrat (CC) die unumstrittene Nr. 1. Rezente Daten konnten nun jedoch zeigen, dass offensichtlich insbesondere bei übergewichtigen Patientinnen – und wenn der Endometriumaufbau unter CC nicht adäquat erfolgt – Aromatasehemmer (wie Letrozol) dem CC überlegen sein dürften. In jedem Fall sind zum Ausschluss begleitender Sterilitätsfaktoren ein Spermiogramm des Partners und eine frühzeitige Evaluierung des Tubenstatus sinnvoll. Unter jeglicher Stimulationstherapie ist ein ultrasonografisches Zyklusmonitoring zur Evaluierung von Endometriumhöhe, Follikelgröße und -anzahl im Sinne des optimalen Timings und zur Vermeidung von Mehrlingsschwangerschaften obligat. Kommt es innerhalb von 6 Zyklen CC/Aromatasehemmern nicht zum Eintritt der gewünschten Schwangerschaft, so sollen als Second-Line-Therapieoptionen die sog. „Low-dose step-up“-Gonadotropinstimulation oder eine laparoskopische Stichelung mit der Patientin diskutiert werden, wobei beide Optionen hinsichtlich der zu erwartenden Erfolgsrate gleich gut sind.
Als Ultima Ratio kann dem Kinderwunschpaar die Durchführung einer IVF/ICSI-Behandlung angeboten werden. Aufgrund der Vielzahl vorhandener Follikel und der hohen Anti-Müller-Hormon-Werte stellen PCO-Patientinnen ein Hochrisikokollektiv für das ovarielle Hyperstimulationssyndrom dar. Als Präventivmaßnahmen sind neben niedrig dosierter Stimulation im Antagonistenprotokoll die Auslösung mit Agonisten, „Freeze all“-Strategien, die begleitende Gabe von Metformin und wahrscheinlich auch eine Stichelung im Vorfeld zielführend. Das stufenweise therapeutische Vorgehen bei Patientinnen mit PCO-Syndrom und Kinderwunsch ist in einer WHO-Leitlinie von Balen et al. (Hum Reprod Update 2016) zusammengefasst (Abb.).
In jedem Fall muss immer die reproduktive Gesamtsituation (Alter der Patientin, Dauer des unerfüllten Kinderwunsches, begleitende Sterilitätsfaktoren) berücksichtigt werden.