Biosimilars in der Gastroenterologie
Biologika nehmen eine herausragende Rolle in der Therapie chronisch entzündlicher Darmerkrankungen (CED) ein.
Diese aus lebenden Zellen biotechnologisch hergestellten Antikörper ermöglichen zunehmend selektive antientzündliche Behandlungsansätze, wobei deren Produktion und Zulassung einem komplexen und kostenintensiven Entwicklungsprozess unterliegen. Mit Patentablauf einzelner Biologika kommen seit einigen Jahren nun zunehmend Biosimilars, ebenso biotechnologisch produzierte Nachfolgepräparate, auf den Markt und führen zu einer zunehmenden Präparatevielfalt – bei sinkenden Kosten für das Gesundheitssystem. Bei den Biosimilars im gastroenterologischen Bereich handelt es sich um Medikamente, die eine wichtige Behandlungsoption in der Therapie von Patienten mit mittelgradiger bis schwerer CED darstellen. Laut Regeltext dürfen diese immunsuppressiv wirkenden Medikamente nur von Fachärzten mit Spezialisierung im Bereich Gastroenterologie, Rheumatologie oder Dermatologie verordnet und verschrieben werden, wenngleich die rezente Positionierung dieser Medikamente in der Grünen Box das vereinfachen sollte.
Ein rezent publiziertes Positionspapier der Arbeitsgruppe für CED der Österreichischen Gesellschaft für Gastroenterologie und Hepatologie (ÖGGH), welches in diesem Artikel zusammengefasst ist, beleuchtete verschiedene Aspekte des Themas Biosimilars.1
Switch und Multiswitch innerhalb der Substanz
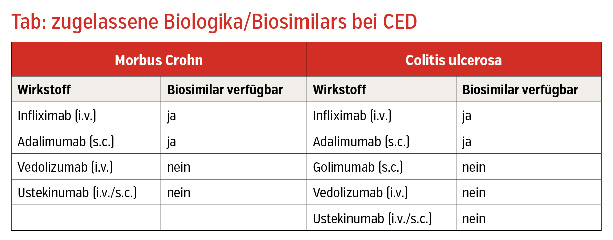
Als „Switch“ wird der Wechsel der Therapie innerhalb des Wirkstoffes vom Originator auf ein Biosimilar oder umgekehrt beziehungsweise von einem Biosimilar auf ein anderes Biosimilar bezeichnet (zum Beispiel Infliximab zu Infliximab; Adalimumab zu Adalimumab). Zahlreiche nationale und internationale Behörden haben sich aus Kostengründen für einen Switch von einem Referenzprodukt auf ein Biosimilar ausgesprochen. Auch die European Crohn’s and Colitis Organisation (ECCO) hat sich in ihrer Erklärung 2016 deutlich positiv zur Verwendung von Biosimilars ausgesprochen.
Beginnend mit der randomisierten und kontrollierten NOR-SWITCH-Studie konnte für CED in mehreren Studien belegt werden, dass die Umstellung des Referenzproduktes auf das Biosimilar keinen Unterschied hinsichtlich Wirkung und Nebenwirkungen erbrachte – dies allerdings bei deutlich geringeren Kosten. So konnte beispielsweise im Non-Inferiority-Vergleich bei Morbus Crohn nachgewiesen werden, dass die Switch-Gruppe vom Infliximab-Referenzprodukt zu CT-P13 hinsichtlich Wirksamkeit und Sicherheit mit der Gruppe, die mit dem Originator weiterbehandelt worden war, vergleichbar war.
Wesentlich weniger eindeutige Daten gibt es zum Thema Multiswitch. Durch die Zunahme an Biosimilars kommt es aus Kostengründen vermehrt zu Switches, die bereits ohne das Wissen der betroffenen Ärzte durch Einkäufer oder Apotheker erfolgen. Zudem gibt es zum Thema Multiswitch kaum klinisch geprüfte Daten.
Neben der Wirksamkeit und der Sicherheit ist auch die lokale Verträglichkeit von subkutan verabreichten Originatoren beziehungsweise Biosimilars sowie die Einschulung auf das entsprechende Equipment zu beachten, um die Adhärenz beziehungsweise Compliance der Patienten zu unterstützen.
Indikationsstellung und Therapieänderung durch den Facharzt
Die Entscheidung des österreichischen Hauptverbandes erlaubt gewissen Biosimilars, aber auch den Originalprodukten seit Kurzem aus Preisgründen den Zugang zur Grünen Box. Dadurch könnten diese Medikamente trotz entsprechender Einschränkung laut Regeltext zukünftig auch durch nichtspezialisierte Ärzte vermehrt frei rezeptiert werden. Hier ist auf die strenge Indikationsstellung und Verordnungshoheit durch spezialisierte Fachärzte dieser Medikamente und die Umsetzung der Empfehlungen der Fachgesellschaften (zum Beispiel Anti-TNF-Checkliste vor Therapie) zu gewährleisten. Die klinische Erfahrung und Daten aus großen Registerstudien zeigen, dass diese Medikamente bei richtigem Einsatz ein hohes Sicherheitspotenzial haben, jedoch auch mit schweren – potenziell lebensgefährlichen – Nebenwirkungen assoziiert sein können.
Die verschreibenden Ärzte sind nicht nur für die Aufklärung der Patienten verantwortlich, sondern auch für deren Einschulung auf das entsprechende Injektionswerkzeug (zum Beispiel Pen). Bei einer Umstellung eines Biologikums auf ein Biosimilar hat der verschreibende Arzt daher auch die Verantwortung für die Neueinschulung der Patienten, da hier das Risiko durch die unterschiedliche Handhabung für fehlerhafte Injektionen besteht.
Indikation, Dosisauswahl, Dosis-adaptierung inklusive Therapiebeendigung und Handhabung von Nebenwirkungen bedürfe des Wissens von Spezialisten. Der falsche Einsatz dieser Medikamente kann zu vorzeitigem Wirkungsverlust und Gefährdung der Patienten führen. Aufgrund der sehr limitierten Therapiealternativen bei CED-Patienten bedeutet dies vor allem für junge Patienten eine deutliche Prognoseverschlechterung ihrer chronischen Erkrankung bis hin zur Erwerbsunfähigkeit und Frühinvalidität. Auch besteht die Gefahr, dass vermeidbare Nebenwirkungen dieser Medikamente durch den nichtoptimalen Einsatz gehäuft auftreten.
Wissenswertes für die Praxis
- Indikationsstellung, Festlegung der Dosis bei Therapiestart und Adaptierung, Monitoring sowie jegliche Therapieänderungen bedürfen spezieller Erfahrung und des Fachwissens und haben ausschließlich durch die Fachärzteschaft zu erfolgen. Diese ist auch für die Einschulung der Patienten und gegebenenfalls für das Beenden der Therapie zuständig.
- Bei Switch auf ein Biosimilar ist neben der vergleichbaren Wirksamkeit der Biologika/Biosimilars, der Handhabung des Pens, der Patientencompliance auch der verlässlichen Verfügbarkeit des Präparats ein hoher Stellenwert einzuräumen.
- Wie auch bei der primären Therapieeinstellung mit Biosimilars sind es vor allem ökonomische Gründe, die für einen Switch sprechen, medizinische Gründe gibt es dafür nicht.
- Ein häufiger Wechsel (Multiswitch) sollte vermieden werden, da zu wichtigen Fragen, etwa der Immunogenität, noch keine ausreichenden Daten zur Verfügung stehen und dies auch immer wieder zu Verunsicherung der Patienten führt.
Referenzen:
1 Dejaco C et al., J Gastroenterol Hepatol Erkr 2020; https://doi.org/10.1007/s41971-019-00067-0
Die vollständige Version des Positionspapiers ist im Journal für Gastroenterologische und Hepatologische Erkrankungen erschienen und kann hier nachgelesen werden: doi.org/10.1007/s41971-019-00067-0
 Expertenstatement
Expertenstatement
Assoz. Prof. Priv.-Doz. Dr. Alexander Moschen
Universitätsklinik für Innere Medizin I, Innsbruck
Christian-Doppler-Labor für Mukosale Immunologie
Die Erstattung aus der Grünen Box für Biologika und Biosimilars ist nicht mit einer „freien Verschreibung“ gleichzusetzen. Sowohl in der Fachinformation als auch im Regeltext des Erstattungskodex ist festgehalten, dass die Indikation durch den entsprechenden Facharzt erfolgen muss. Aus bürokratischer Sicht hat sich gegebenenfalls die Weiterverschreibung der Therapie durch Allgemeinmediziner erleichtert.
Biologika sind komplexe Medikamente, mit denen wir im Bereich der Gastroenterologie bereits umfassend Erfahrung gesammelt haben und die in ihrer Anwendung viel Fachexpertise bedürfen. Das betrifft einerseits die Auswahl des passenden Wirkstoffes für den jeweiligen Patienten, andererseits die Einschulung. Darüber hinaus sind vor dem Beginn einer Biologika- beziehungsweise Biosimilartherapie eine ganze Reihe von Screenings und Maßnahmen durchzuführen, und es ist medizinischen Problemen, die unter einer solchen Therapie auftreten, ein besonderes Augenmerk zu widmen.
Biosimilars dürfen, um ihre Zulassung zu erhalten, weder schlechter noch besser wirksam sein als das Original. Sie sind daher zwar keine medizinische Innovation, bringen aber – solange sie günstiger sind – einen finanziellen Vorteil für das Gesundheitssystem. Bezüglich Adalimumab gibt es aktuell keinen relevanten Preisunterschied zwischen dem Originalprodukt und dem Biosimilar, der Infliximab-Originator wird nicht mehr erstattet. Zu beachten ist dabei, dass jener Arzt, der den Switch vornimmt, auch für die Neueinschulung des Patienten zuständig ist.