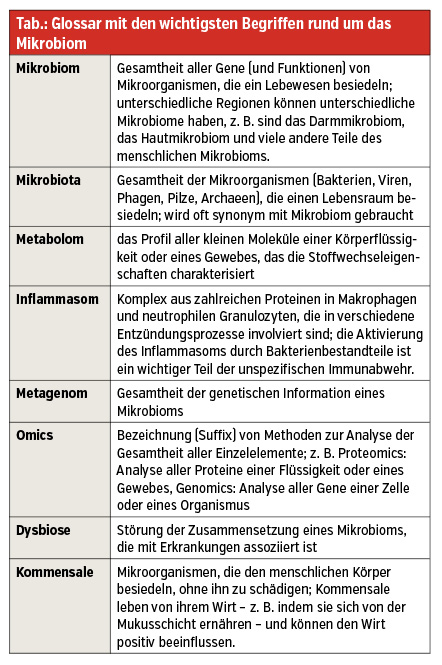
Darmmikrobiom: ein kaum erschlossenes Forschungsgebiet
Der menschliche Körper ist von ca. 30 Billionen Mikroorganismen mit einer Masse von ca. 2 kg besiedelt. Der Großteil findet sich im Darm, aber auch an anderen Orten des Körpers gibt es ein Mikrobiom, das für die jeweiligen Körperteile hochspezifisch ist. Neben Bakterien finden sich auch Pilze, Viren und Archaeen in und auf unserem Körper.
Das Darmmikrobiom ist neben der Mukusschicht, der Darmepithelschicht mit ihren unterschiedlichen Zell-Zell-Verbindungen („tight junctions“, „gap junctions“) und dem Darmimmunsystem ein Teil der Darmbarriere. Über die Lymphgefäße und das portalvenöse System besteht eine enge anatomische und funktionelle Beziehung zwischen dem Darmmikrobiom und der Leber – in der Literatur oft als „Darm-Leber-Achse“ bezeichnet (Abb.).
Zusammenhänge zwischen Erkrankungen und Mikrobiom
Bei gastrointestinalen Erkrankungen, Stoffwechselerkrankungen, Lebererkrankungen, aber auch bei Erkrankungen, die vom Darm weiter „entfernt“ sind, wie neurologische Erkrankungen, Autoimmunerkrankungen, Lungenerkrankungen und psychiatrische Erkrankungen, finden sich Veränderungen der Zusammensetzung und/oder Funktion des Darmmikrobioms. Bei Untersuchungen am Menschen ist es schwierig, eine kausale Beziehung herzustellen, es gibt aber klare Assoziationen. Der Schweregrad der Erkrankung, Begleiterkrankungen, Medikamente, Alter und Geschlecht können das Mikrobiom als Kofaktoren beeinflussen. Eine häufig beschriebene Veränderung ist ein Verlust der Diversität (Anzahl der unterschiedlichen bakteriellen Spezies). Dieser Diversitätsverlust führt wie in anderen Ökosystemen auch zu einem Verlust der Resilienz, also der Stabilität des Mikrobioms gegenüber externen Einflüssen. Das kann beim menschlichen Mikrobiom zu einem Verlust der Kolonisationsresistenz gegenüber pathogenen Keimen führen (z. B. Clostridioides-difficile-Infektion). Der Verlust der eigenen Darmbakterien (Kommensale) führt zu einem Funktionsverlust und z. B. zu einer verminderten Produktion von kurzkettigen Fettsäuren.
Medikamente beeinflussen das Mikrobiom
Ungefähr 25 % aller Medikamente beeinflussen die Zusammensetzung des Darmmikrobioms signifikant. Antibiotika sind das Paradebeispiel für negative Einflüsse auf das Darmmikrobiom; die meisten Antibiotika führen zu einem starken Verlust der mikrobiellen Diversität, und dadurch kann es zu einer Überwucherung mit pathogenen Keimen kommen, die dann antibiotikaassoziierten Durchfall und die gefürchtete Clostridioides-difficile-Infektion auslösen können. Aber auch vermeintlich nebenwirkungsarme Substanzen wie Protonenpumpenhemmer schädigen das Mikrobiom. Durch den Verlust der Säurebarriere kommt es zu einer „Oralisierung“ des Darmmikrobioms. Die vermehrt anzutreffenden oralen Bakterien im Darm sind mit Inflammation, Barrierestörung und vermehrten Komplikationen (insbesondere bei Risikoerkrankungen wie Leberzirrhose) vergesellschaftet.
Mikrobiombasierte Therapiestrategien verfügbar
Antibiotika beeinflussen das Darmmikrobiom zwangsläufig und werden in Tierexperimenten häufig eingesetzt, um die Pathophysiologie mikrobiomassoziierter Erkrankungen zu untersuchen. Weitere Möglichkeiten sind die Verwendung von Probiotika, Präbiotika oder Synbiotika (Kombination aus Prä- und Probiotika). Für die Verwendung von Probiotika gibt es bereits Evidenz zur Prophylaxe der antibiotikaassoziierten Diarrhö, zur Prophylaxe der nekrotisierenden Enterokolitis bei Frühgeborenen oder zur Therapie des Reizdarmsyndroms. Eine weitere Möglichkeit der Modulation des Mikrobioms ist die Stuhltransplantation. Die Stuhltransplantation ist die Standardtherapie und wird ab dem 2. Rezidiv einer Clostridioides-difficile-Infektion eingesetzt. Andere Substanzen, z. B. Gallensäuren, können das Mikrobiom beeinflussen, und der therapeutische Einsatz ist Gegenstand wissenschaftlicher Untersuchungen.
- Der Schweregrad einer Erkrankung, Begleiterkrankungen, Medikamente, Alter und Geschlecht können das Mikrobiom als Kofaktoren beeinflussen.
- Etwa 25 % aller Medikamente beeinflussen die Zusammensetzung des Darmmikrobioms signifikant.
- Antibiotika haben zwangsläufig einen Einfluss auf das Darmmikrobiom, die meisten führen zu einem starken Verlust der mikrobiellen Diversität.