Neuropathische Schmerzen sind häufig und betreffen bis zu 10 % der erwachsenen Bevölkerung. Definitionsgemäß werden sie durch eine Läsion oder Erkrankung des somatosensorischen Nervensystems verursacht, während nozizeptive Schmerzen durch eine Nozizeptor-Aktivierung bei Gewebsschädigung entstehen. Der Begriff stellt keine eigenständige Diagnose dar, sondern ist vielmehr eine klinische Beschreibung für ein Phänomen, dessen Ursache im zentralen oder peripheren Nervensystem lokalisiert sein kann – dementsprechend spricht man von zentralen oder peripheren neuropathischen Schmerzen. Als dritte Kategorie, die die Mechanismen chronischer Schmerzen beschreibt, hat die Internationale Gesellschaft zur Erforschung des Schmerzes (IASP) den Terminus noziplastischer Schmerz eingeführt. Er ist auf eine veränderte Nozizeption ohne klaren Nachweis einer Gewebeschädigung oder Läsion des somatosensorischen Systems zurückzuführen.
Ätiologie
Die Entstehung neuropathischer Schmerzen lässt sich auf verschiedene pathophysiologische Mechanismen zurückführen:
- ektope Erregung geschädigter Axone,
- periphere Sensibilisierung mit Verringerung der Reizschwelle,
- zentrale Sensibilisierung mit Antwortsteigerung spinaler Hinterhorn-Neurone,
- gestörte Schmerzhemmung durch verminderte Aktivität supraspinal deszendierender inhibitorischer Neurone und
- Aktivierung von Mikroglia mit veränderter purinerger Signalübertragung.
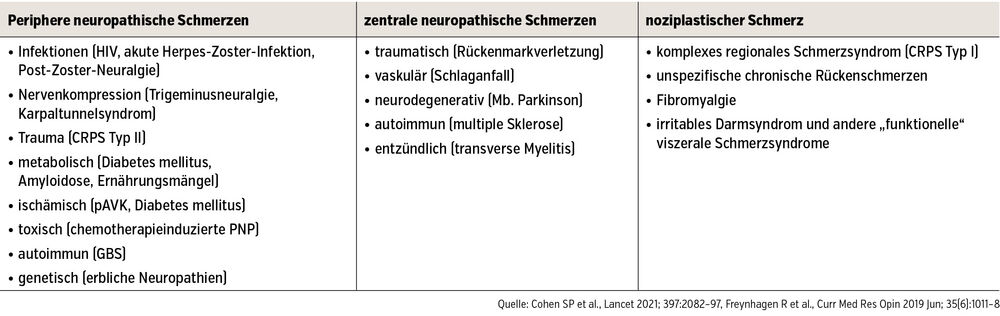
Typische Ursachen neuropathischer Schmerzen sind in der Tabelle zusammengefasst. Häufig sind die diabetische schmerzhafte Polyneuropathie, neuropathische Schmerzen bei multipler Sklerose, die Post-Zoster-Neuralgie oder zentrale neuropathische Schmerzen nach Rückenmarkverletzungen oder Schlaganfall.
Der chronische – also länger als 3 Monate anhaltende – neuropathische Schmerz setzt sich nach dem biopsychosozialen Modell aus einer organischen, sozialen und psychischen Komponente zusammen. Je länger der Schmerz anhält, desto geringer wird bei vielen Betroffenen der Anteil der biologischen Komponente. Die Wichtigkeit der psychischen und sozialen Faktoren nimmt in der Regel zu. Das subjektive Empfinden spielt beim chronischen Schmerz eine wichtige Rolle, die Patientenschilderung muss respektiert werden. Chronische Schmerzen können die Lebensqualität im privaten sowie im beruflichen Bereich enorm einschränken.
Diagnose
Die Diagnose neuropathischer Schmerzen stützt sich ganz wesentlich auf die Anamneseerhebung und klinische Untersuchung. Neben dem typischen brennenden oder elektrisierenden Charakter spontaner Schmerzen sowie dem Vorliegen von Parästhesien und/oder Dysästhesien sind neuropathische Schmerzen charakterisiert durch sogenannte stimulusevozierte Schmerzen wie Hyperalgesie und Allodynie.
Ein Vorschlag einer Arbeitsgruppe der IASP unterscheidet zwischen möglichem, wahrscheinlichem und definitivem neuropathischem Schmerz. Sobald anamnestisch eine relevante neurologische Erkrankung oder Läsion vorliegt und der Schmerz in einem dazu plausiblen neuroanatomischen Verteilungsmuster auftritt, spricht man von einem möglichen neuropathischen Schmerz. Finden sich dazu in der körperlichen Untersuchung sensible Defizite (Minussymptome) und evtl. zusätzlich auch Plussymptome wie brennender Spontanschmerz, Hyperalgesie oder Allodynie in diesem Verteilungsgebiet, spricht man von einem wahrscheinlichen neuropathischen Schmerz. Definitiver neuropathischer Schmerz liegt vor, wenn die Läsion oder Erkrankung des somatosensorischen Systems, die den Schmerz erklärt, mit einem diagnostischen Test bestätigt wird. Ein medikamentöser Therapieversuch ist bereits bei wahrscheinlichem neuropathischen Schmerz gerechtfertigt. Zum Screening und zur Einordnung des Schweregrades der neuropathischen Schmerzen wird ergänzend der Einsatz standardisierter Fragebögen empfohlen.
Anamnese und Untersuchung
Die Bestätigung einer erklärenden Läsion oder Erkrankung des zentralen Nervensystems erfolgt in der Regel durch bildgebende Verfahren (CT, MRT). Unter den elektrophysiologischen Verfahren werden Läsionen des somatosensorischen Systems standardmäßig durch Neurografie oder somatosensorisch evozierte Potenziale dokumentiert, auch wenn sie nicht spezifisch das nozizeptive System erfassen. Eine ergänzende standardisierte quantitative sensorische Testung (QST) kann bei unauffälligen Ergebnissen in der konventionellen elektrophysiologischen Untersuchung und/oder bei dem Verdacht auf eine Small-Fiber-Neuropathie erfolgen, eine topische Zuordnung der Läsion ist mit dieser Methode aber nicht möglich. So wie nozizeptiv evozierte Potenziale (z.B. durch Laser oder Kontakthitze evoziert) ist sie nur an spezialisierten Zentren verfügbar. Für beide Methoden ist der Empfehlungsgrad schwach. Als Goldstandard in der Diagnostik der Small-Fiber-Neuropathie gilt weiter die Hautbiopsie. Eine starke Empfehlung haben schließlich auch Reflextests des Trigeminus für die Diagnostik der sekundären Trigeminusneuralgie. Sie kommen v. a. dann zur Anwendung, wenn ein MRT nicht durchgeführt werden kann.
Behandlung
Die Behandlung von chronisch neuropathischen Schmerzen ist eine komplexe Angelegenheit und soll auf einer multimodalen Basis beruhen. Das Ziel der Behandlung ist eine deutliche, mindestens 30–50%ige Schmerzreduktion sowie eine Verbesserung der Lebens- und Schlafqualität. Darüber hinaus sollten die beruflichen und sozialen Aktivitäten weitestgehend erhalten bleiben. Insomnie ist ein häufiges Begleitsymptom des chronischen Schmerzes und muss daher sehr ernst genommen und behandelt werden. Psychologische Maßnahmen sollen in der Insomnietherapie bevorzugt werden; wenn erforderlich, können auch Medikamente verschrieben werden. Melatoninhaltige Präparate oder Trizyklika wie Amitriptylin sind wesentlich besser geeignet als Benzodiazepine, deren Einsatz vermieden werden sollte.
Das Therapiekonzept richtet sich nach der Ätiologie des Schmerzes. Ein komprimierter N. medianus im Karpaltunnel muss möglicherweise durch eine Operation entlastet werden. Eine symptomatische Therapie kann bei einer Post-Zoster-Neuralgie notwendig sein. Eine Kombination aus ursächlicher und symptomatischer Therapie wird beispielsweise im Rahmen einer diabetischen Polyneuropathie angewendet.
Medikamentöse und nichtmedikamentöse Maßnahmen können dabei hilfreich sein. Sehr wichtig für den Erfolg der Therapie ist eine gut erklärende, ausführliche und empathische Kommunikation mit den Patient:innen. Als ein initiales Gesprächsziel ist zu vermitteln, dass Schmerzen auch nach einem abgeschlossenen Heilungsprozess anhalten können. Gut informierte und aufgeklärte Patient:innen haben eine höhere Erfolgswahrscheinlichkeit. Klare Ziele der Therapie (z. B. mindestens 30–50%ige Schmerzreduktion) sollen definiert werden und mögliche Nebenwirkungen unter Vermeidung eines Nocebo-Effektes mit den Patient:innen besprochen werden.