Ein neues geriatrisches Syndrom?
Das kardiorenale Syndrom (CRS) umfasst ein Spektrum von Erkrankungen, bei denen die Funktionsstörung eines Organsystems, entweder des Herzens oder der Nieren, zur Beeinträchtigung des anderen Organs führt. Neben den ökonomischen Kosten (etwa 4–7 % des gesamten Gesundheitsbudgets in den westlichen Ländern) ist diese komplexe Funktionsstörung u. a. für den Großteil aller Wiederaufnahmen in den Spitälern bzw. direkt oder indirekt für rund 30–40 % aller Todesfälle bei geriatrischen Patient:innen verantwortlich. Das CRS wird häufig durch eine komorbide Anämie kompliziert (CRAS= kardiorenales Anämiesyndrom), was zu einer wechselseitigen und fortschreitenden Verschlechterung der Herz- und Nierenfunktion führt.
Pathophysiologie des CRAS
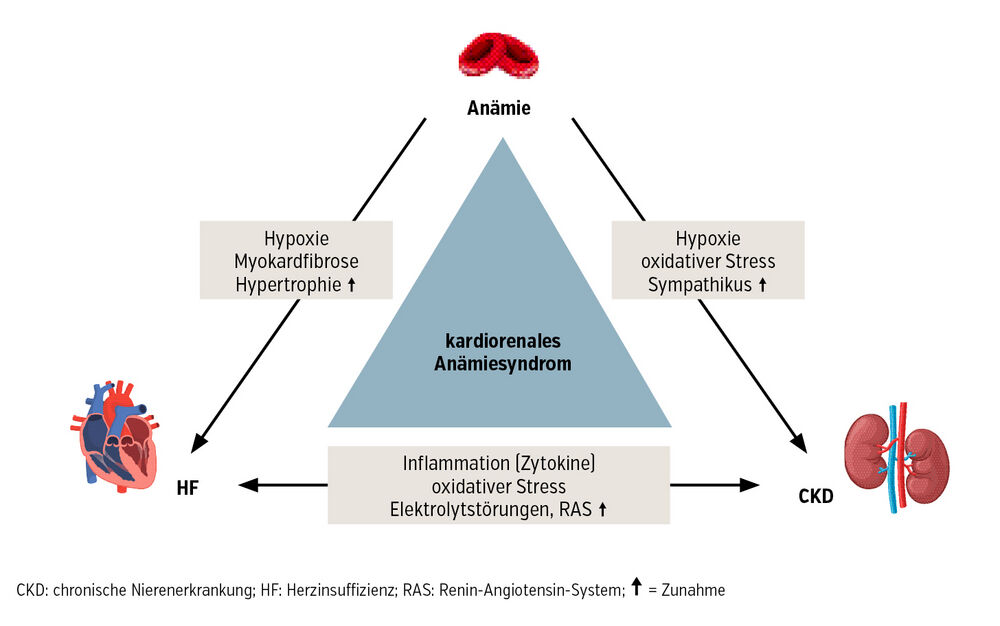
- Eine reduzierte Herzfunktion führt zu einer verminderten renalen Perfusion, was eine Abnahme der glomerulären Filtrationsrate (GFR) zur Folge hat. Eine daraus resultierende Nierenfunktionsstörung (CKD) verschlechtert wiederum die Herzinsuffizienz durch Flüssigkeitsretention und erhöht Vor- und Nachlastdruck.
- Im Rahmen der CKD kommt es zu einer verminderten Produktion von Erythropoetin. Die Akkumulation urämischer Toxine bei Niereninsuffizienz hat zusätzliche kardiotoxische und hämatologische Effekte, die sowohl die Herzfunktion als auch die Erythropoese negativ beeinflussen.
- Die reduzierte Hämoglobinkonzentration vermindert die Sauerstofftransportkapazität des Blutes, was zu einer myokardialen Hypoxie führt. Dies resultiert in einer kompensatorischen Tachykardie und einem erhöhten kardialen Output.
- Chronische Herzinsuffizienz und CKD sind mit erhöhten Entzündungsmediatoren (Zytokinen) und oxidativem Stress verbunden. Diese Faktoren verursachen Endothelschäden und fördern die Progression der vaskulären Grunderkrankung, was zu einer weiteren Verschlechterung der Organfunktionen führt.
- Die Aktivierung des Renin-Angiotensin-Aldosteron-Systems (RAAS) und des sympathischen Nervensystems führt zu systemischer Vasokonstriktion, Natrium- und Wasserretention sowie zu einem erhöhten intraglomerulären Druck. Diese Mechanismen verstärken die kardiale und renale Dysfunktion und tragen zur Persistenz der Anämie bei (Abb.).
Diagnostische Herausforderungen
Die Diagnose einer Herzinsuffizienz basiert klinisch auf dem Vorhandensein von Symptomen wie Dyspnoe, Müdigkeit und Flüssigkeitsretention, unterstützt durch bildgebende Verfahren wie die Echokardiografie. Eine CKD wird primär durch eine verminderte GFR und das Vorhandensein einer Albuminurie diagnostiziert. Mehr als 50 % aller geriatrischen Herzinsuffizienz-Patient:innen haben bei Diagnosestellung bereits eine deutlich eingeschränkte Nierenfunktion mit einem Serum-Kreatinin > 2 mg/dl. Neben einem Rückgang des renalen Blutflusses findet sich häufig eine verminderte tubuläre Rückresorption für Na+, K+ und Phosphat und damit gekoppelt ein erhöhtes Risiko für Elektrolytentgleisungen mit den bekannten klinischen Folgen wie Muskeladynamie und hohes Sturzrisiko.
Zusätzlich beeinflusst eine persistierende Anämie maßgeblich die Überlebensrate dieser Patient:innen. Häufig ist die Symptomatik sehr unspezifisch und scheint für die Betroffenen subjektiv wenig belastend zu sein. Von der Ätiologie her ist diese Art von Anämien immer multifaktoriell, sie manifestieren sich meistens in Zusammenhang mit sekundär erworbenen Nierenerkrankungen („anemia of chronic diseases“).
Therapeutische Strategien
Derzeit gibt es keine evidenzbasierten Empfehlungen für das Management des CRAS; die Behandlung erfordert einen multifaktoriellen Ansatz. Die Voraussetzung für eine optimale Therapie liegt im tiefen Verständnis der renalen, hämodynamischen und laborchemischen Veränderungen bei den einzelnen Patient:innen. Unabdingbar sind regelmäßige Kontrollen aller maßgeblicher Parameter, ebenso das Erkennen von sonst eher unbedeutsamen Risikofaktoren wie die diätische Salzzufuhr oder gastrointestinale Funktionsstörungen. Von der medikamentösen Therapie bedeutsam sind ACE-Hemmer und AT2-Rezeptorantagonisten. Um eine nebenwirkungsarme RAAS-Blockade zu gewährleisten, gilt bei geriatrischen Patient:innen die Regel „start low, go slow“. Neben b-Blockern sind auch Aldosteronantagonisten eine therapeutische Option, wobei man aber im Verlauf der Behandlung streng auf den Serum-Kaliumspiegel achten soll.
Behandlungsmöglichkeiten der Anämie
Die meisten dieser Anämien sind auf einen Eisenmangel und/oder einen Erythropoietin-(EPO-)Mangel zurückzuführen. Zu diesem Zweck hat sich in den letzten Jahrzehnten eine Substitutionstherapie mit verschiedenen erythropoesestimulierenden Faktoren (ESF) etabliert, die sich durch unterschiedlich lange Halbwertszeiten auszeichnen. Sehr kontroversiell diskutiert werden zurzeit die möglichen negativen Auswirkungen einer EPO-Therapie, die in erster Linie durch die steigende Blutviskosität, eine akzentuierte Vasokonstriktion und eine verstärkte Thrombozytenadhäsion das Risiko für eine Hypertonieentgleisung bzw. für eine Thrombose erhöht. Aus diesem Grund wird empfohlen, die einzelnen Zielbereiche (Hämoglobin/Hämatokrit) dem Lebensalter angepasst zu definieren.
Eine intravenöse Eisentherapie verbessert die Eisenparameter bei Patient:innen mit Herzinsuffizienz, die einen Eisenmangel aufweisen: Serum-Ferritin < 100 mg/l oder 100–299 mg/l bei Transferrinsättigung < 20 %, mit oder ohne CRS oder CKD. Studien, die orale mit intravenöser Eisentherapie verglichen, fanden heraus, dass intravenöses Eisen bei CKD-Patient:innen die Hb-Spiegel (11 bis 12g/dl) stärker erhöht als orales Eisen. Es gibt Hinweise darauf, dass orales Eisen Veränderungen im Darmmikrobiom verursacht und zur Erhöhung der Produktion urämischer Toxine bei CKD beiträgt. Daher scheint die intravenöse Eisentherapie ohne ESF ausreichend für das Management von CRAS zu sein.
Neue Therapieansätze
Mehrere neue Therapien befinden sich derzeit in der klinischen Entwicklung, darunter hypoxieinduzierbare Faktor-Prolylhydroxylase-Inhibitoren (HIF-PHIs). HIF-PHIs fördern die Erythropoese durch Stabilisierung des hypoxieinduzierbaren Faktors, was zur vermehrten Produktion von Erythropoietin und zur Verbesserung der Eisenverfügbarkeit führt. Klinische Studien zeigten hier vielversprechende Ergebnisse bei der Behandlung der Anämie bei CKD und könnten auch bei CRAS von Nutzen sein.