Familiäre Hypercholesterinämie
Definition und Häufigkeit
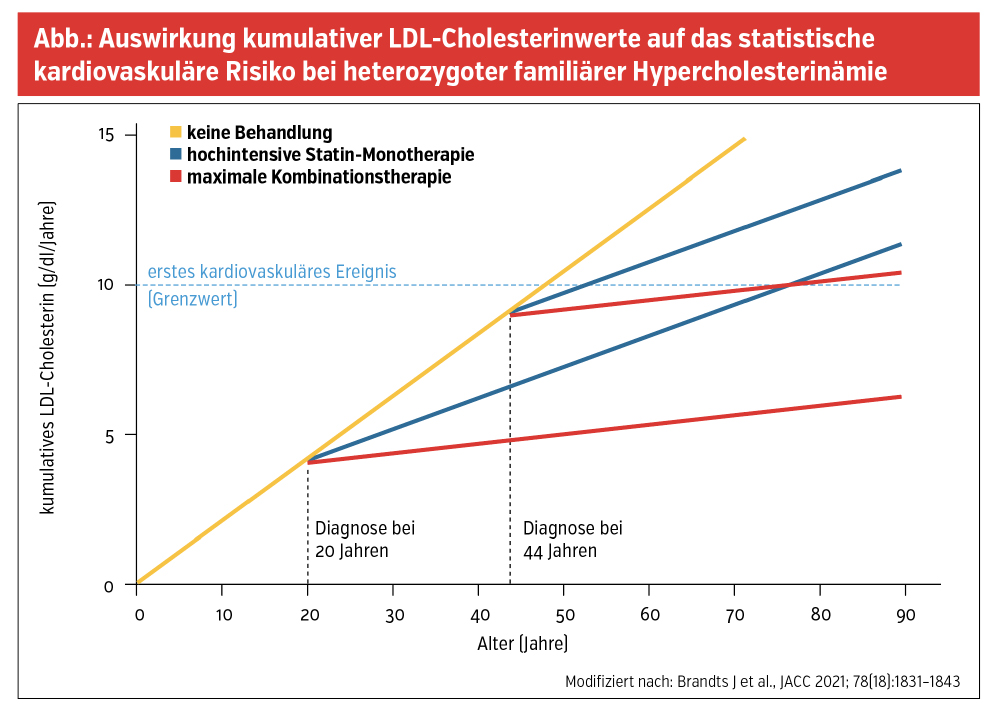
Bei der FH handelt es sich um eine genetische Stoffwechselstörung, bei der die Betroffenen mit einem seit Geburt erhöhten Low-Density-Lipoprotein-Cholesterin (LDL-C) konfrontiert sind. Aufgrund der lebenslangen Exposition der Gefäßwände gegenüber LDL-C führt die Erkrankung unbehandelt frühzeitig zu Atherosklerose und konsekutiv zu frühzeitigen kardiovaskulären Ereignissen (Abb.).
Ursächlich für die FH ist zumeist eine monogenetische Störung mit autosomal dominantem Erbgang. Betroffen sind zu ca. 95 % der Mutationen im Bereich von Genen, die den LDL-Rezeptor kodieren. Je nach Anzahl der betroffenen Allele wird die häufigere heterozygote (HeFH) Form von der sehr seltenen homozygoten (HoFH) Form unterschieden. War man bis vor wenigen Jahren noch davon ausgegangen, dass die Prävalenz der HeFH bei 1 : 500 liegt, so haben Screeningprogramme in großen Bevölkerungsgruppen ein weitaus häufigeres Vorkommen gezeigt (ca. 1 : 200). Insbesondere in einem Kollektiv von Patient:innen mit atherosklerotischen Erkrankungen lag die Prävalenz sogar bei 1 : 17. Die HoFH hingegen ist eine äußerst seltene Erkrankung und wird mit einer Prävalenz von ca. 1 : 300.000 bis 1 : 650.000 angegeben.
Klinische Manifestation
Da LDL-C ein wesentlicher Mitspieler in der Pathogenese der Atherosklerose ist, gibt es eine enge Korrelation zwischen der Höhe und der Dauer der LDL-C-Exposition mit dem Atheroskleroseausmaß. Durch die exzessiv erhöhten LDL-C-Werte (500–1.000 mg/dl) führt die HoFH bei den Betroffenen zumeist bereits im Kindesalter zu ausgeprägter Atherosklerose und kardiovaskulären Ereignissen, weshalb so früh wie möglich intensivste therapeutische Maßnahmen inklusive Lipoproteinapherese erforderlich sind.
Die HeFH hingegen kann längere Zeit unentdeckt bleiben. Im Rahmen einer klinischen Untersuchung können Sehnenxanthome vor allem als Einlagerungen in die Achillessehne sowie Xanthome im Bereich der metacarpophalangealen Extensorensehnen detektiert werden. Auch das Vorliegen eines Arcus lipoides corneae bei Patient:innen unter 45 Jahren kann wegweisend für die Diagnose der HeFH sein.
Diagnose
Die Diagnose wird vorrangig durch das Vorliegen von signifikant erhöhten LDL-C-Spiegeln gestellt, wobei ein LDL-C > 190 mg/dl verdächtig für das Vorliegen einer FH ist. Um dem erhöhten kardiovaskulären Risiko gerecht zu werden, haben die aktuellen ESC/EAS-Dyslipidämie-Guidelines diesen Grenzwert aufgegriffen und klassifizieren Patient:innen mit LDL > 190 mg/dl bereits in der Kategorie „hohes Risiko“, was einen LDL-C-Zielbereich von < 70 mg/dl zur Folge hat.
Sollte noch ein weiterer kardiovaskulärer Risikofaktor wie z. B. Nikotinkonsum oder arterielle Hypertonie vorliegen, ist sogar die Höchstrisikokategorie erreicht und ein LDL-C von < 55 mg/dl anzustreben. Eine wesentliche Säule in der Diagnose der FH stellt durch den zumeist autosomal dominanten Erbgang das Erheben einer Familienanamnese mit dem Fokus auf Hypercholesterinämie und prämaturen kardiovaskulären Ereignissen dar.
Diagnosescores
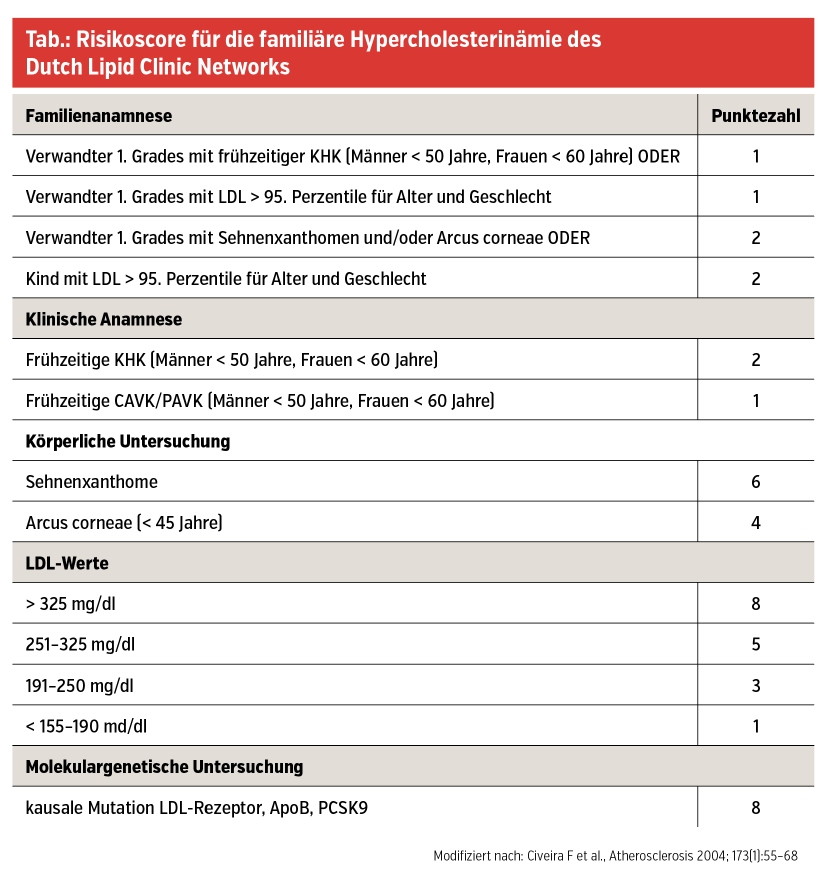
Um die Diagnose der FH stellen zu können, stehen mehrere klinische Scores zu Verfügung, wie z. B. der DLCN (Dutch Lipid Clinic Network) (Tab.).
Dort werden anhand von Familienanamnese, Vorliegen von Atherosklerose und Höhe des LDL-C-Spiegels Punkte vergeben. Der entscheidendste Faktor für die Prognose der FH ist die frühzeitige Diagnosestellung, gefolgt von einer ehestmöglichen Therapieeinleitung. Die Wirksamkeit dieser Maßnahmen konnte in einer Studie mit 20 Jahren Follow-up durch einen Generationenvergleich unterstrichen werden. Während bei der ab Kindesalter mit Statinen therapierten Generation keine kardiovaskulären Ereignisse auftraten, war bis zum Alter von knapp 40 Jahren annähernd die Hälfte der unbehandelten Eltern davon betroffen. Bei neuidentifizierter FH ist es daher entscheidend, ein Kaskadenscreening bei allen erstgradigen Verwandten einzuleiten.
Therapie
Statine
Potente Statine wie Rosuva- und Atorvastatin senken LDL-C um ca. 50 % und sind auch bei der FH die Therapie erster Wahl. Zwar ist bei FH-Patient:innen häufig das Therapieansprechen etwas geringer ausgeprägt als bei Nicht-FH-Patient:innen, dennoch sind gerade bei der FH sehr niedrige LDL-C-Ziele anzustreben, weshalb zumeist eine Kombinationstherapie erforderlich ist.
Ezetimib
Anders als bei Statinen und unabhängig vom LDL-Rezeptor funktioniert bei Ezetimib die LDL-C-Senkung durch eine Reduktion der intestinalen Cholesterinresorption mittels Inhibition des NCP1L1-Transporters. In der Monotherapie kann man nur eine ca. 20%ige Senkung des LDL-C erwarten. Deutlich attraktiver hinsichtlich Potenz und Therapieadhärenz sind vor allem die Kombinationspräparate mit Statinen.
Bempedoinsäure
Durch den Wirkmechanismus über die ATP-Citrat-Lyase kommt es zu ähnlichen Einflüssen auf die Cholesterinbiosynthese und LDL-R-Regulation wie bei Statinen, allerdings wird die Muskulatur durch eine fehlende enzymatische Ausstattung von diesem Prozess ausgespart, weshalb die Bempedoinsäure bei Statin-Unverträglichkeit wegen muskulärer Beschwerden eingesetzt wird. In den Studien, in denen auch speziell FH-Patient:innen berücksichtigt wurden, konnte eine ca. 20%ige LDL-Reduktion in der Monotherapie erzielt werden. Eine positive kardiovaskuläre Outcome-Studie liegt seit März 2023 vor.
PCSK9-Therapien
Bereits in den ESC/EAS-Leitlinien von 2019 wurden PCSK9-Inhibitoren (Alirocumab, Evolocumab) für Patient:innen mit FH mit maximal verträglicher Statin- und Ezetimib-Therapie auch in Primärprävention empfohlen. Auch für die siRNA-basierte Therapie mit Inclisiran ist in Studien eine signifikante zusätzliche LDL-C-Reduktion bei HeFH nachgewiesen. Insgesamt lässt sich in diesen Kombinationstherapien eine bis zu 85%ige LDL-C-Senkung.
Lipoproteinapherese
Die Notwendigkeit einer Lipoproteinapherese ist durch die Verfügbarkeit von PCSK9-Therapien dramatisch zurückgegangen und gilt nun vor allem bei Patient:innen mit progredienter Atherosklerose und Lipoprotein-Erhöhungen sowie bei HoFH.
Weitere Therapieoptionen
Bei der HoFH stehen mit Evinacumab und Lomitapid 2 Substanzen zur Verfügung, die unabhängig vom LDL-Rezeptor zu einer signifikanten LDL-C-Senkung führen. Als Zukunftsausblick gibt es spannende tierexperimentelle Daten, wo durch den Einsatz von CRISPR/Cas9 auf genetischer Ebene eine Korrektur der LDL-Rezeptor-Expression erfolgt, wodurch nach einmaligem Einsatz eine lebenslange Modifikation erfolgen kann.