INITIATIVE DIABETES: Pumpentherapie und Blutzuckermonitoring
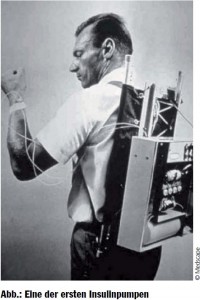
Die Geschichte der Insulinpumpentherapie reicht bis in die 1960er-Jahre zurück (Abb.). Mehnert, Renner et al. untersuchten die Glukosehomöostase unter intravenöser Insulingabe bei Diabetikern (Hepp et al., Horm Metab Res 1977). Slama et al. (Diabetes 1974) verabreichten Insulin intravenös für ein bis fünf Tage bei sieben Patienten mit Typ-1-Diabetes. Dabei zeigte sich eine gute glykämische Kontrolle, die intravenöse Insulingabe zeigte sich aber als problematisch. Die erste Publikation mit dem Titel „Continuous subcutaneous insulin infusion: an approach to achieving normoglycaemia“ durch John C. Pickup et al. wurde im „British Medical Journal“ im Jänner 1978 veröffentlicht.
CSII vs. Insulininjektion mittels Spritze
Schon in der Mitte der 1980er-Jahre gab es sehr gute Evidenz für die Effektivität der kontinuierlichen Insulinzufuhr (Continuous Subcutaneous Insulin Infusion, CSII). Die Gruppe um Pickup (Bending et al., Am J Med 1985) konnte zeigen, dass die CSII-Therapie die Häufigkeit des Auftretens von Hypoglykämien, verglichen mit der Spritzentherapie, reduzieren kann. Bode et al. (Diabetes Care 1996) zeigten bei 55 Typ-1-Diabetikern eine Reduktion von schweren Hypoglykämien unter der Insulinpumpentherapie. In diversen Studien konnte gezeigt werden, dass die Tag-zu-Tag-Variabilität der Blutzuckerwerte unter der Pumpentherapie deutlich niedriger ist. Mit der im Jahre 1993 im „New England Journal of Medicine“ veröffentlichten DCCTStudie (The Diabetes Control and Complications Trial), in die 1.441 Patienten mit Typ-1-Diabetes (726 ohne Retinopathie, 715 mit milder diabetischer Retinopathie) eingeschlossen waren, konnte der Benefit einer nahe-normoglykämischen Einstellung – das Ziel der intensivierten Insulintherapie – eindrucksvoll gezeigt werden. Im Vergleich von intensivierter zu konventioneller Insulintherapie konnte über eine Nachbeobachtungszeit von im Mittel 6,5 Jahren das relative Risiko für die Entwicklung
- einer Retinopathie um 76% (bei bestehender milder Retinopathie eine Progressionsverzögerung um 54%),
- einer Neuropathie um 60% sowie
- einer Nephropathie um 56% reduziert werden.
Schrittweise ausweitung der Einsatzmöglichkeiten
Die Indikation für die Insulinpumpentherapie hat sich im Laufe der letzten 35 Jahre deutlich geändert. Im Jahr 1978 waren dies Studienpatienten, in den 1980er-Jahren Patienten mit einem Dawn-Phänomen, in den 1990er-Jahren Patienten mit schweren Hypoglykämien unter der Therapie mit Spritze. Laut den Leitlinien der Österreichische Diabetes Gesellschaft (ÖDG) in der überarbeiteten und erweiterten Fassung 2009 sind die Indikationen für den Beginn einer Insulinpumpentherapie derzeit wie folgt (Stadler et al., Wien Klin Wochenschr 2009):
- Verbesserung der Stoffwechselkontrolle (HbA1c bzw. glykämische Variabilität) insbesondere bei Dawn-Phänomen oder bei Kinderwunsch bzw. Schwangerschaft
- Neigung zu Hypoglykämien
- (ausgeprägte) Hypoglykämiewahrnehmungsstörung
- diabetische Polyneuropathie
- ausgeprägte Insulinresistenz Wunsch nach flexiblerer Lebensgestaltung (Sport, Schichtarbeit etc.)
Die Tabelle zeigt die derzeit in Österreich am Markt befindlichen Insulinpumpen. In den nächsten Jahren erwarten wir die Zulassung der so genannten Patch-Pumps (Insulinpumpen ohne Schlauchsystem).
Kontinuierliches Glukosemonitoring
Ein weiterer Meilenstein auf dem Weg zum „künstlichen Pankreas“ oder so genannten „Closed Loop“ in der Geschichte der Insulinpumpentherapie ist in der Entwicklung der Continuous Glucose Monitoring Systems (CGMS) zu sehen.
Das erste Gerät, dass von der US Food and Drug Administration (FDA) 1999 zugelassen wurde, war das „MiniMed CGMS“. Es misst alle fünf Minuten den Glukosewert im Interstitium. Dieses System gibt die Glukosewerte aber erst nach Auslesung mittels Dockingstation am Computer sowie zugehöriger Software preis.
Ein weiteres Gerät, das „Menarini Glucoday S“, benutzt ein Mikrodialysesystem und wurde 2003 zugelassen.
2004 kam, wieder von Medtronic MiniMed, der „Guardian“ auf den Markt. Bei diesem System übermittelt der Sensor die Messung alle fünf Minuten an die Pumpe.
2006 erfolgte die Zulassung des „MiniMed Paradigm Real-Time“-Systems. Zum ersten Mal in der Geschichte des Diabetesmanagements ist hier das kontinuierliche Glukosemonitoring in eine Insulinpumpe integriert. Bei Verwendung der „Paradigm Veo“-Insulinpumpe kann das System neuerdings auch in die Software der Pumpe eingreifen, indem es z.B. bei einer Hypoglykämie die Insulinzufuhr aus der Pumpe unterbricht.
Von Abbott wurde 2007 mit dem „Freestyle Navigator“ ein weiterer Glukosesensor auf den Markt gebracht. Er hat allerdings keine Zulassung in Österreich.
Der jüngste Zugang im Jahre 2009 in Europa ist das Gerät „DexCom Seven Plus“. Die Tragedauer des Sensors hier liegt bei bis zu sieben Tagen.
Fernziel „closed Loop“
Die Einzelkomponenten für ein künstliches Pankreas, nämlich Insulinpumpen und Systeme zur kontinuierlichen Glukosemessung, stehen nun schon seit Längerem zur Verfügung. Was noch fehlt, ist die Software, welche die Einzelkomponenten verknüpft und mittels Algorithmen die Abgabe der richtigen Insulinmenge zur richtigen Zeit errechnet. Die zu bedenkenden Variablen sind:
- Insulinwirkung
- Insulinaufnahme
- Verstoffwechselung der aufgenommenen Nahrung
- evtl. bestehender Stress
- körperliche Aktivität
In Studien ist es mit den derzeit zur Verfügung stehenden Geräten (Insulinpumpe und Glukosesensor) schon möglich, Blutzuckerwerte in einem definierten Blutzuckerbereich zu halten. Bei drohender Überschreitung des oberen Zielwerts wird die Insulinzufuhr erhöht, bei drohender Unterschreitung wird die Insulinzufuhr automatisch unterbrochen (Letzteres ist bei der Insulinpumpe „Paradigm Veo“ schon programmiert).
Auf dem Weg zum künstlichen Pankreas bedarf es aber einer weiteren Verbesserung der Insulinpumpen (einerseits in Richtung schlauchlose Systeme, andererseits in Richtung Abgabe von Insulin und Glukagon), einer Verbesserung der Messgenauigkeit der Sensoren als auch der Software. Einen weiteren limitierenden Faktor auf dem Weg zum künstlichen Pankreas stellt aber auch die Geschwindigkeit des Wirkbeginns der Insuline dar. Die derzeit zur Verfügung stehenden Insuline liegen allesamt im subkutanen Gewebe primär als Hexamere vor. Erst nach Auflösung der Hexamerstruktur, wenn das Insulin als Monomer vorliegt, kann es seine hormonelle Wirkung entfalten. Seit Jahren läuft die Entwicklung zu monomeren Insulinen, wobei verschiedene Ansätze gewählt werden. Ein Ansatz ist die Mischung von Insulin mit humaner Hyaluronidase. Dieses Enzym spaltet interstitielles Hyaluronan (Hyaluronsäure) an der Injektionsstelle und ermöglicht eine raschere Absorption des Insulins. Ein anderer Weg ist der Zusatz von Ethylendiamintetraessigsäure (EDTA) und Zitrat zum Insulin. Durch den Chelator wird Zink entfernt und es können rascher Monomere entstehen (Biodel, Linjeta™).
Resümee
Seit der Publikation der DCCT-Studie im Jahr 1993, der Zulassung von Insulin lispro 1996 und Insulin aspart im Jahre 2000 sowie durch die Sensorunterstützung zeigt sich eine stete Steigerung der Insulinpumpen-Anwender. Durch die sensorgesteuerte Insulinpumpentherapie ist ein großer Schritt zur Erreichung des künstlichen Pankreas getan. Nächtliche „Closed Loop“-Systeme werden schon eingesetzt und zeigen in Studien eine bessere Stoffwechselkontrolle als die Standardinsulinpumpentherapie.
Mit der Insulinpumpentherapie sowie den derzeit zur Verfügung stehenden Glukosesensoren gewinnt der Patient mit Diabetes mellitus an Flexibilität im Alltag. Diese umfasst neben dem Durch- und Ausschlafen auch die Gestaltung von Mahlzeiten und Snacks. Durch das Abrufen von Insulinboli zu den Mahlzeiten, die der Patient in Umfang und Zeitpunkt bestimmen kann, werden eine bessere Stoffwechselführung und auch Lebensqualität erreicht. Sport und andere körperliche Aktivitäten können ohne besondere Vorplanung gestartet werden.