Neue Therapien bei chronisch entzündlichen Darmerkrankungen
Die therapeutische Revolution bei chronisch entzündlichen Darmerkrankungen (CED) begann 1955 mit der Entdeckung der Wirksamkeit von Kortikosteroiden bei der akut schweren Colitis ulcerosa (CU), welche die Mortalität der Erkrankung drastisch reduzierte. Im Laufe der nächsten Jahrzehnte waren Sulfasalazin, Mesalazin, Azathioprin, 6-Mercaptopurin sowie Methotrexat als additive Therapieoptionen verfügbar. Schließlich war die 1999 erfolgte Zulassung des TNF-a-Inhibitors Infliximab als erster monoklonaler Antikörper für die Therapie des Morbus Crohn (MC) ein entscheidender Durchbruch in der Behandlung von CED. Bis heute gilt dieses Medikament als eines der wirkungsstärksten, wenngleich nur indirekte Vergleiche mit anderen Präparaten vorliegen. Weitere primäre Therapieindikationen von Infliximab sind nach wie vor der ausgeprägte Dünndarmbefall und die perianale Erkrankung bei MC. Immer noch ist es auch das einzige empfohlene Biologikum für die Behandlung der akut schweren CU. Es folgte die Zulassung von zwei weiteren TNF-a-Inhibitoren (Adalimumab und Golimumab) sowie des Integrin-Antagonisten Vedolizumab und des Interleukin-(IL-)12/23-Inhibitors Ustekinumab. 2017 kam schließlich der erste unselektive JAK-Inhibitor Tofacitinib als oral verabreichbare Therapie für die CU hinzu.
JAK-Inhibitoren
Die derzeit wohl spannendste und noch kontroversiell diskutierte Therapieoption für CED sind die neu verfügbaren, weiterentwickelten, präferenziellen JAK1-Inhibitoren Filgotinib (zugelassen für CU) und Upadacitinib (zugelassen für CU und MC, Tab.), die in einer 1-mal täglichen peroralen Dosierung verabreicht werden.
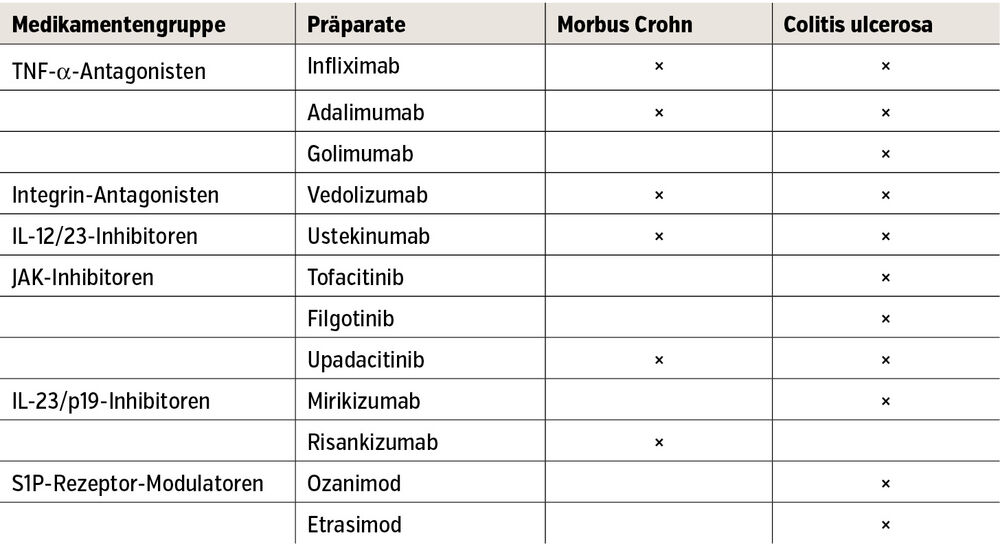
Tab.: Von der Europäischen Arzneimittel-Agentur (EMA) zugelassene Advanced Therapies für die Therapie von chronisch entzündlichen Darmerkrankungen
Während ihnen die Zulassungsstudien eine rasche und gute Wirksamkeit bescheinigen, herrschen in der Ärzteschaft teilweise Bedenken bezüglich des Sicherheitsprofils. Wenngleich die Phase-III-Studiendaten bei CED mit Ausnahme des bekannten erhöhten Risikos für Herpes-Zoster-Infektionen keine bedenklichen Nebenwirkungen zeigen, erließ die Europäische Arzneimittel-Agentur eine Rote-Hand-Warnung für alle JAK-Inhibitoren bei Personen mit entsprechendem Risikoprofil. Diese Warnung basiert allerdings nur auf Daten bei Patient:innen mit rheumatoider Arthritis unter Tofacitinib-Therapie. In der hierzu durchgeführten ORAL-SURVEILLANCE-Studie zeigte sich, dass die Risikopopulation (Alter über 65 Jahre, aktiver oder ehemaliger Nikotinabusus, vorhandene kardiovaskuläre Risikofaktoren) ein erhöhtes Risiko für kardiovaskuläre Komplikationen, thromboembolische Ereignisse und Malignome hatte. Somit können diese Daten weder direkt auf unsere CED-Patient:innen umgelegt werden, da diese oft deutlich andere Patientencharakteristika aufweisen (z.B. jüngeres Alter, weniger kardiovaskuläre Risikofaktoren), noch erscheint es gerechtfertigt, direkt von Tofacitinib auf die selektiveren JAK-1-Inhibitoren zu schließen. Wenn es mit längerfristigen „Real world“-Daten gelingt, die Bedenken hinsichtlich der möglichen Nebenwirkungen auszuräumen, steht einer breiten Anwendung von JAK-1-Inhibitoren bei CU und MC auch bei schweren Erkrankungsformen und bei Patient:innen mit extraintestinalen Manifestationen nichts im Wege.
S1P-Rezeptor-Modulatoren
Eine weitere Therapieoption mit völlig neuem Wirkmechanismus stellen die Sphingosin-1-Phosphat-Rezeptor-Modulatoren dar, die das Einwandern von Lymphozyten in den Darm verhindern sollen. Die Therapie ist bei der multiplen Sklerose bereits etabliert, seit kurzem ist nun das Präparat Ozanimod für die CU zugelassen. Obwohl die perorale Verabreichung attraktiv erscheint, konnte sich dieses Medikament in Österreich bisher nicht etablieren, was allerdings weniger an der Wirksamkeit oder dem Nebenwirkungsprofil des Präparats liegt als vielmehr an der nichtgegebenen Erstattung durch die Gesundheitskasse. Diese Erstattungsproblematik besteht nicht nur bei Ozanimod und wird für unsere CED-Patient:innen zunehmend zum Problem, da sie zur praktischen Nichtverschreibbarkeit von wichtigen innovativen Medikamenten führt. Die Arbeitsgruppe CED innerhalb der Österreichischen Gesellschaft für Gastroenterologie und Hepatologie setzt sich hierbei aktiv für eine dringend notwendige erleichterte Verschreibungspraxis für neue CED-Therapien ein. Mit Etrasimod wurde Ende 2023 ein weiterer Vertreter dieser Medikamentengruppe zugelassen; ob damit die Akzeptanz der Substanzen steigt, bleibt abzuwarten.
Interleukin-23-Inhibitoren
IL-23 hat sich als kritischer Treiber von CED erwiesen. Zur ersten Generation der IL-23-Inhibitoren zählt Ustekinumab, das über eine gemeinsame Untereinheit sowohl IL-12 als auch IL-23 hemmt. Nun ist die 2. Generation von IL-23-Inhibitoren verfügbar, die selektiv IL-23 hemmen und im Unterschied zur zusätzlichen IL-12-Hemmung die Produktion von darmprotektivem IL-17 weniger beeinflussen.
Risankizumab zählt zu dieser 2. Generation der IL-23-Inhibitoren und wurde 2022 für den moderat bis schwer aktiven MC zugelassen. In den Zulassungsstudien erreichte unter Risankizumab in der Erhaltungsphase mehr als die Hälfte der Patient:innen eine klinische Remission. Die Wirksamkeit persistierte unabhängig davon, ob die Patient:innen mit einem oder mehreren Biologika vorbehandelt waren. Mit Spannung wurden die Ergebnisse der SEQUENCE-Studie erwartet, welche die Wirksamkeit von Risankizumab im Vergleich zu Ustekinumab bei vortherapierten MC-Patient:innen untersuchte. Die im Oktober 2023 auf der UEGW vorgestellten Daten zeigten, dass Risankizumab in der Therapie des MC gegenüber Ustekinumab überlegen ist. Auch für die CU steht uns mit Mirikizumab seit Mai 2023 ein selektiver IL-23-Inhibitor mit ähnlich vielversprechenden Effektivitätsdaten wie bei Risankizumab zur Verfügung. Insbesondere das unsere Patient:innen quälende Symptom des imperativen Stuhldrangs wurde genau untersucht und besserte sich unter der neuen Therapie. Beide IL-23-Inhibitoren zeichnen sich durch ein unbedenkliches Sicherheitsprofil aus. Die häufigsten Nebenwirkungen sind Infektionen der oberen Atemwege, Kopfschmerzen sowie Reaktionen an der Injektionsstelle.
Konklusion
Das therapeutische Armamentarium für die Behandlung der CED entwickelt sich derzeit in rasantem Tempo weiter. Die neu verfügbaren Therapieoptionen bieten alternative Wirkmechanismen, zunehmend oral verfügbare Medikamente und teils überlegene Wirksamkeit gegenüber verfügbaren Vergleichspräparaten. Durch die steigende Anzahl unterschiedlicher Behandlungsoptionen stellt sich nun allerdings die bisher weitgehend unbeantwortete Frage, welches Wirkprinzip für welche:n Patient:in das geeignetste ist. Zudem bestehen weiterhin deutliche regulatorisch-bürokratische Hürden in der Verschreibbarkeit neuer Arzneimittel für CED. Hier ist auch politischer Handlungsbedarf gegeben, um unsere Patient:innen an den neuesten therapeutischen Entwicklungen partizipieren lassen zu können.

























































































