Pharmakotherapie der Adipositas
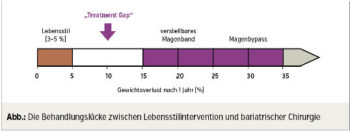
Lebensstilmodifikation ist nach wie vor die Basis jeder Adipositastherapie. Jedoch werden langfristig die meisten Menschen mit Adipositas nach einer Gewichtsreduktion wieder zunehmen. Daher ist ein Gewichtsverlust nicht das einzige Ziel im „Gewichtsmanagement“, sondern ebenso die Gewichtsstabilisierung (Maintenance). Pharmakotherapie mit Antiadiposita ist nur auf Basis einer Lebensstiltherapie mit einer energiereduzierten Diät und vermehrter körperlicher Bewegung indiziert, die von einer geeigneten Verhaltenstherapie begleitet werden müssen. Medikamente können bei Erwachsenen mit einem BMI > 30 kg/m2 oder zwischen 27 und 29,9 kg/m2 mit zumindest einer gewichtsinduzierten Komorbidität erwogen werden. So platziert sich die Pharmakotherapie in der Lücke („Treatment Gap“) zwischen Lebensstilmanagement und bariatrischer Chirurgie (Abb.).
Verfügbare Pharmaka in den USA und Europa
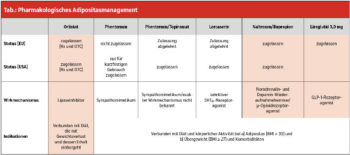
Eine Arbeit über alle fünf aktuell in den USA am Markt befindlichen Medikamente wurde in Obesity Facts publiziert (Toplak, 2014). Darunter sind auch jene drei nachfolgenden Medikamente, die in Europa zugelassen sind (Tab.). Jene Medikamente, die nur in den USA zugelassen sind (Lorcaserin und eine Phentermin/Topiramat-Niedrigdosis- und Extended-Release-Formulation), sind in der Tabelle enthalten, werden im Folgenden aber nicht näher erläutert. Folgende Medikamente für die Therapie der Adipositas sind derzeit in Europa am Markt:
- Orlistat
- Naltrexone in Kombination mit Bupropion
- Liraglutid
Orlistat wurde 1998 durch die European Medicines Agency (EMA) zur Therapie der Adipositas auf Basis einer Lebensstiltherapie zugelassen und wird – wie in den europäischen Guidelines 2015 gefordert – bei einem BMI > 30 kg/m2 oder > 27 kg/m2 mit Komorbiditäten verwendet. Orlistat ist ein selektiver Inhibitor der gastrischen und pankreatischen Lipasen und führt zu einer Reduktion der Lipolyse der Nahrungsfette und damit deren Absorption (etwa 30 %). Klinische Studien mit Orlistat zeigten einen signifikant größeren Gewichtsverlust im Vergleich zu Placebo (5,8 kg versus 3,0 kg; p < 0,001). Der sogenannte X-PERT Trial zeigte deutlich bessere Ergebnisse bei jenen Patienten, die eine Drei-Monate-Response von > 5 % Gewichtsverlust erreicht hatten. Wie hingegen in solchen Fällen üblich, zeigte eine Metaanalyse über alle Patienten (15 Studien, bis 4 Jahre Behandlung) mit Orlistat lediglich einen Gewichtsverlust von etwa 2,9 kg (2,9 %). Verbesserungen von Blutdruck, Bauchumfang, Gesamtcholesterin und LDL-Cholesterin waren ebenso deutlicher mit Orlistat als mit Placebo. Risikofaktorverbesserungen waren naturgemäß stärker bei erhöhten Werten am Studienbeginn. Lediglich ein „safety concern“ – eine mögliche Lebertoxizität – wurde diskutiert, jedoch hat eine rezente Metaanalyse aus dem UK das nicht bestätigen können. Nebenwirkungen hängen von der Compliance in der Ernährung ab. Abdominelle Beschwerden, Diarrhöen and Dyspepsie sind daher durchaus häufig, eine Langzeitgabe ist nur bei Compliance einer fettarmen Kost möglich und sollte besonders im Winter durch Vitaminsupplemente ergänzt werden.
Naltrexon + Bupropion wurde von der EMA im März 2015 zugelassen, wiederum zusätzlich zur Lebensstilintervention bei den bereits oben genannten BMI-Werten mit und ohne Komorbiditäten. Bupropion stimuliert die hypothalamischen POMC-Neuronen, was zu einer Melanocortin-Rezeptor-Aktivierung und einem Gewichtsverlust durch Appetitverminderung und erhöhten Energieumsatz führt. Naltrexon ist ein Antagonist des Opioidrezeptors und potenziert den anorexigenen Effekt des Bupropions; so wirken die beiden Inhaltsstoffe synergistisch.
Die Effekte von Naltrexon + Bupropion auf Gewichtsverlust und Verbesserung der glykämischen und kardiometabolischen Risikofaktoren wurden im Contrave- Obesity-Research-(COR-)Programm untersucht. Dieses bestand aus vier randomisierten, doppelblinden, placebokontrollierten 56-Wochen-Phase-III-Studien bei 4.536 Erwachsenen mit Adipositas: COR-1, COR-II, COR-BMOD und COR-DM. Alle vier Studien zeigten statistisch signifikante und klinisch relevante Gewichtsverluste über 52 Wochen Behandlung mit Naltrexon + Bupropion im Vergleich zu Placebo. Der durchschnittliche Gewichtsverlust betrug etwa 5–9 kg. Signifikante Verbesserungen von kardiometabolischen Markern wurden ebenso gefunden. Das kardiovaskuläre Risiko war nicht erhöht. Die häufigste Nebenwirkung war Übelkeit.
Liraglutid wurde von der EMA im März 2015 zugelassen, wiederum zusätzlich zur Lebensstilintervention bei den bereits oben genannten BMI-Werten mit und ohne Komorbiditäten. Liraglutid ist das erste einmal täglich zu applizierende GLP-1-Analog, das in der Therapie der Adipositas zugelassen wurde. Liraglutid wurde im „Satiety and Clinical Adiposity – Liraglutide Evidence“-(SCALE-)Programm untersucht, um Sicherheit und Effizienz im Gewichtsmanagement bei adipösen Patienten mit und ohne Typ-2-Diabetes mellitus (T2DM) zu quantifizieren. Die größte SCALE-Studie, der Obesity and Prediabetes Trial, untersuchte die Effekte von Liraglutid bei 3.731 Patienten mit einem BMI ≥ 30 kg/m2 oder 27 kg/m2 mit Komorbiditäten, mit oder ohne Prädiabetes, über 56 Wochen. Zu Woche 56 hatten die Patienten unter 3,0 mg Liraglutid 8,0 % (8,4 kg) des Ausgangsgewichtes verloren, verglichen mit 2,6 % (2,8 kg) auf Placebo (Differenz −5,4 %, [5,6 kg], p < 0,001). Damit hatten 63,2 % der Patienten in der Liraglutid-Gruppe, und lediglich 27,1% in der Placebo-Gruppe zumindest 5 % ihres Gewichtes verloren (p < 0,001); 33,1 % und 10,6 %, verloren mehr als 10 % ihres Gewichtes (p < 0,001). Zusätzlich zum Gewichtsverlust wurden Verbesserungen der glykämischen Kontrolle, des Blutdruckes und der Blutfette beobachtet. Aufgrund der guten Ergebnisse im LEADER Trial bei Diabetes mellitus Typ 2 (mit geringerer Dosis) wurde kein Endpoint Trial verlangt. Liraglutid wurde in der Regel gut toleriert, die häufigsten Nebenwirkungen waren milde bis mäßige Übelkeit und Durchfälle.
Resümee und zukünftige Aspekte
Adipositas ist eine multifaktorielle Erkrankung und erfordert eine Kombination von Lebensstiltherapie, Pharmakotherapie und bariatrischer Chirurgie in interdisziplinärer Zusammenarbeit.
Das Gewicht ist nur ein sehr grobes Maß für den Behandlungserfolg; Bauchumfang, Maße der Körperzusammensetzung und psychosoziale Aspekte treten dazu, auch BIA-Messungen zur Abschätzung von Fett- und „lean body mass“ haben Zukunft (lesen Sie dazu die Guidelines der EASO von 2015).
Das in unserer Medizin vernachlässigte Gebiet würde sich fundamental verändern, wenn Versicherungen und Regierungen endlich der WHO folgen und multidisziplinäre Strategien mit brauchbaren Ansätzen aktiv unterstützen. Wir haben kürzlich passende Vorschläge gemacht, die Adipositas als eigenständige Erkrankung in ICD-11 abzubilden, was die jetzige Situation jedenfalls bessern würde – zumindest wäre es ein erster Schritt.
Eine Reihe von Pharmaka mit weiter verbesserter Wirkung auf Körpergewicht und -zusammensetzung sind in Entwicklung und werden voraussichtlich die Lücke („Treatment Gap“) zur bariatrischen Chirurgie endgültig schließen.
Literatur beim Verfasser