Psoriasis-Arthritis in der allgemeinmedizinischen Praxis
Circa 20 % der Patienten mit Psoriasis entwickeln eine Psoriasis- Arthritis (PsA), zusätzlich kommen bei etwa 5–10 % der Psoriasis-Patienten unspezifische, intermittierende Gelenkschmerzen vor.1 Am häufigsten sind die peripheren Gelenke betroffen, daneben kommen bei der PsA auch Entzündungen an Sehnen und Sehnenansätzen sowie eine Spondylitis vor.
In den meisten Fällen gehen die psoriatischen Haut- und/oder Nagelveränderungen dem Auftreten der Gelenkerscheinungen voraus (circa 70 %). Bei etwa je 15 % der Fälle treten die Gelenkbeschwerden vor (PsA sine psoriase) oder gleichzeitig mit der Hautpsoriasis auf.2 Die PsA hat eine starke familiäre Disposition, bei PsA-Patienten leiden etwa 15 % der Verwandten ebenso an einer PsA, und bei mehr als 30 % liegt eine Psoriasis vor.3
Klinische Erscheinungen und Verlauf der PsA
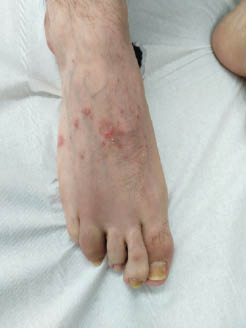
Die PsA kann klinisch sehr variabel in Erscheinung treten: Die Polyarthritis ist die häufigste Manifestation (60 %), während die Oligoarthritis (~ 32 %) und die Monoarthritis seltener vorkommen. Bei einigen Patienten kann es zu einer Entzündung der Wirbelsäule (~ 18–46 %) oder der Sehnenansätze (~ 25–53 %) kommen, was mitunter in einem der ankylosierenden Spondylitis sehr ähnlichen Erkrankungsbild mündet.4, 5 Eine Beteiligung der DIP- Gelenke ist bei der PsA häufig (41 %), die für die PsA charakteristische Daktylitis kommt hingegen nur bei etwa 25 % der Patienten vor (siehe Abb.). Alle diese Erscheinungen können bei der PsA isoliert oder in Kombination vorkommen. Auch der Übergang von einer in eine andere Verlaufsform wird nicht selten beobachtet.
Sonderform SAPHO: Das sogenannte SAPHO-Syndrom (Synovitis, Akne, Psoriasis pustulosis, Hyperostose, Osteitis) ist eine seltene Sonderform der PsA; inkomplette Formen, bei denen nur einzelne Elemente des SAPHO vorliegen, kommen ebenso vor. Extraartikuläre/extrakutane Manifestationen betreffen weniger als 20 % der PsA-Patienten, am häufigsten sind eine akute anteriore Uveitis sowie eine chronisch entzündliche Darmerkrankung.5
Verlauf: So variabel wie das klinische Spektrum ist auch der Verlauf der PsA: Oft kommt es lediglich zu Arthralgien oder milden Arthritiden, bei etwa 5 % der Patienten tritt hingegen ein rasch progredientes Erkrankungsbild, die sogenannte „Arthritis mutilans“, auf.
Diagnose der Psoriasis-Arthritis
Die Diagnose der PsA wird durch die Kombination von Anamnese, klinischer Untersuchung, Labor und bildgebenden Befunden gestellt. Die CASPAR-Klassifikationskriterien werden oft zur Diagnose herangezogen, auch wenn diese für klinische Studien entwickelt wurden.6 Voraussetzung für die Anwendung der CASPAR-Kriterien ist das Vorliegen einer „entzündlichen Affektion“ von Gelenken, Sehnen und/oder der Wirbelsäule. Eine Definition der „entzündlichen Affektion“ ist für die PsA bisher nicht etabliert, in Tabelle 1 sind Kriterien aufgelistet, welche auf klinischer Erfahrung beruhen und eine Hilfestellung für die Identifikation solcher Patienten in der klinischen Praxis bieten. Die CASPAR-Kriterien sind in Tabelle 2 zusammengefasst.
Bis dato gibt es keinen spezifischen Labortest für die PsA. Blutsenkung (BSG) und C-reaktives Protein (CRP) sind bei vielen PsA-Patienten negativ. Ebenso fehlen in der Regel der Rheumafaktor und andere Autoantikörper.7
Im Röntgen ist für die PsA ein Mischbild aus osteodestruktiven und osteoproliferativen Veränderungen typisch, charakteristisch sind periostale Ossifikationen der diaphysären Bereiche der Phalangen oder das sogenannte Pencil-in-the-Cup- Phänomen bei fortgeschrittener Erkrankung. Bei letzterem wölbt sich die erodierte Basis des distalen Phalangealknochens eines Interphalangealgelenks kappenförmig über das bleistiftartig deformierte Köpfchen des proximalen Gelenkanteils. Allerdings sollte die Erkrankung heute vor dem Auftreten solcher Gelenkschäden diagnostiziert werden.7
Sehr vielversprechend sind die Ultraschalluntersuchung und Magnetresonanztomografie (MRT) in der Diagnostik der PsA, wenngleich diese immer nur in Zusammenschau mit den klinischen Befunden interpretiert werden sollten.8 Die Sonografie weist eine hohe Sensitivität und Spezifität zur Detektion entzündlicher Läsionen an Gelenken, Sehnen und Sehnenansätzen auf, während mit Hilfe der MRT zusätzlich auch entzündliche Veränderungen im Knochen untersucht werden können.9 Allerdings hat die MRT eine geringere örtliche Auflösung als die Sonografie, ist kostenintensiver und schwerer verfügbar, und es fehlt die Möglichkeit der dynamischen Untersuchung. Somit haben beide bildgebende Verfahren ihren Stellenwert in der Diagnostik der PsA: die Sonografie zur Beurteilung der Entzündung an Gelenken, Sehnen und Sehnenansätzen, die MRT für spezielle Fragen wie Osteitis und zur Untersuchung der entzündlichen Veränderungen an der Wirbelsäule.
Differenzialdiagnosen der PsA
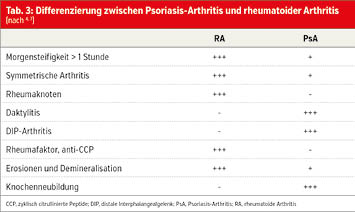
Bei Patienten mit einer Polyarthritis stellt sich nicht selten die Frage, ob eine PsA oder aber eine rheumatoide Arthritis (RA) oder eine andere Form der Polyarthritis plus Psoriasis vorliegt. Die korrekte Diagnosestellung ist entscheidend, da sich PsA und RA hinsichtlich der Therapieoptionen und der Prognose stark unterscheiden.10, 11 Einige Kriterien, welche zur Unterscheidung von PsA und RA herangezogen werden können, sind in Tabelle 3 dargestellt.
Im Falle einer Monoarthritis ist die Liste der Differenzialdiagnosen lang, so könnte beispielsweise eine aktivierte Arthrose oder eine Kristallarthropathie plus Psoriasis vorliegen. Zudem kommen sowohl die Arthrose als auch die Gicht häufig gemeinsam mit der PsA vor. Zu denken ist auch an eine reaktive Arthritis oder (insbesondere bei Gonarthritis) an eine Lyme-Arthritis.4
Therapie der Psoriasis-Arthritis
Die Therapie der PsA hat sich in den letzten Jahrzehnten dramatisch verändert. Konnten den Patienten in der Vergangenheit oft nur nichtsteroidale Antirheumatika (NSAR), Analgetika und Kortison sowie topische Behandlungen für die Hautpsoriasis angeboten werden, stehen heute eine Reihe an biologischen (b) und „targeted synthetic (ts) disease-modifying anti-rheumatic drugs“ (DMARDs) zur Verfügung. Durch die heutigen Behandlungsmöglichkeiten kann bei vielen Patienten eine Remission sowohl von Seiten der Haut als auch von Seiten der muskuloskelettalen Manifestationen erreicht und in den allermeisten Fällen eine bleibende Invalidisierung verhindert werden.
Die Behandlung von PsA-Patienten richtet sich nach den klinischen Manifestationen und der Prognose der Patienten, die European-League-against-Rheumatism-(EULAR-)Empfehlungen zur Behandlung der PsA von 2015 sind ein für die Praxis hilfreicher Leitfaden zur Therapieplanung.11
Die EULAR-Empfehlungen beinhalten einen Entscheidungsbaum, der neben Vorschlägen für die initiale Therapiewahl auch die regelmäßige Re-Evaluierung der Krankheitsaktivität und eine Anpassung der Behandlung im Falle von unzureichender Krankheitskontrolle vorsieht.11
PsA-Patienten mit peripherer Arthritis werden in der Regel initial mit NSARs behandelt, außer es liegen Risikofaktoren für einen progredienten Verlauf vor (zum Beispiel viele geschwollene Gelenke, bereits vorhandene strukturelle Schäden, hohe Entzündungswerte im Blut oder extra-artikuläre Manifestationen wie Daktylitis). In diesem Fall sollte von Beginn an eine Therapie mit Methotrexat (MTX) eingeleitet werden. Das Ziel der Behandlung ist die Remission oder zumindest eine niedrige Krankheitsaktivität, gemessen mit Hilfe von klinischen Composite-Scores, wie dem Disease-Activity-in-psoriatic-Arthritis-Score (DAPSA).12 Der Score kombiniert die Zahl der geschwollenen und druckschmerzhaften Gelenke, das CRP und die Aktivitätseinschätzung und die Schmerzbeurteilung durch den Patienten. Ein Wert von 0–4 wird als Remission angesehen, bis zu einem Wert von 14 wird eine niedrige Krankheitsaktivität angenommen. Wird das Behandlungsziel nicht nach 3–6 Monaten erreicht, sollte die Therapie angepasst werden: Patienten mit Risikofaktoren für einen progredienten Verlauf erhalten nach MTX-Versagen ein Biologikum, in der Regel einen TNF-α-Blocker. Bei Patienten ohne Risikofaktoren kann ein weiteres konventionelles Basistherapeutikum, wie Leflunomid, Sulfasalazin oder Cyclosporin A, versucht werden. Patienten, welche an einer axialen Beteiligung, Daktylitis und/oder Enthesitis leiden, erhalten bereits nach Versagen von NSAR ein Biologikum, insbesondere dann, wenn die Lebensqualität und Funktion eingeschränkt sind. Der Therapieerfolg sollte auch nach Einleiten einer Biologikatherapie regelmäßig überprüft werden und bei unzureichendem Ansprechen sollte eine Änderung der Therapie erfolgen. Neben den TNF-α-Blockern Infliximab, Etanercept, Goliumab, Adalimumab und Certolizumab stehen uns weitere Biologika wie Secukinumab, Ixekizumab (beides Interleukin-17-Hemmer), Ustekinumab (Interleukin-12/23-Blocker) und Abatacept (CTLA-4-Ig) sowie tsDMARDs wie Apremilast (Phosphodiesterase-4-Hemmer) und Tofacitinib (JAK-Inhibitor) zur Verfügung. Das Wirkprofil und auch der Erfahrungsschatz aus klinischen Studien ist zu all diesen Präparaten unterschiedlich, sodass der Rheumatologe individualisiert diese Substanzen einsetzen kann.
Resümee
Die PsA kennzeichnen eine variable klinische Präsentation und ein heterogener Verlauf. Zur Diagnose der PsA müssen eine entzündliche Manifestation an Gelenk(en), Sehnen/Sehnenansätzen und/oder der Wirbelsäule festgestellt werden und weitere Erscheinungen der PsA berücksichtigt werden. Bei Patienten mit Polyarthritis und Psoriasis kann die Differenzierung zwischen PsA und RA plus Psoriasis schwierig sein, eine korrekte Unterscheidung ist aus therapeutischer und prognostischer Sicht aber von großer Bedeutung.
Für die Therapie der PsA wird ein individueller Behandlungsplan anhand der klinischen Manifestationen und Risikofaktoren für einen progredienten Verlauf erstellt, wobei die EULAR-Empfehlungen 2015 ein hilfreicher Leitfaden für die Praxis sind. Entsprechend den Empfehlungen werden NSARs, konventionelle Basistherapeutika, Biologika und tsDMARDs eingesetzt. Weitere Substanzen sind gerade in Entwicklung, sodass in Zukunft vielleicht eine noch effizientere Behandlung der PsA möglich sein wird.
Literatur:
1 Radtke MA, Reich K, Blome C et al., Prevalence and clinical features of psoriatic arthritis and joint complaints in 2009 patients with psoriasis: results of a German national survey. J Eur Acad Dermatol Venereol 2009; 23:683–91; DOI:10.1111/j.1468-3083.2009.03159.x
2 Anandarajah AP, Ritchlin CT, The diagnosis and treatment of early psoriatic arthritis. Nat Rev 2009; 5:634–41; DOI:10.1038/nrrheum.2009.210
3 Fitzgerald O, Winchester R, Psoriatic arthritis: from pathogenesis to therapy. Arthritis Res Ther 2009; 11:214; DOI:10.1186/ar2580
4 Wollina U, Unger L, Heinig B et al., Psoriatic arthritis. Dermatol Ther 2010; 23:123–36; DOI:10.1111/j.1529-8019.2010.01306.x
5 Liu J-T, Yeh H-M, Liu S-Y et al., Psoriatic arthritis: Epidemiology, diagnosis, and treatment. World J Orthop 2014; 5:537–43; DOI:10.5312/wjo.v5.i4.537
6 Taylor W, Gladman D, Helliwell P et al., Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthritis Rheum 2006; 54:2665–73; DOI:10.1002/art.21972
7 Ritchlin CT, Colbert RA, Gladman DD, Psoriatic Arthritis. N Engl J Med 2017; 376:957–70; DOI:10.1056/NEJMra1505557
8 Husic R, Ficjan A, Duftner C et al., Use of ultrasound for diagnosis and follow-up of psoriatic arthritis. Eur Med J 2014; 65–72
9 Mandl P, Navarro-Compán V, Terslev L et al., EULAR recommendations for the use of imaging in the diagnosis and management of spondyloarthritis in clinical practice. Ann Rheum Dis 2015; 74:1327–39; DOI:10.1136/annrheumdis-2014-206971
10 Smolen JS, Landewé R, Bijlsma J et al., EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2016 update. Ann Rheum Dis 2017; 76:960–77; DOI:10.1136/annrheumdis-2016-210715
11 Gossec L, Smolen JS, Ramiro S et al., European League Against Rheumatism (EULAR) recommendations for the management of psoriatic arthritis with pharmacological therapies: 2015 update. Ann Rheum Dis 2016; 75:499–510; DOI:10.1136/annrheumdis-2015-208337
12 Schoels MM, Aletaha D, Alasti F et al., Disease activity in psoriatic arthritis (PsA): defining remission and treatment success using the DAPSA score. Ann Rheum Dis 2016; 75:811–8; DOI:10.1136/annrheumdis-2015-207507
Die Psoriasis-Arthritis ist heterogen hinsichtlich der klinischen Manifestationen und des Verlaufs. Für die Diagnose der Psoriasis-Arthritis muss eine entzündliche Affektion der Gelenke, der Sehnen/Sehnenansätze und/oder der Wirbelsäule festgestellt werden, zudem müssen weitere Kriterien, wie das Vorliegen von psoriatischen Haut-/Nagelveränderungen, berücksichtigt werden. Die Therapie der Psoriasis-Arthritis wird individuell auf Grund der klinischen Erscheinungen und des Vorliegens von Prognosefaktoren erstellt, die EULAR-Empfehlungen sind ein hilfreicher Leitfaden für die klinische Praxis. Für die Behandlung der Psoriasis-Arthritis stehen neben nichtsteroidalen Antirheumatika und konventionellen DMARDs wie Methotrexat auch Biologika und „targeted synthetic“ DMARDs zur Verfügung.
Eine 2016 publizierte Studie im Auftrag der Österreichischen Gesellschaft für Rheumatologie in Kooperation mit der ÖGAM und der Österreichischen Ärztekammer hat den Status der Kooperation im Fachbereich Rheumatologie zwischen Ärzten für Allgemeinmedizin mit Kassenvertrag und den Fachärzten mit Zusatzfach Rheumatologie erhoben.1 Unter anderem wurde die Frage gestellt, wann Patienten mit Psoriasis dem internistischen Rheumatologen vorgestellt werden sollten (siehe Abb.). Wie sollte die Zusammenarbeit organisiert sein? Jeder Patient mit der Verdachtsdiagnose einer Psoriasis-Arthritis sollte dem Rheumatologen vorgestellt werden. Vor Überweisung ist zumindest eine laborchemische Vorabklärung sinnvoll. Die Einleitung einer Basistherapie sollte durch den Rheumatologen erfolgen; alle 3 bis 6 Monate sollte unter einer Behandlung mit Basistherapeutika (im Besonderen mit Biologika) eine rheumatologische Kontrolle erfolgen.