Schweres Asthma richtig behandeln
Schweres oder schwieriges Asthma?
In der Literatur wird schweres Asthma beschrieben als:
- Anhaltende Asthmabeschwerden
- Persistierende schwere bzw. hochgradig variable Atemwegsobstruktion
- Häufiger Bedarf an Notfallmedikation (β-Sympathomimetika) trotz ausgeschöpfter Langzeittherapie mit inhalativem Kortison in hoher Dosis, langwirksame inhalative β-Sympathomimetika, Theophyllin, Antileukotriene
- Systemische Kortikosteroide intermittierend oder dauerhaft notwendig
Davon abzugrenzen ist der schwere Asthmaanfall:
- Schwerer Asthmaanfall: Sprechdyspnoe, Atemfrequenz > 25/min,HF > 110/min, FEV1 oder PEF < 50% Soll
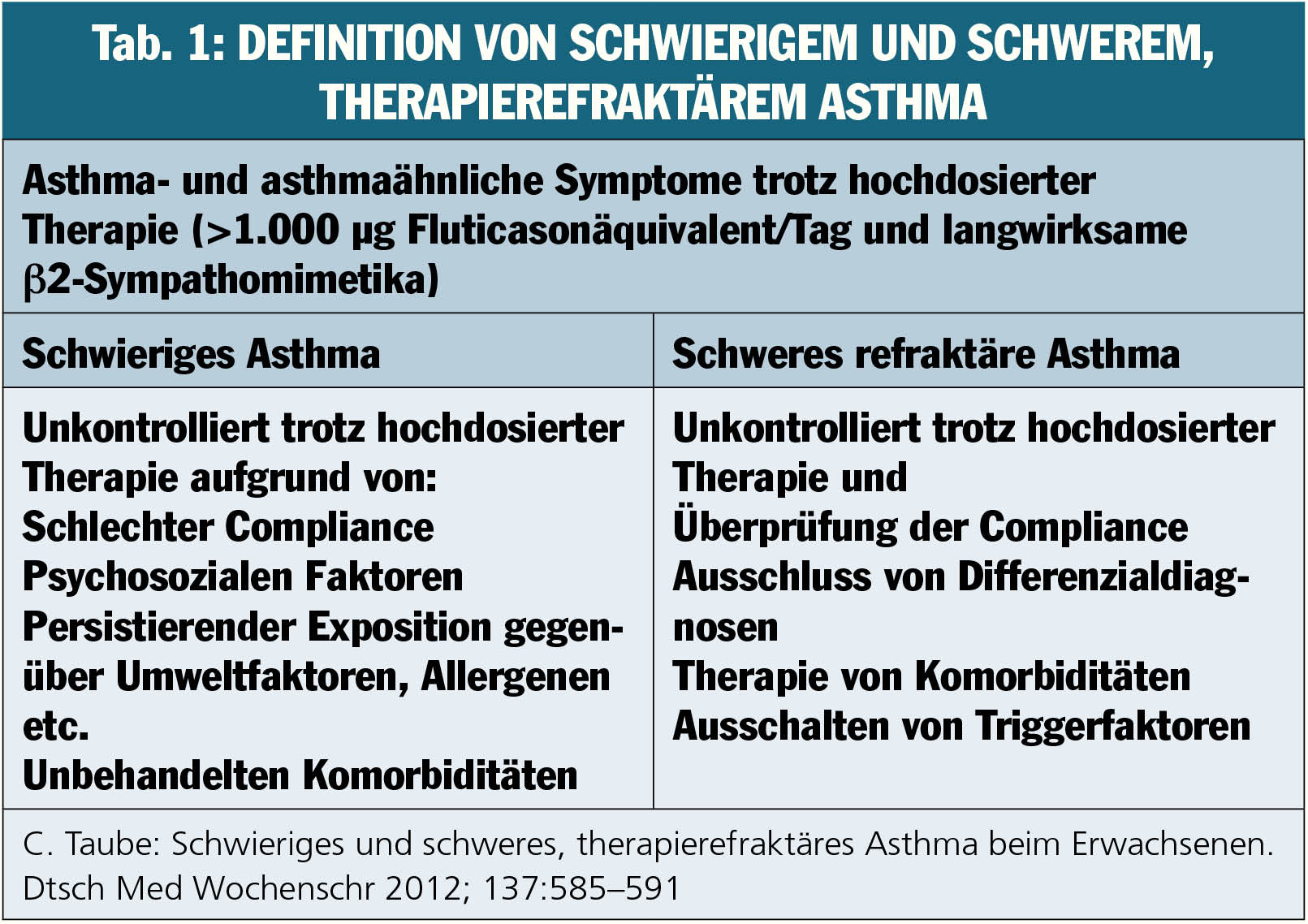
Etwa ein Zehntel der Asthmatiker können als schwere Fälle bezeichnet werden. Interessant ist die Unterscheidung in schweres und schwieriges Asthma (Tab. 1).
„Schweres Asthma ist wie eine Entgleisung trotz Nutzung der gesamten therapeutischen Palette und präventiver Maßnahmen (Ausschalten der Triggerfaktoren wie Allgergenbelastung, [Passiv-]Rauchen etc.). Die weitaus größere Gruppe ist die der Patienten mit schwierigem Asthma“, so Prim. Dr. Gert Wurzinger, Lungenabteilung LKH Hörgas-Enzenbach und Pulmologische Tagesklinik des LKH Graz West.
Bei diesen Patienten würde man sich eigentlich erwarten, dass sie sich an die Therapievorgaben halten, z.B., weil sie schon Angst vor dem nächsten Anfall haben oder durch Ausschluss von Umweltfaktoren ihr Asthma unter Kontrolle bringen könnten. Doch sie tun es nicht. Diese Patienten sind oft schwieriger zu therapieren.
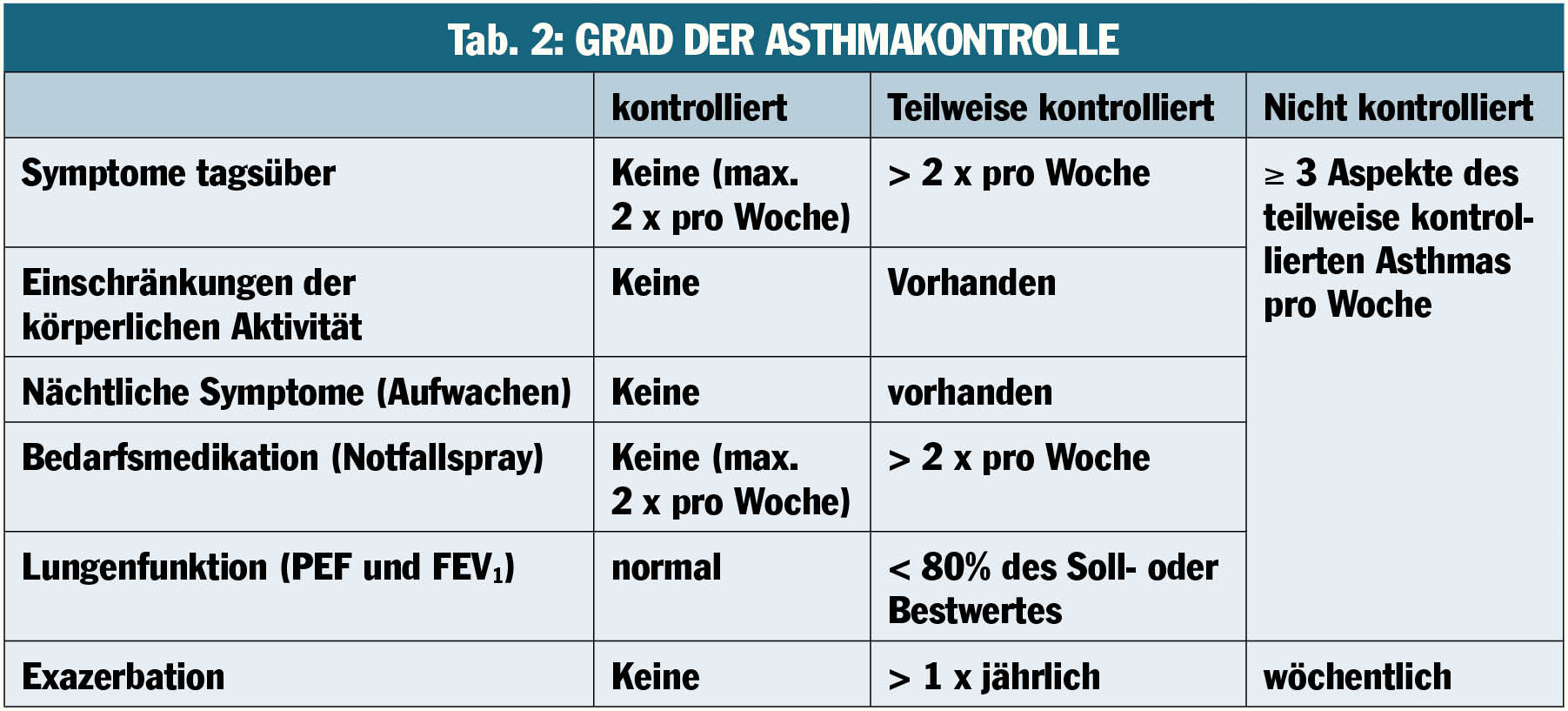
Die Asthma-Kontrolle nach GINA
Derzeit wird unterschieden zwischen Patienten, bei denen das Asthma entweder kontrolliert, nur teilweise kontrolliert oder nicht kontrollierbar ist (siehe Tab. 2).
Bei gut kontrollierten Patienten können die Medikamente solange reduziert werden, bis es wieder zu Beschwerden kommt – Übertherapie muss nicht sein. Wichtig ist, dem Patienten einen Notfallplan mitzugeben.
Ist der Patient nicht oder nur teilweise kontrolliert, muss die Dosis solange erhöht werden, bis das Asthma unter Kontrolle ist. Das geht mit „Step-up-Step-down-Therapien“. Man sollte sich dabei auch an der Anamnese und nicht nur an der Lungenfunktion orientieren.
Zusätzlich sollte der behandelnde Arzt den Histaminspiegel kontrollieren. Haben Asthmapatienten eine Histaminintoleranz (niedriger Diaminoxydasespiegel bzw. erhöhter Histaminspiegel), sollten sie eine Zeit lang histaminarm essen. Entspannungstechniken, wie Yoga etc., aber vor allem die Asthmaschulung sind für die Therapie des schweren Asthmas empfohlen.
Außerdem sollte ein Peakflowmetrie-Protokoll geführt werden, an dem man erkennt, wie es um den Patienten steht. Die Peakflowmetrie, bei der der Patient mindestens drei Messungen durchführen sollte, sollte in der Früh und am Abend gemacht werden, und zwar unbedingt vor einer Inhalation, da es sonst keinen Ausgangswert gibt. Bzw. kann der Patient auch das Betamimetikum inhalieren und 15–30 Minuten danach noch einmal eine Messung durchführen, um zu sehen, wie sehr sich der Wert gegenüber der ersten Messung verbessert hat. Das ist auch eine Motivation, das Betamimetikum zu inhalieren, weil der Patient die Verbesserung seiner Werte sieht.
Bei jeder Messung wird der beste Wert im Protokoll notiert. Anhand dieser Notizen lässt sich leicht erkennen, wann sich das Asthma verschlechtert. Vom besten je erreichten Wert können 20% heruntergerechnet werden. Diese 100–80% sind die physiologische Variabilitätsbreite, in der sich der Patient über den Tag bewegen darf (grüner Bereich). Fällt der Patient unter diese 80%-Marke, kommt er in den pathologischen Bereich und es ist zu kontrollieren, warum sich der Wert verschlechtert (gelber Bereich). Bei 50% beginnt der lebensgefährliche Bereich (roter Bereich). Sobald der Patient unter diese Marke fällt, muss der Patient sofort ins nächste Krankenhaus gebracht werden.
Was lässt sich aus dem Peakflowmetrie-Protokoll ablesen?
Der Patient trägt nicht nur seine Peakflow-Werte ein, sondern kann auch noch zusätzlich Symptome vermerken. „Als Arzt kann also anhand des eingetragenen Absolutwertes der grüne, gelbe oder rote Bereich errechnet werden. Außerdem kann auch der Erfolg des Beta-Mimetikums abgelesen werden“, so Wurzinger.
Das Protokoll zeigt auch den zirkadianen Rhythmus auf. Morgens sind die Werte im Allgemeinen immer schlechter als abends, da der Vagus die Bronchien einengt. Ist der Rhythmus > 20%, ist das ein Hinweis auf eine Irritation der Bronchien.
Im Peakflowmetrie-Protkoll lassen sich auch Exazerbationen schon ein bis zwei Tage, bevor der Patient eine Verschlechterung spürt, erkennen. Wird hier sofort der Notfallplan aktiviert, kann sich die Lungenfunktion verbessern und der Patient beugt dem Asthmaanfall vor.
Die Grenzwerte und der Notfallplan können direkt am Peakflowmeter angebracht werden. So hat der Patient die Möglichkeit, leichter die einzelnen Bereiche zu erkennen und zu wissen, wann es kritisch wird.
Unumgänglich in der Therapie: Betamimetika
Um Patienten besser einstellen zu können, sollte die Basismedikation optimiert werden. „Etwa 80% der Patienten inhalieren ihre Medikamente falsch – das ist häufig ein Schulungsproblem. Das beste Medikament kann nicht helfen, wenn es nicht richtig angewendet ist!“, betont Wurzinger. „Man kann auch in der Chronopharmakologie Verbesserungen vornehmen. Wenn Patienten eher abends oder nachts Anfälle haben, hilft es nicht, wenn sie morgens ihre Medikamente inhalieren müssen.“
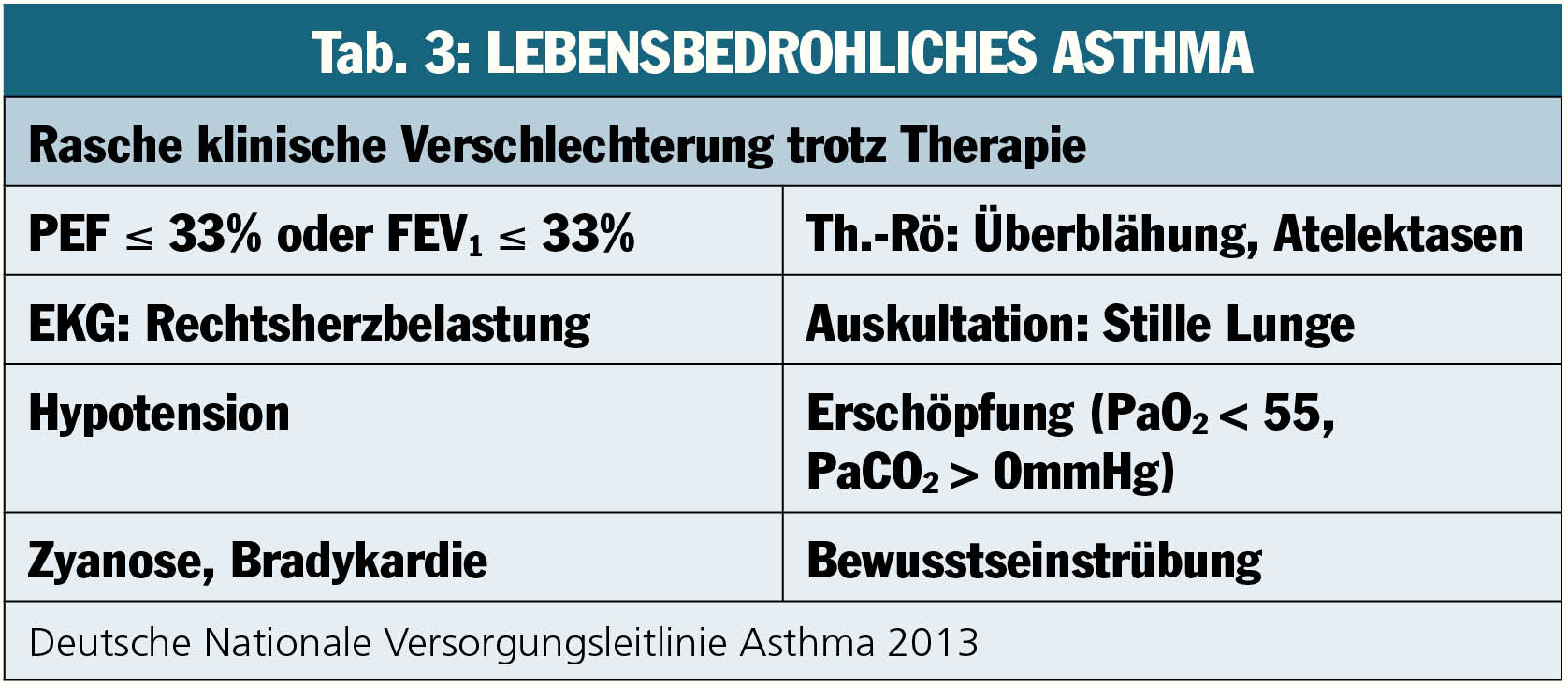
Für den lebensbedrohlichen Asthmaanfall (Tab. 3) beträgt die Initialdosis bei Dosieraerosolen vier bis acht Hübe. Hilft das nicht, folgen zwei bis vier Hübe im 15-Minuten-Intervall. Kinder können sogar permanent vernebelt werden. „Prinzipiell gibt es auch für Erwachsene keine Grenze nach oben, denn besser, es wird eine Tachykardie ausgelöst, als der Patient verstirbt an einem Asthmaanfall“, so der Pneumologe. Wird allerdings über eine lange Zeit viel Betamimetikum gegeben, muss darauf geachtet werden, dass der Patient eine Hypokaliämie entwickeln kann und Kalium substituiert werden muss.
Betamimetika werden also kumulativ gegeben und die Bronchien öffnen sich langsam von zentral nach peripher, bis der Patient selbst merkt, dass es ihm besser geht und der behandelnde Arzt eine Verbesserung des Peakflows sieht. Erst dann können die Intervalle zwischen den Inhalationen verlängert werden. „Davor gibt es keine obere Dosierungsgrenze, die einzuhalten wäre. Bei lebensbedrohlichen Asthmaanfällen kann sogar alle 30–60 Sekunden inhaliert werden! Der Effekt sollte durch Pekflowmetrie-Messungen kontrolliert werden“, hebt Wurzinger noch einmal hervor.
Systemische Betamimetika
Eine subkutane Verabreichung ist nicht evidenzbasiert. Es gibt keine Studien, die zeigen, dass oder ob subkutan appliziertes Betamimetikum besser wäre als inhalatives.
Worauf ist weiters zu achten?
- Der richtige Grad der Hydrierung
- Mukolytika bringen keinen Effekt
- Sedativa zu verabreichen ist ohne invasive Beatmungsmöglichkeit lebensgefährlich, da die Atemmuskulatur zum Stillstand kommt
- Theophyllin wird heute nicht mehr empfohlen, da es sehr viele Nebenwirkungen hat und die bronchodilatorische Wirkung sehr gering ist
Therapieempfehlungen im akuten Fall
Magnesium: Sehr gut wirkt die intravenöse Gabe von Magnesium. Es wirkt bronchodilatierend und kardioprotektiv. Die Wirkung von Magnesium ist interessanterweise umso besser, je schlechter die Funktion der Lunge ist. Eine Lungenfunktion von < 20% hat die beste Reversibilität. Besonders bei schweren Asthmaanfällen ist also die i.v. Magnesiumverabreichung ideal.
Sauerstoff: Natürlich ist auch die Gabe von Sauerstoff wirksam, v.a., wenn Anzeichen einer Ermüdung der Atemmuskulatur auftreten. Anfangs besteht ein Sauerstoffmangel, der durch eine Hyperventilation zu kompensieren versucht wird. Dann kommt es aber langsam zu einer Hypoxämie, die durch die Hyperventilation noch mit einer CO2-Verminderung einhergeht. In der Folge beginnt das CO2 aber zu steigen, was als lebensbedrohlich zu werten ist. Dann muss der Patient möglichst rasch ins Krankenhaus.
Kortikosteroide: Nach der Intensivstation bekommt ein Patient natürlich systemische Kortikosteroide. Der Peakflow gibt den Hinweis, wann auf inhalative Steroide umgestellt werden darf. Anfänglich gibt es große Amplituden zwischen den Werten in der Früh und abends. Sind diese Schwankungen nur noch physiologisch vorhanden, ist der Patient außer Gefahr und kann ohne Risiko eines Rebound-Effekts umgestellt werden.
Die Peakflowmetrie ist also besonders beim schweren Asthmatiker das ideale Instrument, um den Patienten zu kontrollieren. Besonders bei Patienten, die immer wieder entgleisen, lassen sich auslösende Faktoren über über Peakflowaufzeichnungen ausfindig machen.
Vitamin D: Eine sehr interessante Arbeit aus 2012 beschäftigt sich mit dem Zusammenhang von Vitamin D und Asthma. Es wurde festgestellt, dass der Vitamin-D-Spiegel linear mit der Verschlechterung des Asthmas abnimmt. Bei schweren Asthmatikern muss also unbedingt auch auf eine Normalisierung des Vitamin-D-Spiegels geachtet werden, da sich die Erkrankung dadurch scheinbar besser kontrollieren lässt.
Maßnahmen über die internationalen Leitlinien hinaus
Salizylat-Desaktivierung: Bei Patienten mit Salizylat-Intoleranz besteht die Möglichkeit der adaptiven Desaktivierung. Dazu bekommen sie sie mehrmals täglich steigende Dosen von Salizylat.
Geht es dem Patienten gut, wird weiter gesteigert bis auf 500–1.000 mg. Langsam wird dann für die Dauertherapie wieder auf 250–200 mg gesenkt.
Anti-IgE: Seit 2013 ist die Anti-IgE-Behandlung (Omalizumab) in den Guidelines aufgenommen. Es hat den großen Vorteil, dass bei Patienten mit starkem allergischem Asthma, die nicht auf normale Werte eingestellt werden können, das Immunsystem beruhigt werden kann. In den Studien sieht man den deutlichen Profit der Patienten.
Andere Optionen sind die bronchiale Thermoplastie, die in Österreich nicht durchgeführt wird, und langwirksame Antimuskarinika (LAMA), die seit diesem Jahr verwendbar sind.
Auch in der Pipeline sind Antiinterleukin-5-Antikörper, zu denen in Mainz derzeit eine große Studie läuft. Dies wirkt ähnlich wie Anti-IgE, wirkt aber auch an den schon an die Basophilen gebundenen Antikörper und inaktiviert sie. In zwei bis drei Jahren wird dieses Medikament erhältlich sein.
Zu Bedenken ist auch die Behandlung mit Biologika. In einigen Studien wurde gezeigt, dass schwere Asthmaformen auf die Gabe von Infliximab reagieren. Das ist zwar eine Off-Label-Therapie, aber durchaus eine Option für schwere Asthmatiker.
Diese speziellen Therapien sind jedoch entsprechenden Zentren vorbehalten.