Viren: Potenzielle Gefahr für die Herzgesundheit
Virale Infekte, seien sie primär oder „übergangene“ Infekte, können in seltenen Fällen auch das Hirn oder das Herz betreffen. Die Problematik der Virusinfektion des Herzens (Perikarditis, Perimyokarditis oder reine Myokarditis) liegt in der mangelnden Spezifität der Symptome und einem breiten Spektrum der klinischen Präsentation.
Perikarditis: Klinisch unspezifisch
Bei Infekten des Perikards spielen Viren wie Coxsackie-B- und Adenoviren, aber auch Herpes, CMV und HIV eine Hauptrolle. Die Prävalenz einer Perikarditis bzw. Perimyokarditis bei schweren COVID-19-Verläufen liegt in den meisten Studien zwischen 4 % und 10 %, sofern diagnostisch danach gesucht wurde. Daneben sind auch Infektionen mit Bakterien, Parasiten und Pilzen sowie Tuberkulose zu bedenken, die allerdings in Österreich zahlenmäßig eine untergeordnete Rolle spielen. Zu bemerken ist, dass ca. 90 % der akuten Perikarditiden ätiologisch ungeklärt bleiben und als idiopathisch klassifiziert werden, wobei eine überwiegend virale Genese am wahrscheinlichsten scheint. Die klinische Präsentation ist sehr unspezifisch, u. a. mit Fieber und retrosternalem Schmerz. An eine Perikarditis sollte man bei einer Verschlechterung dieser Symptomatik beim Vorbeugen des Oberkörpers sowie bei atemabhängigen retrosternalen Schmerzen denken.
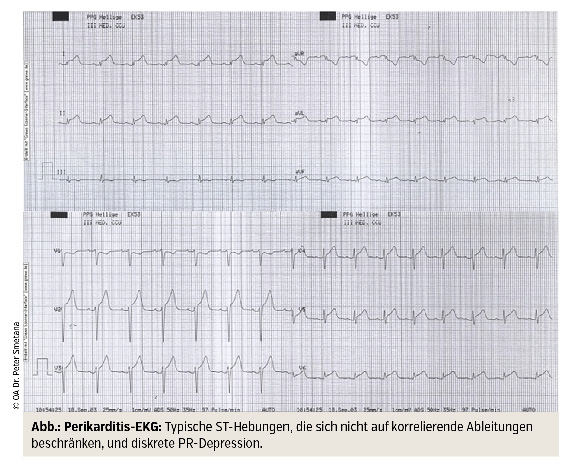
Begleiterkrankungen ausschließen: An diagnostischen Maßnahmen ist neben der Anamnese, die bereits erste Hinweise in diese Richtung geben kann, eine Auskultation vorzunehmen. Bei ca. einem Drittel der Patienten hört man ein Perikardreiben, das pathognomonische „Lederknarren“, das allerdings mit der Entwicklung eines Perikardergusses verschwindet. Die Diagnose wird meist durch das Erkennen der charakteristischen EKG-Veränderungen gestellt. Dies sind typische ST-Hebungen aus dem S heraus, die in sogenannten nichtkorrespondierenden Ableitungen auftreten (also nicht dem Gebiet einer Koronararterie entsprechen), sowie eine PR-Depression (Abb.).
Teil der diagnostischen Aufarbeitung sollte stets ein Röntgen des Thorax sein, um Ursachen nichtinfektiöser Genese, wie z. B. Malignome, Pneumonien mit Begleitpleuritis und Begleitperikarditis oder auch Tuberkulose, ausschließen zu können. Wichtig ist auch eine echokardiografische Untersuchung, da bei mehr als der Hälfte der Patienten ein Perikarderguss nachzuweisen ist. Weitere bildgebende Verfahren sind CT und MRT, wobei insbesondere dem MRT eine besondere Rolle zukommt, um simultan auch eine myokardiale Mitbeteiligung dokumentieren zu können. Im Labor sollten rotes und weißes Blutbild sowie Entzündungsparameter bestimmt werden, jedenfalls die Herzenzyme (CK, CK-MB und Troponin), um eine myokardiale Beteiligung beurteilen zu können.
Bei unkomplizierter Perikarditis ist eine weiterführende Diagnostik im Sinne einer ätiologischen Abklärung im klinischen Routinealltag zumeist nicht möglich und auch nicht notwendig. Eine zeitnahe Diagnostik ist allerdings wichtig, um Spätkomplikationen, wie eine konstriktive Perikarditis, zu vermeiden.
Therapie: Nach Ausschluss einer myokardialen Beteiligung ist standardmäßig eine Hochdosis-NSAR-Therapie mit Ibuprofen 3 × 600 mg pro Tag über zumindest ein bis zwei Wochen zu geben. Wichtig sind eine engmaschige Kontrolle der Nierenfunktion und die begleitende Gabe eines Protonenpumpeninhibitors (PPI). Bei Vorliegen einer KHK ist ASS 3 × 750–1000 mg anderen NSAR vorzuziehen. An zweiter Stelle steht Colchicin mit 2 × 0,5 mg pro Tag in der Standarddosierung, die Studienlage zeigt eindeutige Vorteile einer Kombinationstherapie aus ASS und Colchicin bzw. NSAR und Colchicin, was die Symptomlinderung, aber auch, was die Rezidivrate betrifft. Glukokortikoide sollen nicht mehr routinemäßig eingesetzt werden, sondern sind nur noch als Ultima Ratio empfohlen. Wichtig ist eine körperliche Schonung bis zur Symptomfreiheit bzw. Normalisierung der diagnostischen Parameter, jedenfalls aber ein Sportverbot für mindestens 3 Monate.
Perimyokarditis, Myokarditis: Schonung unerlässlich
Die Myokarditis bzw. myokardiale Beteiligung einer Perikarditis verlangt ein grundsätzlich anderes und deutlich radikaleres diagnostisches Vorgehen (Tab.).
Hier ist eine Koronarangiografie zum Ausschluss eines akuten Koronarsyndroms (ACS), ein MRT des Herzens sowie eine stationäre Aufnahme zur Rhythmusüberwachung notwendig. Im Gegensatz zu den retrosternalen Schmerzen und zur dramatischen klinischen Präsentation im Sinne eines subjektiven Leidensdrucks gestaltet sich die die Diagnostik der Myokarditis schwieriger. Die EKG-Veränderungen bei der reinen Myokarditis sind unspezifisch. Möglich, aber nicht pathognomonisch, sind ST-Hebungen, die einen Myokardinfarkt vortäuschen können. Arrhythmien können sowohl als Bradyarrhythmien bei AV-Überleitungsstörungen als auch als Tachyarrhythmien bis zum plötzlichen Herztod auftreten.
Laborchemisch sind die Entzündungsparameter oft im Normbereich, die CK und CK-MB sowie Troponin, vor allem bei der akuten Myokarditis, erhöht. Ein Virusnachweis gelingt meist nicht. In den meisten Häusern wird ein sogenannter „Myokarditisblock“ abgenommen, sinnvoll ist eine zweimalige Abnahme mit 1–2 Wochen Pause, um eine etwaige Serokonversion einer akuten Virusinfektion aufdecken zu können. Echokardiografisch können regionale oder diffuse Kontraktionsstörungen auftreten, eventuell fokal regionale Wandverdickungen durch ein Ödem. Hier ist allerdings das MR der Echokardiografie deutlich überlegen. Zudem schließt eine unauffällige Echokardiografie eine Myokarditis nicht aus. Das MRT des Herzens ist derzeit als nichtinvasiver Goldstandard der Myokarditisdiagnostik anzusehen, es zeigt Ödembildung, Nekrose und Hyperämie.
Eine Myokardbiopsie soll nur bei akuter Herzinsuffizienz mit hämodynamischer Kompromittierung durchgeführt werden, die Indikationsstellung sollte aufgrund der Invasivität und der oft limitierten therapeutischen Konsequenz sehr streng sein.
Der Krankheitsverlauf ist sehr unterschiedlich, meist gutartig und selbstlimitierend, allerdings ist umgekehrt eine Myokarditis bei knapp 10 % aller Patienten mit plötzlichem Herztod beschrieben. Insbesondere bei jungen Sportlern ist dies eine der häufigsten Ursachen eines plötzlichen Herztods.
Therapie: Die Therapie bei Myokarditis richtet sich nach den Komplikationen. Wichtig ist, keine NSAR-Gabe routinemäßig zu verordnen, da diese in manchen Studien mit einer erhöhten Mortalität einhergegangen ist. Bei reduzierter Linksventrikelfunktion soll eine Herzinsuffizienztherapie etabliert werden, bei akutem fulminantem Verlauf kann es auch zum Einsatz von Herz-Lungen-Maschinen auf den Intensivstationen kommen. Zum Schutz vor einer lebensbedrohlichen malignen Arrhythmie kann eine tragbare Herzschrittmacher-Weste (LifeVest) für 3 Monate erwogen werden. Eine körperliche Schonung soll jedenfalls für 6 Monate bzw. bis zur Erholung der ventrikulären Funktion strikt eingehalten werden, da die körperliche Belastung ein Trigger für potenzielle maligne Arrhythmien und konsekutiven plötzlichen Herztod sein kann.
Wissenswertes für die Praxis
- Die klinische Präsentation der Perikarditis ist sehr unspezifisch, u. a. mit Fieber und atemabhängigem retrosternalem Schmerz, ein Vorbeugen des Oberkörpers verschlechtert die Symptome.
- Auch bei sportlich aktiven jungen Menschen ist nach einer Virusinfektion bei Leistungsminderung über das zu erwartende Ausmaß an eine Myokarditis zu denken und sind diagnostische Maßnahmen (Labor, EKG) zu setzen.
- Das MRT des Herzens ist derzeit als nichtinvasiver Goldstandard der Myokarditisdiagnostik anzusehen.
- Die NSAR-Gabe ist bei einer reinen Myokarditis zu vermeiden.
- Bei Verdacht auf Myokarditis gilt absolutes Sportverbot.