Vom Mund bis Magen: Wenn Verdauung krank macht
Der Terminus Reflux bedeutet ein Flussphänomen gegen die physiologische Richtung. Im Allgemeinen bezieht man den Begriff auf den gastroösophagealen Reflux, doch gibt es das Phänomen auch als duodenogastralen Reflux und als urologisches Problem. Gastroösophagealer Reflux ist bis zu einem gewissen Ausmaß physiologisch und wird erst ab einer willkürlich definierten Grenze von 4 % der Zeit mit pH < 4 im distalen Ösophagus zur Pathologie. Dies kann, muss aber nicht mit Symptomen und Störung der Lebensqualität einhergehen.
Die typischen, kaum verwechselbaren Symptome sind Sodbrennen und saures Aufstoßen, seltener und weniger spezifisch Brustschmerzen (nach entsprechender Differenzialdiagnose). Atypische Symptome sind Heiserkeit, Husten oder Asthma. In unserer Umgebung erwarten wir Sodbrennen mehr als einmal pro Monat bei 20 % aller Erwachsenen, mehr als einmal pro Woche bei 10 %.
Die Ursachen werden nur inkomplett verstanden. Nachgebende Spannung der Zwerchfellschenkel, erhöhter Druck im Bauchraum oder im Magen und vermehrte Magensäureproduktion wirken zusammen, beeinflusst von Genetik und Lebensstil.
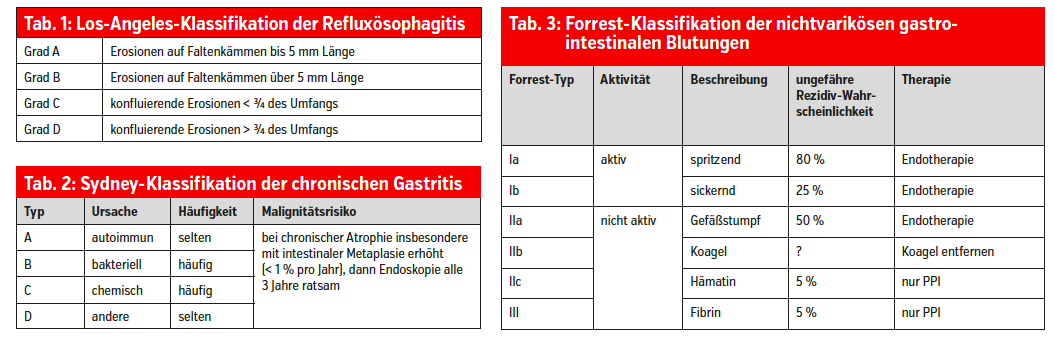
Die Diagnose wird klinisch gestellt und durch eine Probetherapie bestätigt. Im Fall typischer Symptome wird eine Standarddosis eines Protonenpumpenhemmers (PPI) einmal täglich für 14 Tage gegeben, bei atypischen Symptomen zweimal täglich eine Standarddosis für acht Wochen und danach der Erfolg evaluiert. Hat es eindeutig geholfen, ist die Diagnose für praktische Belange bewiesen. Gastroskopie, pH-Metrie, Impedanzmessung und Manometrie braucht man nur, um differenzial-diagnostische Fragen (Ösophagitis anderer Ursache, Motilitätsstörung) zu beantworten und Komplikationen bei schweren Formen (Refluxösophagitis, Stenose, Barrett, Karzinom) zu entdecken. Gastroskopisch wird die Reflux-Ösophagitis nach der Los-Angeles-Klassifikation (Tab. 1) graduiert, der Barrett-Ösophagus nach der Praha-Klassifikation vermessen. Dabei steht C für die zirkumferenzielle Länge, M für die maximale Länge der Zungen (zum Beispiel C3M5 für einen 3 cm langen zirkumferenziellen, insgesamt 5 cm langen Barrett). Radiologischer Reflux-Nachweis spielt keine Rolle mehr.
Die Therapie kennt einfache Lebensstilmaßnahmen wie Gewichtsabnahme, Nutzen der Schwerkraft postprandial und nachts, Meiden von Säurelockern und sphinkterrelaxierenden Genussmitteln, baut aber vorwiegend auf medikamentöse Säurehemmung. Dazu werden die PPI nach der Probetherapie in ihrer Dosis angepasst, bei Beschwerdefreiheit reduziert, bei ungenügender Besserung gesteigert. Sowohl H2-Blocker und Antazida als auch Alginate werden ergänzend, in milden Fällen auch anstatt des PPI eingesetzt. Wenn die Säurehemmer nicht vertragen werden, langfristig besonders hoch dosiert werden müssten oder der Patient nicht auf Dauer PPI einnehmen will, gibt es als Alternative die chirurgische Fundoplicatio. Deren Komplikationen halten sich in engen Grenzen (Unmöglichkeit des Aufstoßens, Stuhlunregelmäßigkeiten, Rezidive, praktisch keine Mortalität), aber der erwünschte Erfolg ist nicht immer gewährleistet.
Chronischer Reflux kann, meist dann, wenn er mit einer Refluxösophagitis einhergeht, also höhergradig ist, und ungenügend behandelt wurde, zu einer benignen peptischen Stenose, längerstreckig oder nur in Form eines kurzstreckigen Ringes (Schatzki-Ring) oder zur Ausbildung eines Barrett-Ösophagus führen. Stenosen werden mit hochdosierter, längerfristiger PPI-Therapie während einer Serie von endoskopischen Dehnungen behandelt. Bezüglich des Risikos eines Barrett-Ösophagus verweise ich auf das Kapitel „Ösophaguskarzinom“.
Einteilung der Dyspepsie
Dyspeptische Symptome wie postprandiale epigastrische Schmerzen, Völlegefühl nach dem Essen oder Übelkeit sind alltägliche Beschwerden, die meist spontan oder durch einfache Hilfsmittel wieder verschwinden. Wenn diese Beschwerden mehr als drei Monate anhalten oder immer wiederkehren und die ärztliche Untersuchung ergebnislos bleibt, sprechen wir von Dyspepsie oder Reizmagen. Etwa 5 % aller Erwachsenen leiden daran.
Wie viel Diagnostik für den Reizmagen ausreicht und wann sie einsetzen soll, hängt von der Schwere der Symptome, zusätzlichen Alarmsymptomen, Alter, Komorbidität, Medikamentenanamnese, Helicobacterprävalenz und Gesundheitssystem ab. Massive Schmerzen oder Erbrechen, oft schwer von einer Ulkus-erkrankung abgrenzbar, können ein CT, eine Sonografie oder eine Gastroskopie am selben Tag notwendig machen, ebenso Blutungszeichen. Ein Malignomverdacht wird eine rasche Diagnostik innerhalb einer Woche begründen, leichtere Symptome werden zuerst eine Probetherapie oder nichtinvasive Helicobacterdiagnostik erhalten.
Obwohl pathophysiologisch wenig begründbar, hat sich die Einteilung der Dyspepsie in einen Säuretyp, einen Motilitätstyp und einen Refluxtyp wegen des intuitiven Bezugs zur naheliegenden Probetherapie (PPI für Säure- und Refluxtyp, Prokinetika für Motilitätstyp) bewährt.
Wenn diese Probetherapie nicht nützt, kann man noch auf Phytotherapeutika wie Anis, Kümmel, Wermutkraut, Tausendgüldenkraut und viele andere zurückgreifen. Auch wenn es nicht sauber bewiesen ist, empfehle ich Nikotinkarenz, nur sparsamen oder keinen Alkoholkonsum und Medikamentengebrauch, Vermeidung individuell unverträglicher Nahrungsmittel (häufig Kaffee), Stressbewältigungsstrategien oder Psychotherapie (beispielsweise Hypnotherapie). Die Prognose ist bei korrekter Differenzial-diagnose inklusive einer unauffälligen Gastroskopie mit Biopsie sehr gut.
Gastroskopische Überwachung sinnvoll
Gastritis ist eine histologische Diagnose. Gastritis kann symptomfrei verlaufen oder mit Beschwerden der Dyspepsie einhergehen, aber auch mit Blutungen. Man unterscheidet akute und chronische Gastritiden. Chronische Gastritiden können die Ulkusentwicklung begünstigen und ein Risikofaktor für Magenkarzinom und MALT-Lymphom des Magens sein.
Chronische Gastritiden teilt man nach der Sydney-Klassifikation (Tab. 2) in Typ A (autoimmun), Typ B (bakteriell), Typ C (chemisch) und Typ D (andere) ein. Am häufigsten sind Typ B und C.
Typ B wird durch Helicobacter pylori verursacht und steigt vom Antrum mehr oder weniger weit Richtung Corpus auf. Dabei kann sich der Schwerpunkt der Entzündung vom Antrum zum Corpus hin verschieben. Die in schweren Fällen auftretende Atrophie kann durch zusätzliche intestinale Metaplasie zur Präkanzerose werden (Correa-Kaskade) und regelmäßige Gastroskopien mit Biopsien zur Überwachung sinnvoll machen (Gastroskopie alle drei Jahre, bei leichter Dysplasie alle sechs Monate). Die histologischen Gradingsysteme OLGA und OLGIM präzisieren diese Empfehlungen noch weiter. Aktuelle Informationen zur Helicobacterprävalenz in Österreich, zur Resistenzlage und zu den derzeit empfohlenen Eradikationsschemata entnehmen Sie bitte der ÖGGH-Website, Rubrik „Fachwissen“.
Typ C wird entweder exogen (durch Medikamente wie NSAR, ASS) oder endogen (durch duodenogastralen Reflux) ausgelöst. Zur Prophylaxe bei geplanter NSAR- oder ASS-Therapie können niedrigdosierte PPI oder Prostaglandine in Risikokonstellationen verwendet werden (siehe Empfehlungen der Rheumatologen, Kardiologen und Gastroenterologen Österreichs auf ihren jeweiligen Homepages).
Die Typ-A-Gastritis ist mit einer proximal betonten, mehr oder weniger kompletten Atrophie der Magenschleimhaut verbunden. Antikörper gegen Parietalzellen und Intrinsic Factor können im Plasma nachgewiesen werden. Eine gastroskopische Überwachung alle ein bis zwei Jahre wird wegen des erhöhten Risikos für Karzinome und neuroendokrine Tumoren des Magens eindringlich empfohlen. Eine parenterale Substitution von Vitamin B12 und Eisen ist regelmäßig notwendig.
Unter dem Typ D verbergen sich so unterschiedliche Erkrankungen wie Morbus Crohn, Sarkoidose, infektiöse oder allergische Entzündungen der Magenschleimhaut, die ganz spezifische Behandlungsansätze notwendig machen. Chronische Gastritis bereitet den Boden für Erosionen und Ulzera sowie für das Magenkarzinom. Damit wird die Prognose zweifelhaft.
Gute Prognose bei adäquater Behandlung
Ein Ulkus ist ein Schleimhautdefekt, der die Muscularis mucosae durchdringt. Wir unterscheiden Ulzera des Magens und des Duodenums. Die Prädilektionsstelle im Duodenum ist der Bulbus, im Magen das Antrum und besonders die Angulusfalte. Ulzera entstehen durch ein Ungleichgewicht zwischen Aggression (Säure, Pepsin, Galle, Pankreassaft) und Protektion (Schleim, Zellintegrität, Durchblutung) an der Schleimhaut. Daher sind die Gastritis und die mitbefallenen gastralen Metaplasien im Bulbus duodeni der wesentliche Wegbereiter der Ulkuskrankheit.
Da Gastrin der wichtigste Stimulator der Magensaftsekretion ist, kommt es bei der tumorbedingten exzessiven Überproduktion in Gastrinomen (Zollinger-Ellison-Syndrom) zu multiplen, meist duodenalen und jejunalen Ulzera mit schweren Komplikationen. Weitere seltene Ursachen von Ulzera sind Durchblutungsstörungen, wie an der Anastomose nach Magenresektionen oder nach Embolien.
Ulzera verursachen Oberbauchschmerzen, typischerweise in Nüchternphasen, aber auch postprandial. Ausstrahlung ist möglich. Kompliziert können Ulzera durch Blutung, Stenose, Penetration oder Perforation werden. Ulcera ventriculi können mit einem exulzerierten Magenkarzinom verwechselt werden.
Die Diagnostik der Ulkuskrankheit fußt fast ganz auf der Gastroskopie mit Biopsie, daneben hat das Magenröntgen kaum mehr Bedeutung. Ein CT kann bei Komplikationen hilfreich sein. Die Endosonografie (EUS), in vielen Belangen die letzte Instanz im Oberbauch, ist bei Gastritis und Ulkus bedeutungslos.
Ulzera werden mit hochdosierten PPI behandelt (zum Beispiel Esomeprazol 80 mg oder Pantoprazol 80 mg, später in reduzierter Dosis), je nach klinischer Situation intravenös oder oral. Eine Helicobacterinfektion muss gesucht und bei Nachweis eradiziert werden. Bei Komplikationen kommen außerdem interventionelle endoskopische (Tab. 3), radiologische und operative Verfahren zur Anwendung. Die Abheilung der Ulzera und der Erfolg einer Helicobactereradikation sollen monitiert werden.
Die Prognose des unkomplizierten Ulkusleidens ist bei adäquater Behandlung gut, Komplikationen haben aber eine substanzielle Mortalität (zum Beispiel Blutungen circa 5 %).