Wandel in der Therapie der venösen Thromboembolien
Die venöse Thromboembolie (VTE) mit Manifestation als tiefe Beinvenenthrombose (TVT), Pulmonalembolie (PE) oder gleichzeitiger Präsentation beider Krankheitsbilder ist ein keineswegs seltenes Krankheitsbild und wird sowohl im ambulanten als auch im stationären Bereich häufig diagnostiziert. Für die TVT wird eine jährliche Inzidenz von 150 Fällen/100.000 und für die PE eine von 100 Fällen/100.000 angegeben. Dabei besteht eine ausgeprägte Altersabhängigkeit mit starker Zunahme der VTE-Rate mit zunehmendem Lebensalter. In der Liste der kardiovaskulären Todesursachen nimmt die VTE als fatale PE den dritten Platz hinter Herzinfarkt und Schlaganfall ein. Zusätzlich sind auch Langzeitkomplikationen, wie ein postthrombotisches Syndrom nach TVT und eine chronische thromboembolische pulmonale Hypertension (CTEPH) nach meist wiederholter PE zu berücksichtigen.
Therapiedauer
Das Ziel der Therapie einer symptomatischen VTE ist die Linderung der bestehenden Symptomatik (Schmerzen, Beinschwellung, Dyspnoe), die Verhinderung einer Thrombusprogression sowie die Vermeidung von akuten (Reembolien, zum Teil mit fatalem Ausgang) und chronischen Komplikationen. Die Therapie der VTE kann in drei Phasen eingeteilt werden (siehe Abb. 1). Die initiale Therapiephase besteht in einer besonders intensiven Antikoagulation und dient der Verhinderung eines frühen Rezidivs der Erkrankung. An die Initialphase schließt sich die frühe Erhaltungstherapie an, welche je nach initialer klinischer Präsentation und Heilungsverlauf etwa drei bis sechs Monate dauert. Im Anschluss daran wird bei entsprechender Indikation eine verlängerte Erhaltungstherapie angeschlossen. Früher gültige Behandlungsrichtlinien sahen eine unbefristete Langzeittherapie in erster Linie nur bei rezidivierenden VTE-Ereignissen vor. In den letzten Jahren haben sich diese Empfehlungen insofern geändert, dass nach den aktuellen Guidelines (9th ACCP von 2012) bereits nach einer einmaligen, idiopathischen proximalen TVT oder PE und niedrigem bis mittlerem Blutungsrisiko eine zeitlich unbefristete Dauertherapie erwogen wird. Diese Empfehlungen sind durch das hohe Rezidivrisiko nach einem idiopathischen VTE-Ereignis begründet. Der Nachweis oder auch der Ausschluss einer hereditären Thrombophilie ändert diese Einschätzung nicht und wird daher nicht generell empfohlen. Dabei muss allerdings betont werden, dass für die Festlegung der Therapiedauer auch andere Gesichtspunkte (z.B. Blutungsrisiko, Patientenwunsch) zu berücksichtigen sind und regelmäßig evaluiert werden sollten. In der Praxis ist die Entscheidung für das Absetzen oder auch die Fortsetzung einer Antikoagulanzientherapie in vielen Fällen nicht einfach. Die Bestimmung des D-Dimers frühestens drei Wochen nach Absetzen der Antikoagulation kann dabei helfen, Patienten in Gruppen mit höherem (D-Dimer positiv) und niedrigerem (D-Dimer negativ) Rezidivrisiko zu stratifizieren.
Ambulante Therapie
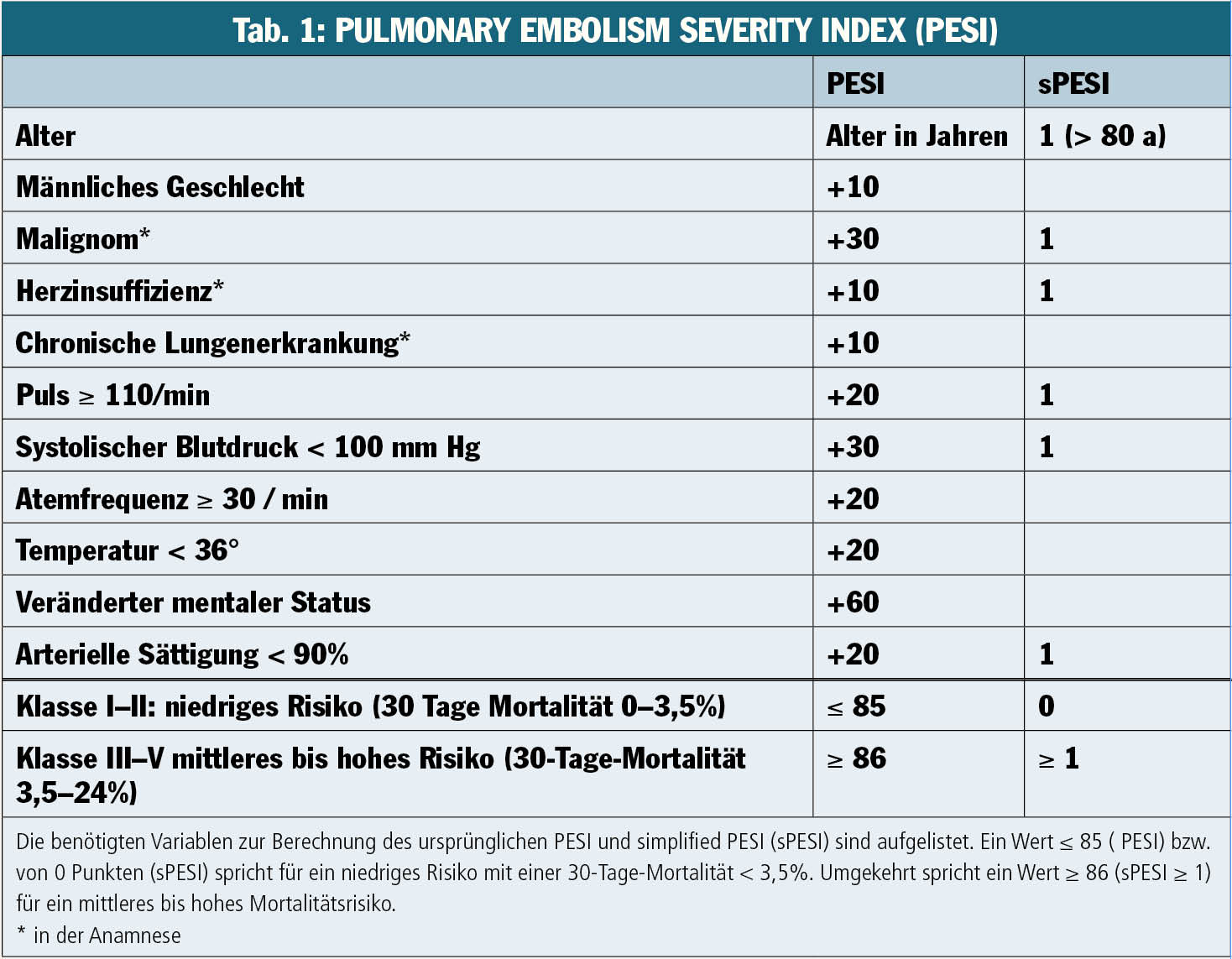
Die früher für VTE-Patienten verordnete Bettruhe ist weitgehend verlassen worden, und für die TVT ist heute in vielen Fällen eine ambulante Therapie der Standard. Dabei sollte bei einer TVT auch auf eine adäquate Kompressionstherapie mittels Kurzzugkompressionsverband bzw. Kompressionsstrumpf der Klasse II zur Prophylaxe eines postthrombotischen Schadens geachtet werden. Für eine optimale Wirksamkeit sollte die Kompression bei einer proximalen TVT über zwei Jahre nach dem TVT-Ereignis fortgesetzt werden. In jedem Fall immobilisiert wird heute nur noch der hämodynamisch instabile PE-Patient. Andererseits kann für PE-Patienten mit niedrigem Risiko eine frühe Entlassung und in Einzelfällen eine ambulante Therapie erwogen werden. Zur Abschätzung des Mortalitätsrisikos innerhalb von 30 Tagen wurden Risikoscores (Pulmonary embolism severity index, [PESI] und simplified PESI) entwickelt und validiert (Tab. 1).
NOAK/DOAK in der Therapie der VTE
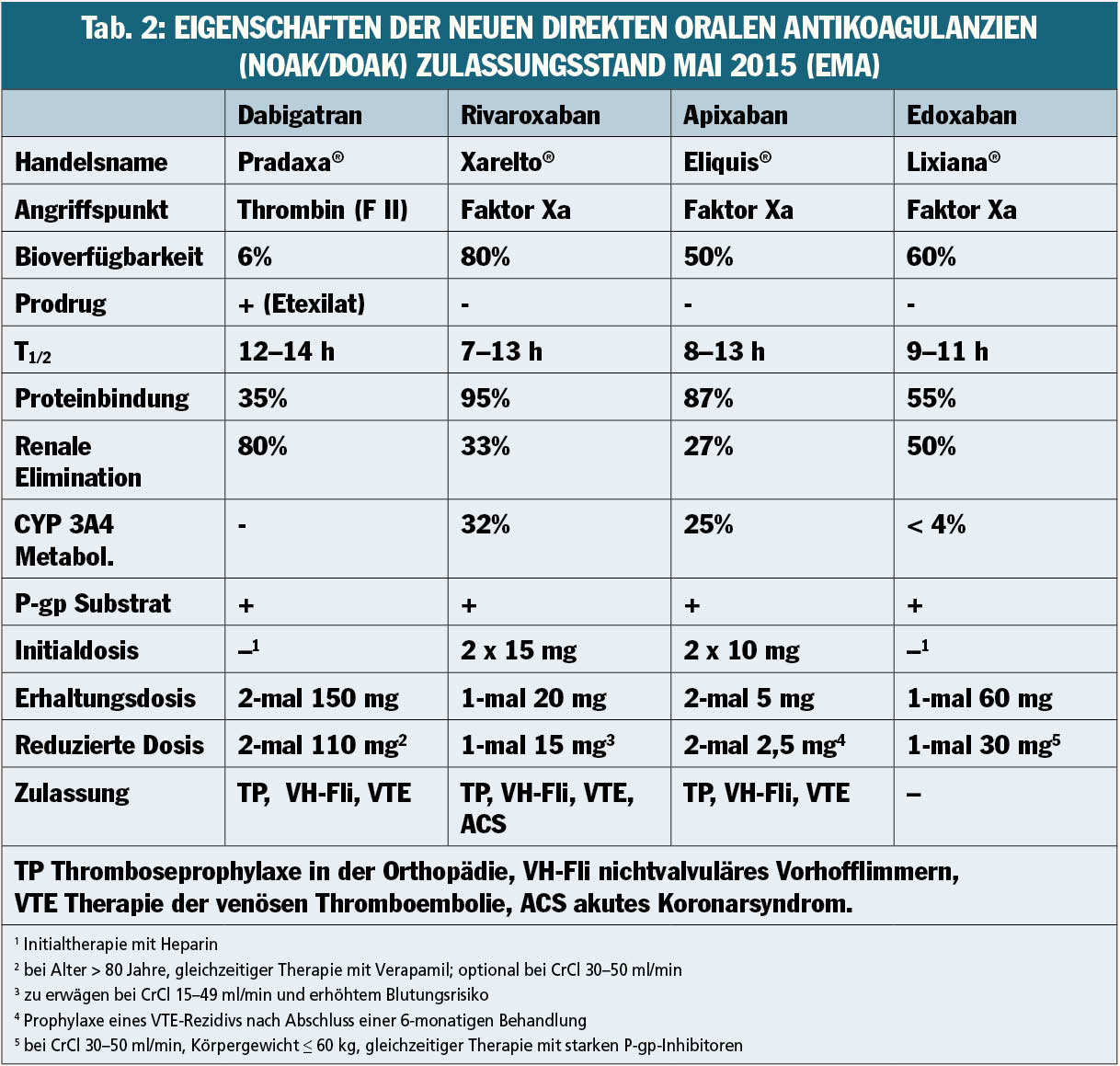
In Tabelle 2 sind wichtige Eigenschaften, der aktuelle Zulassungsstatus sowie die Dosierungsempfehlungen für die neuen direkten oralen Antikoagulanzien (NOAK/DOAK) in der Therapie der venösen Thromboembolie aufgelistet. Für die Initialtherapie der VTE ohne vorangegangene Heparintherapie sind derzeit zwei direkte orale Faktor-Xa-Inhibitoren zugelassen, wobei für die initiale Therapiephase erhöhte Dosierungen vorgesehen sind. Rivaroxaban wird in den ersten drei Wochen in einer Dosis von zweimal 15 mg eingenommen und anschließend in einer Dosis von einmal 20 mg als Dauertherapie fortgesetzt. Bei einer Kreatininclearance von 15–49 ml/min und erhöhtem Blutungsrisiko kann eine Dosisreduktion auf einmal 15 mg erwogen werden. Apixaban wird in der ersten Woche in einer Initialdosis von zweimal 10 mg und anschließend in einer Erhaltungsdosis von zweimal 5 mg eingenommen. Nach Abschluss einer sechsmonatigen Behandlung ist bei Apixaban eine Dosisreduktion auf zweimal 2,5 mg in der verlängerten Erhaltungstherapie zur Sekundärprophylaxe eines VTE-Rezidivs vorgesehen. Beide Faktor-Xa-Inhibiotoren sind bei einer Kreatininclearance unter 15 ml/min kontraindiziert. Der direkte Thrombininhibitor Dabigatran ist nach initialer Heparintherapie (mindestens fünf Tage) ebenfalls zur Therapie der VTE in einer Dosierung von zweimal 150 mg zugelassen. Bei einem Alter über 80 Jahre oder begleitender Therapie mit Verapamil muss die Dosis von Dabigatran auf zweimal 110 mg reduziert werden, eine Reduktion ist auch bei einer Kreatininclearance von 30–50 ml/min möglich, unter 30 ml/min ist Dabigatran kontraindiziert. Falls initial eine Therapie mit niedermolekularem Heparin (NMH) durchgeführt wurde, kann zum Zeitpunkt der nächsten geplanten Verabreichung des NMH (oder bis zu zwei Stunden davor) auf ein NOAK umgestellt werden. In jedem Fall ist zum Unterschied zu den Vitamin-K-Antagonisten keine überlappende Gabe mit Heparin vorgesehen. Ein weiterer Faktor-Xa-Hemmer (Edoxaban) wird voraussichtlich bald zugelassen werden. Die vorliegenden Studiendaten belegen neben der vergleichbaren Wirksamkeit auch ein sehr gutes Sicherheitsprofil mit einem Trend zu weniger schweren Blutungen unter NOAK im Vergleich zu den Vitamin-K-Antagonisten. Dazu kommen noch eine Reihe praktischer Vorteile, wie eine voraussagbare Pharmakokinetik mit fixer Dosierung unter Wegfall der bei Vitamin-K-Antagonisten notwendigen engmaschigen Gerinnungskontrollen und laufenden Dosisanpassungen. Zudem sind bei den NOAK im Vergleich zu den Vitamin-Antagonisten deutlich weniger Interaktionen mit anderen Medikamenten und Nahrungsmitteln zu erwarten. Wichtig ist allerdings, das bestehende Gegenanzeigen, insbesondere mechanische Herzklappen, eine höhergradige Nieren- oder Leberinsuffizienz sowie eine Schwangerschaft oder Stillperiode vor einer Verschreibung von NOAK ausgeschlossen werden. Potenzielle Nachteile der NOAK sind derzeit noch im Fehlen spezifischer Antidots, welche aber bereits in klinischer Testung stehen, sowie in der noch eingeschränkten Erfahrung in der Langzeittherapie mit den neuen Substanzen zu sehen.
Neue ESC-Guidelines zur PE
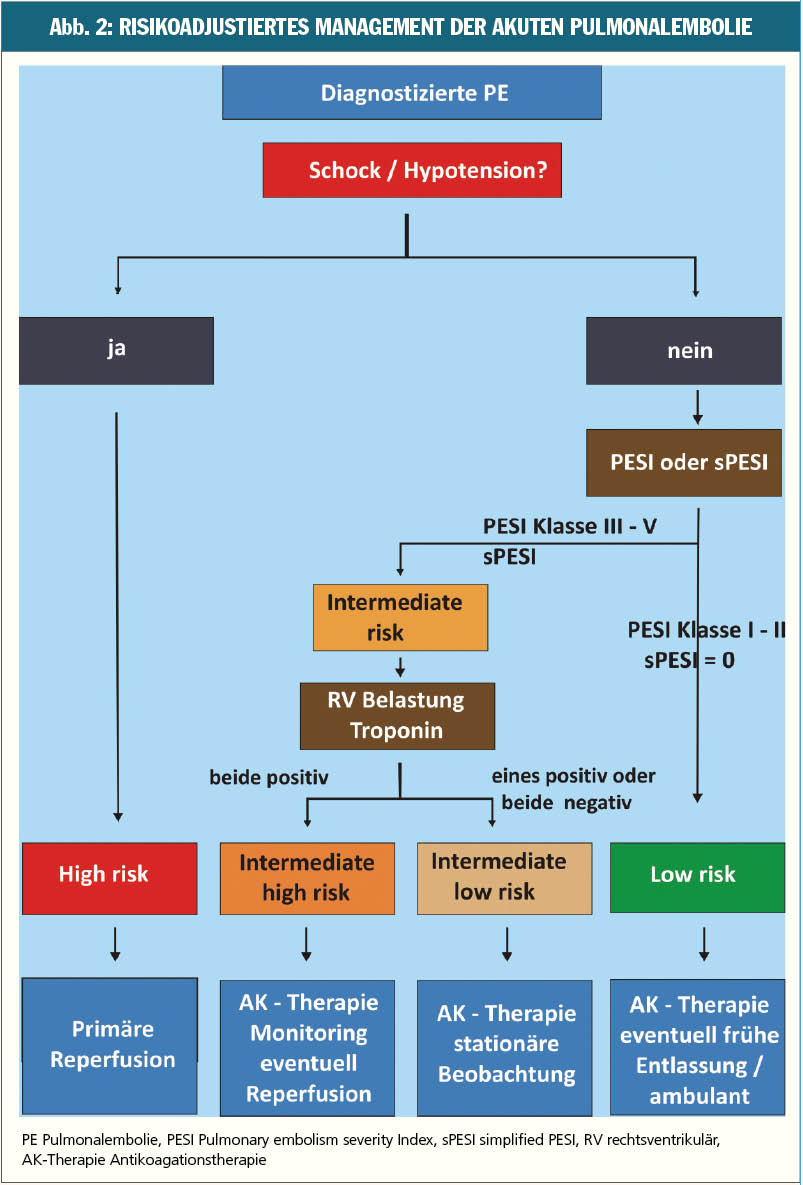
Vor kurzem wurden von der European Society of Cardiology (ESC) neue Guidelines für die Pulmonalembolie veröffentlicht. Neu ist dabei die Einteilung der Pulmonalembolie in vier statt bisher drei Risikogruppen (Abb. 2). Unverändert werden Patienten mit Schock oder Hypotonie der High-risk-Gruppe zugeordnet und sollten beim Fehlen von Kontraindikationen eine primäre Reperfusion (üblicherweise systemische Thrombolysetherapie) erhalten. Alle anderen Patienten mit gesicherter Pulmonalembolie sollen anhand des oben beschriebenen PESI oder simplified PESI Scores weiter risikostratifiziert werden. Ein PESI Klasse I–II beziehungsweise ein simplified PESI von 0 spricht dabei für ein niedriges Mortalitätsrisiko (low risk). Die Patienten in dieser Gruppe werden mit Antikoagulanzien eingestellt, wobei oft eine frühe Entlassung, in Einzelfällen auch eine ambulante Behandlung möglich ist. Patienten mit einem PESI Klasse ≥ III oder sPESI ≥ 1 werden anhand der bildgebenden Zeichen einer Rechtsherzbelastung (in der Echokardiographie oder Computertomografie) und der kardialen Biomarker (insbesondere Troponin T oder I) weiter stratifiziert. Sind beide Tests positiv, liegt ein intermediate high Risiko vor. Neben Antikoagulation und Monitoring ist hier, insbesondere bei hämodynamischer Verschlechterung, auch eine systemische oder kathetergerichtete Thrombolyse zu diskutieren. Die Patienten, bei denen nur ein oder keiner dieser Tests positiv sind, werden als intermediate low risk eingestuft und benötigen neben der Antikoagulation eine stationärer Überwachung.
Zusammenfassung
In den letzten Jahren hat sich die Therapie der venösen Thromboembolien deutlich gewandelt. Eine wichtige Änderung betrifft die Therapiedauer, wobei hier der Trend zu einer Dauertherapie bereits nach einem einmaligen, schweren idiopathischen Erstereignis einer VTE geht. Die in den letzten Jahren entwickelten NOAK/DOAK haben das Potenzial, die Therapie der VTE durch ihre Vorteile gegenüber den Vitamin-K-Antagonisten (vergleichbare Wirkung bei mindestens gleicher Sicherheit, fixe Dosierung, Wegfall routinemäßiger Gerinnungskontrollen, deutlich weniger Interaktionen mit Medikamenten und Nahrungsmitteln) wesentlich zu vereinfachen. Der Schweregrad einer PE kann mittels eigens dafür entwickelter Indizes abgeschätzt werden. Die akute PE wird nach den neuesten Guidelines unter anderem danach in vier Risikokategorien mit entsprechendem unterschiedlichem Management unterteilt.