Wie kann man die Nierenfunktion erhalten?
Im Jahr 2021 lebten etwa 537 Millionen Erwachsene weltweit mit Diabetes, diese Zahl soll sich bis zum Jahr 2045 auf 783 Millionen Menschen vergrößern.1
Die Prävalenz chronischer Niereninsuffizienz liegt bei Diabetes-Patient:innen > 25 %. Es wird geschätzt, dass 40 % aller Menschen mit Diabetes eine chronische Niereninsuffizienz (CKD) im Lauf ihres Lebens entwickeln. Nachdem die Prävalenz von Diabetes steigend ist, steigt proportional auch die CKD.2 Bei vielen Patient:innen verläuft die Erkrankung progredient und endet letztlich in einer terminalen Niereninsuffizienz bzw. Nierenversagen mit einem erheblich erhöhten Risiko für kardiovaskuläre Morbidität und Mortalität.3
Diagnose der CKD
Die CKD wird definiert durch eine geschätzte glomuläre Filtrationsrate (eGFR) < 60 ml/min/1,73 m2 und/oder Albuminurie (Albumin-Kreatinin-Ratio im Harn ≥ 30 mg/g) bzw. durch das Vorhandensein anderer Anzeichen von Nierenschädigung wie Hämaturie oder Strukturanomalien.2 Die Situation muss mindestens 3 Monate bestehen, damit die Diagnose als gesichert gilt. Die CKD ist meistens ein Zufallsbefund, da sie häufig keine Symptome verursacht.2 Jedoch weist die Niere oftmals bereits bei der Diagnose von Diabetes oder Hypertonie schon erste Schäden auf.3 Die gemeinsamen Leitlinien der American Diabetes Association (ADA) und Kidney Disease: Improving Global Outcomes (KDIGO) empfehlen daher, Patient:innen mit Diabetes jährlich auf die Anzeichen einer CKD zu screenen.2
Behandlung der CKD
Die ADA/KDIGO-Leitlinien empfehlen die Erstellung eines umfassenden ärztlichen Behandlungsplans in Abstimmung mit den Patient:innen. Dieser sollte neben der medikamentösen Therapie auch Lebensstilempfehlungen hinsichtlich Ernährung, Bewegung, Rauchstopp und Gewichtsmanagement beinhalten. Eine evidenzbasierte Pharmakotherapie, die sofort nach Diagnose der CKD begonnen werden soll, erhält bestmöglich die Organfunktion und hilft beim Erreichen der definierten Zielwerte für Glykämie, Blutdruck und Lipidstatus.2Die empfohlene Medikation umfasst eine RAS-Blockade (ACE-Inhibitor oder Angiotensin-II-Rezeptorblocker) für Diabetiker:innen mit Hypertonie und Albuminurie. Darüber hinaus ist die Einnahme eines Statins zur primären Prävention atherosklerotischer kardiovaskulärer Erkrankungen bei Diabetes und CKD angeraten. Bei Typ-2-Diabetes und einer eGFR ≥ 30 ml/min/1,73 m² ist Metformin empfohlen, gemeinsam mit einem SGLT2-Inhibitor (hier sollte initial die eGFR ≥ 20 ml/min/1,73 m² liegen, kann dann aber auch bei niedrigerer eGFR fortgesetzt werden). In bestimmten Fällen kann auch die Zugabe eines GLP-1-Rezeptoragonisten (RA) sowie eines nichtsteroidalen Mineralkortikoid-Rezeptorantagonisten (MRA) erforderlich sein (Abb.).2
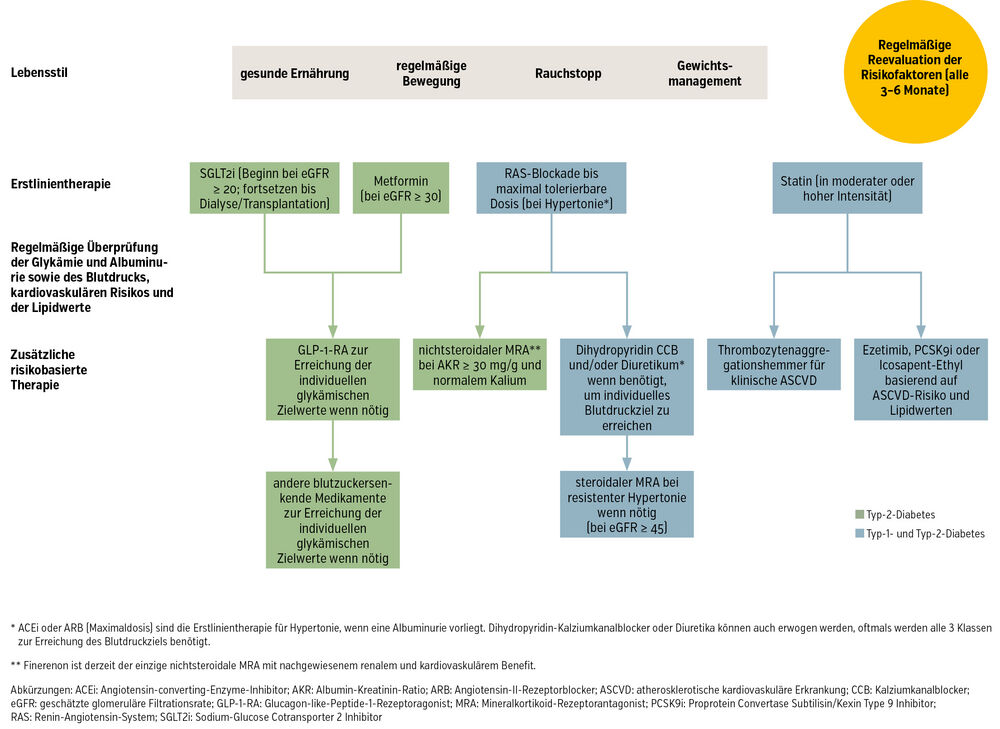
Abb.: Behandlungsansatz für Patient:innen mit Diabetes und CKD adaptiert nach de Boer IH et al. Diabetes Care 20222
SGLT2-Inhibitoren
SGLT2-Hemmer sorgen für die Glukose-Rückresorption in den Nieren, wodurch überschüssige Glukose mit dem Urin ausgeschieden wird, was eine insulinunabhängige Senkung des Blutzuckerspiegels bedingt.4 Darüber hinaus konnte neben dieser Wirkung sowohl ein relevanter kardio- als auch nephroprotektiver Effekt für Empagliflozin4, 5, Canagliflozin6, 7 und Dapagliflozin8, 9 nachgewiesen werden. Damit besteht eine hohe Evidenz, dass diese Substanzen die CKD-Progression sowie das kardiovaskuläre Risiko und das Risiko der Entwicklung einer Herzinsuffizienz bei Menschen mit Diabetes und CKD reduzieren.2
GLP-1-Rezeptoragonisten
GLP-1-RA reduzieren die Albuminurie und verlangsamen die Reduktion der eGFR.10 Darüber hinaus kann das Risiko für schwerwiegende kardiovaskuläre Ereignisse gesenkt werden, wie die kardiovaskulären Outcome-Studien von Dulaglutid11, Liraglutid12 und Semaglutid13 gezeigt haben. Wurde der individuelle glykämische Zielwert mit Metformin und/oder dem SGLT2-Inhibitor verfehlt oder besteht eine Kontraindikation, sollte ein GLP-1-RA verabreicht werden, um die glykämischen Zielwerte zu erreichen.2
Mineralkortikoid-Rezeptorantagonisten
Der steroidale MRA Spironolacton wird für das Management der resistenten Hypertonie und zur Behandlung des primären Hyperaldosteronismus bei normaler eGFR eingesetzt, führt aber zu Hyperkaliämie, besonders bei reduzierter Nierenfunktion.2 Eine neue Klasse nichtsteroidaler MRA wird derzeit bei Patient:innen mit Typ-2-Diabetes und CKD untersucht.2 Finerenon reduzierte bei diesem Patientenkollektiv in 2 Phase-III-Studien die CKD-Progession14 sowie kardiovaskuläre Ereignisse.15 Besteht trotz maximaler RAS-Blockade weiterhin eine Albuminurie ≥ 30mg/g, ist die Kaliumkonzentration im Serum normal, und liegt die eGFR ≥ 25 ml/min/1,73 m², ist die Zugabe eines nonsteroidalen MRA empfohlen.2
Eine rezent publizierte Analyse, welche die Daten der großen randomisierten Outcome-Studien von SGLT2-Inhibitoren, GLP-1-RA und nichtsteroidalen MRA von Patient:innen mit Typ-2-Diabetes und (zumindest moderater) Albuminurie miteinander kombiniert hat, sieht ein großes Potenzial für relevante Überlebensvorteile, wenn diese Medikamente gemeinsam eingesetzt werden.16 In dieser Berechnung reduzierte sich das geschätzte Risiko für schwerwiegende kardiovaskuläre Ereignisse um 35 % im Vergleich zur konventionellen Behandlung. Beispielsweise könnte für eine:n Patient:in im Alter von 50 Jahren die geschätzte Zeit bis zur CKD-Progression sogar um 5,5 Jahre verlängert werden.16 RAS-Blockade, SGLT2-Inhibitoren, GLP-1-RA und nichtsteroidale MRA stellen daher die „4 Säulen“ in der Therapie von Diabetes und CKD dar, die speziell bei Patient:innen mit hohem kardiorenalem Risiko eingesetzt werden sollten.16























































































