Management von Neutropenie
Eine Antitumorbehandlung kann sich negativ auf die Anzahl der neutrophilen Blutzellen auswirken. Die febrile Neutropenie und die in diesem Zusammenhang vermehrt auftretenden Infektionen stellen einen bedeutenden Einflussfaktor auf die Morbidität, die Mortalität, den Antibiotikagebrauch und auf Krankenhausaufenthalte dar. Weitere unerwünschte Folgen inkludieren Dosisreduktionen und Verzögerungen, die in schlechteren Behandlungserfolgen resultieren. Während einer Antitumortherapie ist bei ungefähr 1 % der PatientInnen mit dem Auftreten einer febrilen Neutropenie zu rechnen. Bei bis zu einem Drittel der Betroffenen treten Komplikationen auf, die stationär behandelt werden müssen; die Mortalität liegt bei 10 %.1–4
Definiert wird eine febrile Neutropenie als eine oral gemessene Körpertemperatur über 38,3 Grad Celsius, oder zwei aufeinanderfolgende Messungen von über 38 Grad Celsius, die in einem Zeitraum von zwei Stunden erfolgt sind. Gleichzeitig muss eine absolute Neutrophilenzahl (ANC) < 0,5 × 109/l vorliegen beziehungsweise erwartet werden, dass diese unter diesen Wert fallen wird.1, 4
Risikofaktoren können, wie auch bei anderen unerwünschten Nebenwirkungen einer Antitumorbehandlung, in individuelle, krankheitsbedingte und therapieassoziierte Faktoren unterteilt werden (Tab. 1). Laut einem Expertinnen- und Expertenkonsens der Deutschen Krebsgesellschaft, Deutsche Krebshilfe und AWMF (2017) sollten vor jedem Chemotherapiezyklus die patientInnenassoziierten Risikofaktoren erhoben werden, um die Einschätzung des Gesamtrisikos des Auftretens einer febrilen Neutropenie zu ermöglichen.2
Prophylaxe
Granulopoetische Wachstumsfaktoren (G-CSF)
G-CSF gehören zu einer Klasse biologischer Wirkstoffe, die das Wachstum und die Entwicklung der Neutrophilen regulieren. Sie werden eingesetzt, um Komplikationen einer Neutropenie einer myelosuppressiven Therapie zu reduzieren und die Dosisintensität aufrechterhalten zu können. Sie reduzieren den Schweregrad und die Dauer der Neutropenie sowie das Auftreten einer febrilen Neutropenie, einer Infektion, die infektassoziierte Mortalität und die Gesamtsterblichkeit bei Erwachsenen und Kindern.4
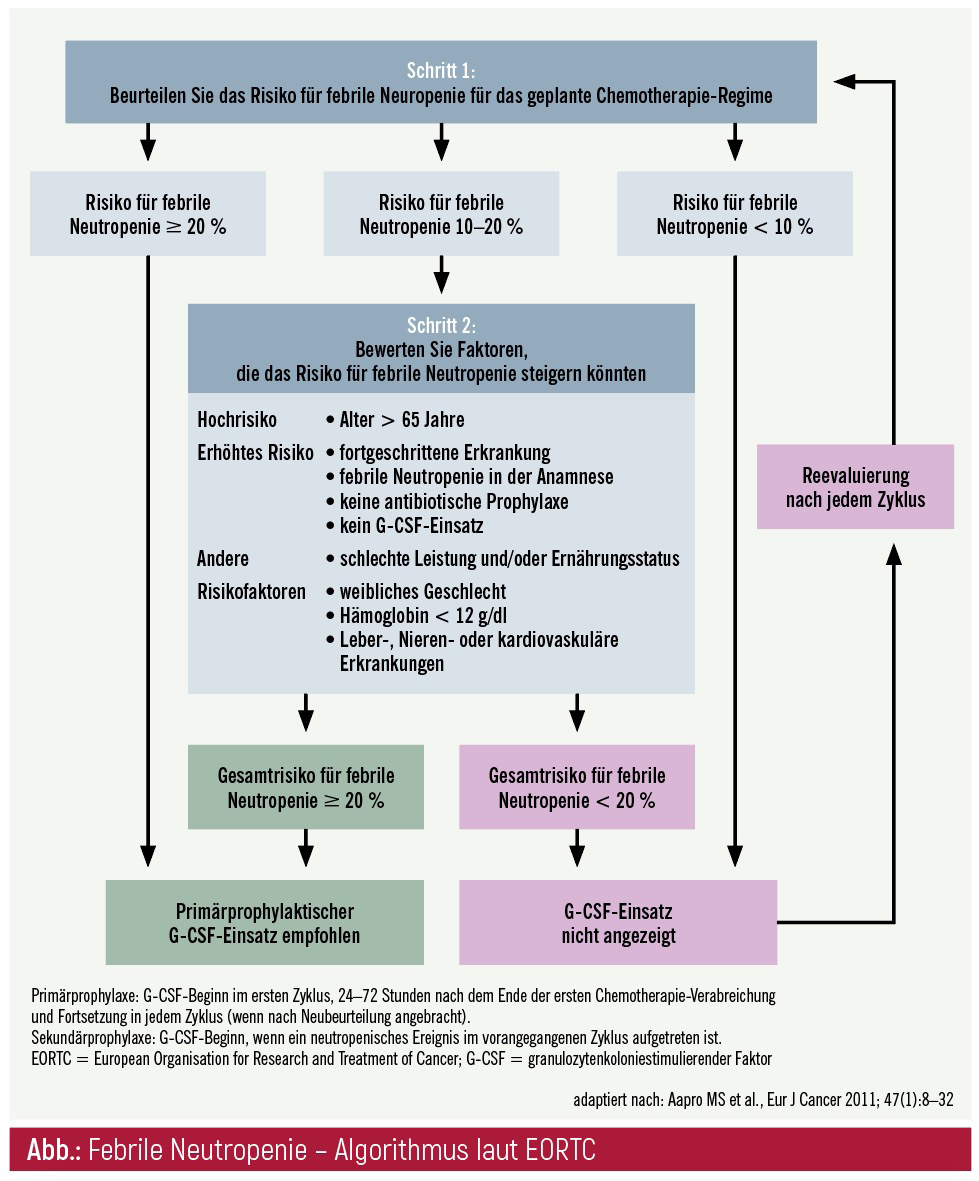
Primärprophylaxe mit G-CSF: NCCN, ASCO, EORTC (Abb.), NCI und ESMO empfehlen einheitlich die Primärprophylaxe mit G-CSF bei Patientinnen und Patienten während einer Antitumortherapie mit einem Risiko eine febrile Neutropenie zu entwickeln von 20 % oder höher. Das Risiko für eine febrile Neutropenie sollte vor jedem Therapiezyklus eingeschätzt werden.3, 4 Die Entscheidung für eine prophylaktische G-CSF-Gabe erfolgt auf Basis der therapiebedingten vorhandenen Risiken und der individuell existierenden Faktoren.2 Bei einem Risiko unter 20 % sollen die individuellen Risikofaktoren in die Entscheidungen miteinfließen.3 Eine Liste zur therapieassoziierten Risikoeinschätzung ist bei der NCCN-Guideline® zu den myeloiden Wachstumsfaktoren zu finden. Nach einer autologen/allogenen Stammzelltransplantation existieren keine einheitlichen Empfehlungen zum Einsatz von G-CSF.4
Nebenwirkungen: Die Verabreichung sollte erst am Tag eins bis vier nach Ende der Chemotherapie erfolgen.3, 4 PatientInnen sollten über potenziell auftretende unerwünschte Wirkungen, mögliche Selbstmanagementstrategien und deren Grenzen informiert und beraten werden. Am häufigsten treten milde bis mittelstarke medulläre Knochenschmerzen auf.
Durch die rasche Zunahme der Leukozyten können subfebrile Temperaturen auftreten. In seltenen Fällen kann es zu einer Milzruptur kommen.5
Weitere Möglichkeiten
Antimikrobielle, antifungale, antivirale und Pneumocystis-jirovecii-Prophylaxen sollten nur noch bei PatientInnen mit hohem Risiko angedacht und diskutiert werden. Jährliche Influenza-Impfungen werden PatientInnen, Angehörigen und allen in den Gesundheitsberufen tätigen Personen empfohlen. Ausgenommen sind PatientInnen, die in den letzten sechs Monaten Anti-B-Zell-Antikörper und eine Induktions-/Konsolidierungstherapie bei einer ALL erhalten haben. Lebendimpfstoffe sollten in der aktiven Therapiephase und bei signifikanter Immunsuppression nicht verabreicht werden. Personen, die im selben Haushalt wie die Patientin/der Patient wohnen, sollten informiert und beraten werden, ihren gesamten Impfstatus zu überprüfen und gegebenenfalls zu aktualisieren.6 Für eine neutropene Diät und eine protektive Isolation konnte kein Nutzen bezüglich einer Reduktion des Auftretens von Infektionen nachgewiesen werden.1, 4, 7
Edukation und Selbstmanagement
Um eine febrile Neutropenie erfolgreich managen zu können, erfordert es ein promptes Erkennen und Reagieren auf eine potenzielle Infektion. Patientenedukation im ambulanten Bereich betreffend Symptome und Zeichen, die Körpertemperatur inkludierend, ist essenziell. Information, zu welchem Zeitpunkt Kontakt zum Behandlungsteam erfolgen soll, muss klar kommuniziert werden. Eine der einfachsten und erfolgreichsten Infektionsprophylaxen stellt das Händewaschen dar – hier sind Pflegepersonen zentral, um dieses Wissen sowie die richtige Technik an die PatientInnen weiterzugeben.8, 9
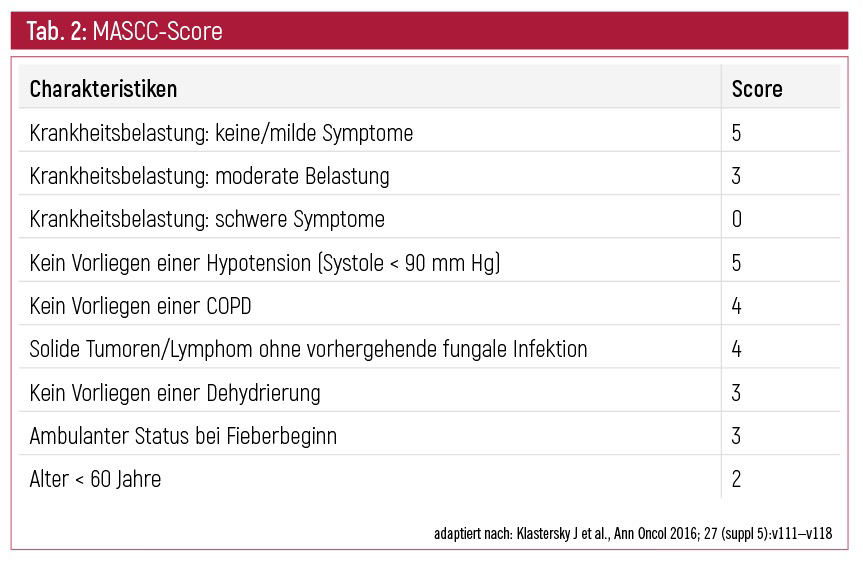
Umfangreiches Assessment notwendig: Zeichen und Symptome einer Infektion bei neutropenen PatientInnen können minimal sein, vor allem während einer Kortikosteroidgabe. Bei Älteren können möglicherweise Verwirrtheitszustände auftreten. Um adäquat intervenieren zu können, soll ein umfassendes Assessment mit Fokussuche erfolgen.1 Risikofaktoren für das Auftreten von Komplikationen bei PatientInnen mit einer bestehenden febrilen Neutropenie sollten mittels eines validierten Einschätzungsinstruments erhoben werden. Geeignet ist hierfür der MASCC-Score (Tab. 2). Wenn ein hohes Risiko für das Auftreten an Komplikationen besteht, wird eine stationäre Aufnahme empfohlen. Im Krankenhaus sollte dann ein engmaschiges Monitoring durchgeführt werden und unverzüglich mit der intravenösen Gabe eines Breitbandantibiotikums begonnen werden; der Beginn sollte idealerweise innerhalb einer Stunde erfolgen.1 PatientInnen mit einem Score ≥ 21 haben ein niedriges Risiko für Komplikationen, die mit einer febrilen Neutropenie assoziiert werden.
Um ein optimales Management durchführen zu können, muss eine umfangreiche Anamnese bezüglich verabreichter Chemotherapie, etwaiger prophylaktisch verabreichter Antibiotika, Steroidgaben, kürzlich erfolgter chirurgische Eingriffe, Allergien erfolgen. Symptome und Zeichen eines Infektionsfokus sollten mittels Fragen und/oder eines körperlichen Assessments erfasst werden. Zusätzlich sollten in jedem Fall die Vitalparameter erhoben werden. Zeichen und Symptome einer Infektion sollten dabei durch die Inspektion invasiver Katheter, eines Assessments des Respirationssystems, des Gastrointestinaltrakts, der Haut, der perianalen Region, dem urogenitalem Ausfluss, der Oropharynx und dem Zentralnervensystem liegen. Vertiefende Untersuchungen umfassen mikrobiologische und bildgebende Verfahren.1
1 Klastersky J et al., Ann Oncol 2016; 27 (suppl 5):v111–v118
2 Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF)
3 Ludwig H, SPECTRUM Onkologie 5/2017 – Sonderdruck „Supportivtherapie bei onkologischen Patienten“, Seiten 2–3
4 Wilson BJ et al., Clin J Oncol Nurs 2018; 22(2):157–68
5 National Comprehensive Cancer Network (NCCN)
6 National Comprehensive Cancer Network (NCCN)
7 Ball S et al., Am J Clin Oncol 2019; 24(3):270–74
8 Van Dalen EC et al., Cochrane Database Syst Rev 2016; 4: Art. No.: CD006247
9 Schlesinger A et al., Lancet Infect Dis 2009; 9(2):97–107