Neue Therapieoptionen bei CED
Morbus Crohn und Colitis ulcerosa sind nach wie vor die beiden wichtigsten Vertreter der chronisch entzündlichen Darmerkrankungen, deren Prävalenz zunimmt. In Nordeuropa und Nordamerika sind derzeit 3,5 Millionen Menschen an CED erkrankt. Seit der Einführung der TNF-α-Blocker vor über 20 Jahren mit Infliximab als deren wichtigstem Vertreter in der CED-Therapie kam 2014 mit Vedolizumab eine neue Substanz der Integrin-Antagonisten auf den Markt, gefolgt vom Januskinasen-(JAK-)Inhibitor Tofacitinib und dem Interleukin-12/23-Antikörper Ustekinumab.
Aufgrund eines unzureichenden Ansprechens oder Therapieversagens im Verlauf der Erkrankung läuft die Forschung nach neuen Wirkstoffen und selektiven Biomarkern für CED auf Hochtouren. Hier ein Überblick, welche Substanzen kurz vor der Zulassung stehen.
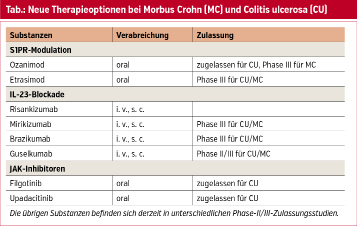
IL-23-Antikörper
Derzeit ist mit Ustekinumab ein Interleukin-Antagonist am Markt, der fixer Bestandteil in der Therapie und Remissionserhaltung bei MC und CU ist. Ustekinumab blockiert die proinflammatorischen Interleukine 12 und 23 und verhindert die Überproliferation und Differenzierung von T-Helferzellen und reduziert somit die Ausschüttung von Zytokinen wie TNF-alpha, IL-17 und IL-22. Es ist allerdings noch nicht geklärt, ob Ustekinumab seine Wirkung durch die Blockade von IL-12 oder IL-23 oder durch die kombinierte Hemmung beider Interleukine erzielt. Durch die selektive Blockade von IL-23 wäre eine verminderte Anfälligkeit für Infektionen durch eine intakte IL-12-vermittelte Immunantwort sowie ein geringeres Malignitätsrisiko denkbar. Mit Risankizumab, Brazikumab, Mirikizumab und Guselkumab befinden sich derzeit mehrere selektive IL-23-Antikörper in klinischer Erprobung für CED.
JAK-Inhibitoren
Bei den JAK-Inhibitoren gibt es mit Tofacitinib einen relativ unspezifischen Januskinase-Inhibitor für Colitis ulcerosa. Tofacitinib inhibiert JAK-1 und JAK-3, die an der Signalweiterleitung von Zytokinen beteiligt sind. Jedoch gibt es hier ein erhöhtes Risiko für Infektionen, Herpes zoster sowie für thromboembolische Ereignisse. Diese thromboembolischen Ereignisse wurden allerdings hauptsächlich in Studien für rheumatoide Arthritis detektiert. Eine kürzlich erschienene Metaanalyse konnte dies für chronisch-entzündliche Darmerkrankungen allerdings nicht zeigen. Eine Weiterentwicklung mit einer spezifischeren Wirkung und selektiver JAK-1-Inhibition sind Filgotinib und Upadacitinib, welche kürzlich für CU zugelassen wurden.
TYK2-Inhibitoren
Einen ähnlichen Wirkmechanismus wie JAK-Inhibitoren, aber noch nicht so weit fortgeschritten in den klinischen Studien, weisen die TYK2-Inhibitoren auf. TYK2-Inhibitoren haben eine spezifischere Wirkweise als JAK-1–3-Inhibitoren und man erhofft sich davon ein geringeres Nebenwirkungsprofil. Genauere Studienergebnisse sind aber noch abzuwarten.
Sphingosine-1-Phosphate-Receptor (S1PR-)Agonisten
Eine weitere neue – bislang nur in der multiplen Sklerose eingesetzte – Klasse sind die Sphingosine-1-Phosphate-Rezeptor- (S1PR-)Agonisten. Diese verhindern den Übertritt von Lymphozyten auf den Lymphknoten ins Blut. Eine Substanz ist Ozanimod, welche seit 2021 zur Behandlung von mittelschweren und schweren Verläufen bei Colitis ulcerosa zugelassen ist (Studie TRUE NORTH). Für die Zulassung bei M. Crohn gibt es aktuell verschiedene Phase-II-Studien. In klinischer Erprobung ist auch Etrasimod; derzeit werden die Ergebnisse der OSASIS-Studie für Colitis ulcerosa und der CULTIVATE-Studie für M. Crohn abgewartet.
Vielzahl an medikamentösen Therapieoptionen
Derzeit wird an einer Vielzahl von neuen Substanzen geforscht, die bessere Behandlungsmöglichkeiten für CED-Patient:innen ermöglichen sollen. Ein wesentlicher Bestandteil dieser Forschungsbemühungen besteht in der Identifikation von spezifischen Biomarkern für CED. Diese spezifischen Biomarker könnten bereits in der allgemein-medizinischen Praxis bestimmt werden. Dadurch könnte der Zeitraum zwischen Diagnose und dem Finden der individuell richtigen Therapieform und Medikation erheblich verkürzt werden.