CLL13-Studie, GAIA
Genetische Risikofaktoren
Kontext: Die randomisierte Phase-III-Studie CLL13, die auch in Österreich erfolgreich rekrutierte, prüfte anhand von 926 Patienten drei zeitlich auf ein Jahr limitierte Venetoclax-basierte Therapiekonzepte (Rituximab-Venetoclax, Obinutuzumab-Venetoclax, Obinutuzumab-Venetoclax-Ibrutinib) gegen den Standardarm FCR/BR (Chemoimmuntherapie) bei fitten Patienten ohne 17p-Alteration. Die co-primären Studienendpunkte waren progressionsfreies Überleben (PFS) und Erreichen einer negativen minimalen Resterkrankung (MRD, <10-4) im Blut mittels Durchflusszytometrie, im Monat 15 gemessen, wobei beide Endpunkte für die Arme mit Obinutuzumab-Venetoclax (+/- Ibrutinib) erreicht werden konnten.
Risikofaktoren: Nun analysierten zwei weitere Abstracts aus dieser klinischen Prüfung molekulare und zytogenetische Risikofaktoren, wobei hier nochmals festgehalten werden muss, dass Patienten mit einer 17p-Alteration nicht in dieser Studie abgebildet waren. Genetische Risikofaktoren, die sowohl bei Chemoimmuntherapie als auch bei den Venetoclax-Armen signifikant diskriminieren, sind NOTCH1-Mutationen und ein unmutierter IgHV-Status (Abb. 1). Zudem dürften BRAF/RAS-Mutationen einen ungünstigen Einfluss auf die Prognose bei Patienten haben, die eine Venetoclax-basierte Therapie erhalten.
Während ein komplexer Karyotyp (≥3 Aberrationen) einen negativen Einfluss auf die Prognose bei Chemoimmuntherapie aufweist, gilt dies bei Venetoclax-basierten Behandlungen erst ab einem hochkomplexen Karyotyp (≥5 Aberrationen) (Abb. 2). Zudem haben sowohl balancierte als auch unbalancierte Translokationen einen negativen prognostischen Einfluss.
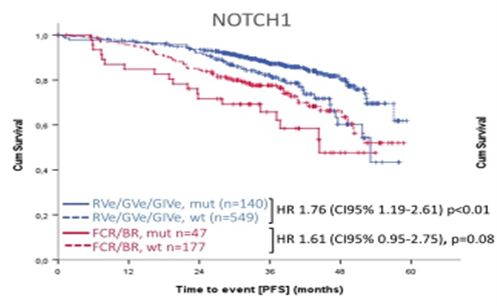
Abb. 1: CLL13-Studie: Prognostische Bedeutung des NOTCH1-Mutationsstatus
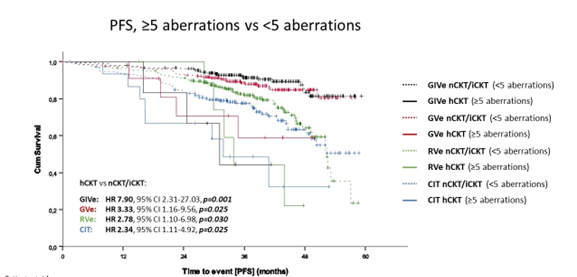
Abb. 2: CLL13-Studie: Prognostische Bedeutung des Karyotyps
Fazit: Auch bei hocheffektiven zielgerichteten CLL-Therapien behalten (zyto)-genetische Hochrisikofaktoren ihre prognostische Bedeutung.





















































































