Albuminurie und Nierenfunktion
Da eine Nephropathie die Prognose von Diabetikern massiv verschlechtert und die Therapie beeinflusst, betonen klinische Leitlinien den Wert einer möglichst frühzeitigen Diagnosestellung. So wird z.B. empfohlen, bei Typ-2-Diabetes zum Zeitpunkt der Diagnosestellung, bei Typ-1-Diabetes spätestens 5 Jahre danach mit einem regelmäßigen Screening nach Mikroalbuminurie (MIA) zu beginnen.
Das Verhalten der Albuminurie wird aber auch herangezogen, um die Effizienz einer therapeutischen Intervention zu evaluieren. Bis eine “klassische” diabetische Nephropathie zur terminalen Niereninsuffizienz führt, vergehen viele Jahre; Primärpräventions- und Interventionsstudien in frühen Stadien haben meist eine wesentlich kürzere Beobachtungszeit. Wenn man nun aber postuliert, dass eine Nephropathie bei Diabetikern immer dem klassischen Schema Hyperfiltration >> Mikroalbuminurie >> Albuminurie >> Abfall der glomerulärer Filtrationsrate (GFR) >> terminale Niereninsuffizienz folgt, kann man auch davon ausgehen, dass eine Therapie, die z.B. das Auftreten einer MIA verhindert, längerfristig die GFR stabilisiert. Andererseits können Interventionen, welche die Albuminurie nicht beeinflussen oder diese sogar verstärken, rasch als potenziell nephrotoxisch erkannt werden, selbst wenn sie die GFR nicht unmittelbar verändern. Somit hat das Paradigma des uniformen Verlaufs der Nephropathie bei Diabetes den klinischen Alltag deutlich erleichtert. Trotzdem muss man einige Fragen stellen:
- Leiden tatsächlich alle Patienten mit Diabetes mellitus und einer reduzierten Nierenfunktion an einer klassischen diabetischen Nephropathie?
- Wenn dies nicht der Fall ist: bleibt die Albuminurie trotzdem ein geeigneter Surrogatparameter für die Einschätzung des individuellen Risiko und der Effizienz einer Therapie?
- Gibt es Situationen, in denen (alleine oder zusätzlich) andere Parameter (wie z.B. die GFR) a priori mit berücksichtigt werden müssen?
Diabetes mellitus Typ 1
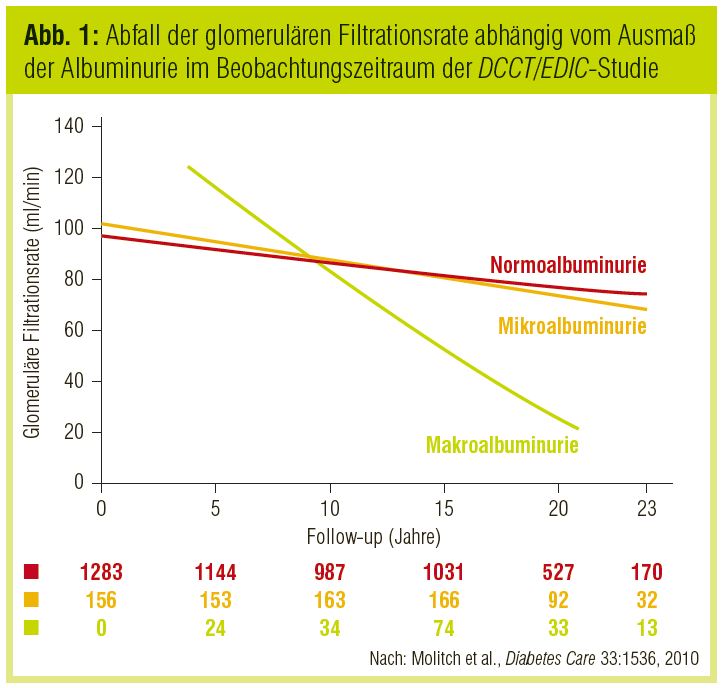
Im Diabetes Control and Complications Trial (DCCT) wurden Patienten ohne Retinopathie und einer Albuminurie unter 40 mg/Tag und solche mit einer Albuminurie unter 200 mg/Tag und mindestens einem Mikroaneurysma der Retina (aber ohne proliferativer Retinopathie) eingeschlossen. Nach Abschluss der randomisierten Therapiephase nahmen 1.375 der 1.441 Patienten an der offenen EDIC-Kohortenstudie (Epidemiology of Diabetes Interventions and Complications) teil, während der sich die HbA1c-Werte zwischen beiden Therapiearmen der DCCT anglichen. Innerhalb von 20 Jahren Beobachtungszeit fiel die eGFR bei 6% der Patienten unter 60 ml/min/1,73 m2 (CKD-Stadium 3) ab; 24% davon waren davor immer normoalbuminurisch, 16% mikro- und 61% makroalbuminurisch. Der jährliche Abfall der eGFR war im Stadium der Makroalbuminurie aber signifikant höher (Molitch et al., Diabetes Care 2010; Abb. 1). In einer anderen Untersuchung fiel die eGFR bei 7% der Patienten unter 60 ml/min/1,73 m2 ab, ohne dass davor eine Albuminurie beobachtet wurde. Allerdings waren alle Patienten, die innerhalb der 16-jährigen Beobachtungszeit ein terminales Nierenversagen entwickelten, vorher albuminurisch (Costacou et al., Am J Kidney Dis 2007). Bei derart langen Beobachtungszeiten stellt sich auch die Frage, ob nicht alleine durch einen altersbedingten Abfall der eGFR einige Patienten das CKD-Stadium 3 erreichen. Perkins et al. (J Am Soc Nephrol 2007) ermittelten mittels Cystatin-CMessungen die Nierenfunktion bei Gesunden und bei Typ-1-Diabetikern: Bei 2,5% der gesunden Probanden fiel die GFR (wahrscheinlich altersbedingt) um mehr als 3,3% pro Jahr, bei Diabetikern mit Normoalbuminurie, Mikroalbuminurie und Makroalbuminurie waren es 9%, 32% und 67%.
In Summe zeigen diese Arbeiten, dass der überwiegende Teil der Typ-1-Diabetiker vor dem Abfall der eGFR unter 60 ml/min/1,73 m2 albuminurisch wird und der Verlauf der Nierenerkrankung daher dem klassischen Konzept der diabetischen Nephropathie entspricht. Ein wesentlich geringerer Prozentsatz der Patienten erreicht das CKD-Stadium 3 ohne vorhergehende Proteinurie. Man hat zwar den Eindruck, dass bei diesen Patienten die GFR etwas rascher abfällt als bei Nichtdiabetikern, ob dies jedoch zum terminalen Nierenversagen führt, ist unklar. Im Einklang mit diesen Daten steht auch, dass der positive Effekt der intensivierten Blutzuckerkontrolle auf die GFR verschwindet, wenn man statistisch den gleichzeitig beobachteten antialbuminurischen Effekt der Intervention berücksichtigt (DCCT/EDIC Research Group, N Engl J Med 2011).
Diabetes mellitus Typ 2
In der United Kingdom Prospective Diabetes Study (UKPDS) entwickelten 38% der Teilnehmer innerhalb von 15 Jahren eine Mikro- oder Makroalbuminurie. Bei 28% sank die (nach Cockcroft und Gault geschätzte) Kreatinin-Clearance unter 60 ml/min, wobei nur 51% dieser Patienten vorher eine Albuminurie hatten (Retnakaran et al., Diabetes 2006). Auch in der NHANESIII-Erhebung hatten nur 45% der Diabetiker mit einer GFR unter 60 ml/min/1,73 m2 eine Mikro- oder Makroalbuminurie (Kramer et al., JAMA 2003); in einer Studie von Thomas et al. (Diabetes Care 2009) waren es 55%, in einer japanischen Untersuchung 262 von 506 Patienten (Yokohama et al., Nephrol Dial Transplant 2009).
Nicht ganz überraschend ist daher auch, dass bei Typ-2-Diabetikern eine Albuminurie und eine reduzierte eGFR unabhängige Risikofaktoren für kardiovaskuläre, aber auch renale Endpunkte sind (Ninomiya et al., J Am Soc Nephrol 2009; Abb. 2). In der ACCORD-Studie entwickelten von 2.894 normoalbuminurischen Patienten 429 eine Mikro- und 44 eine Makroalbuminurie. Bei 33 Patienten stieg das Serum-Kreatinin über 3mg% an oder es trat eine Dialysepflichtigkeit ein, ohne dass jemals eine erhöhte Albuminurie beobachtet wurde dies war nur bei 3 Patienten mit Albuminurie-Anamnese der Fall. Diese Studie zeigt, dass im Gegensatz zum Typ-1-Diabetes bei Typ-2-Diabetes ein Verlust an GFR bei Normoalbumin urie auch zu schweren Nierenerkrankungen führt und der Abfall der GFR bei dieser Form der Nephropathie sogar rascher erfolgt als bei klassischer diabetischer Nephropathie (Ismail-Beigi et al., Kidney Int 2011 [Epub ahead of print]).
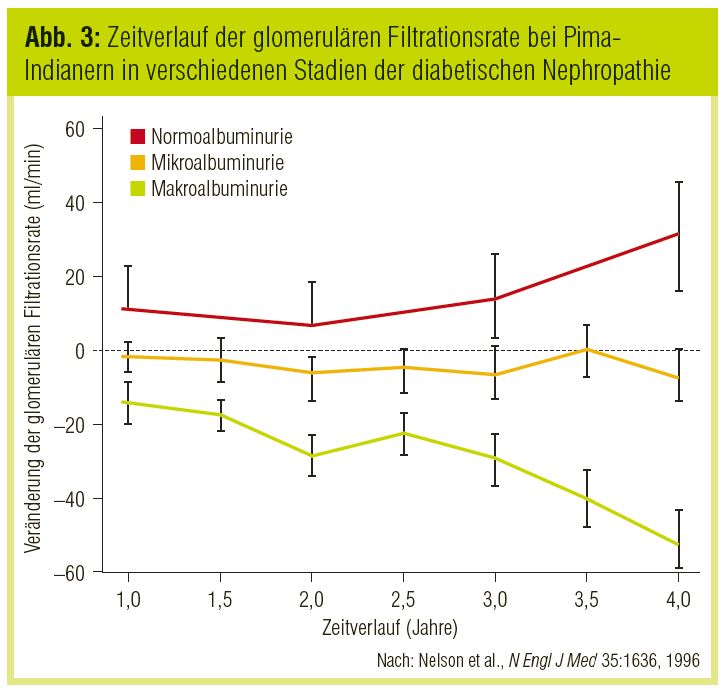
All diese Daten stehen offenbar im Widerspruch zu jenen bei Pima-Indianern, bei denen die GFR erhöht bleibt, solange keine Makroalbuminurie auftritt (Nelson et al., N Engl J Med 1996; Abb. 3). Dafür gibt es zumindest zwei Erklärungsmöglichkeiten:
Einerseits ist bekannt, dass bei Weitem nicht alle, sondern wahrscheinlich nur 3050% der Patienten mit Typ-2-Diabetes und einer eingeschränkten Nierenfunktion histologisch Zeichen einer diabetischen Nephropathie aufweisen (Mazzucco et al., Am J Kidney Dis 2002). Wenn man diese Erklärung heranzieht, muss man auch akzeptieren, dass der Wert von Therapieschemata und Surrogatendpunkten, die bei klassischer diabetischer Nephropathie akzeptiert sind, bei mehr als der Hälfte der Typ-2-Diabetiker mit Nephropathie unklar ist.
Eine andere Möglichkeit wäre, dass moderne, kombinierte und intensivierte Therapieverfahren den klassischen Verlauf der diabetischen Nephropathie verändern. Gegen diese Theorie spricht, dass in der STENO-II-Studie eine aggressive multifaktorielle Therapie bei mikroalbuminurischen Typ-2-Diabetikern zwar das Risiko einer Nephropathie um 61% reduzier
te, wenn man diese nach den klassischen Kriterien als Inzidenz einer Makroalbuminurie definiert. Der doch deutliche Abfall der GFR um 30 ml/min während der Beobachtungszeit wird aber nicht beeinflusst (Gaede et al., N Engl J Med 2003).