Antithrombotische Therapie bei peripherer arterieller Verschlusskrankheit
Von 100 Patienten mit diagnostizierter peripherer arterieller Verschlusskrankheit (PAVK) versterben innerhalb von fünf Jahren 30 Patienten (15 koronar, 5 an anderen vaskulären Ursachen, 10 nichtvaskulär). Zusätzlich erleiden 10 bis 20 Patienten einen nichttödlichen Myokardinfarkt oder apoplektischen Insult. 25 Patienten erleiden eine lokale Progression an den Gefäßen der unteren Extremitäten, von diesen müssen 10 revaskularisiert werden, 2 müssen ausgedehnt amputiert werden. Die antithrombotische Therapie hat daher gemeinsam mit der antidiabetischen, der lipidsenkenden und der antihypertensiven Therapie die Aufgabe, das allgemeine kardiovaskuläre Risiko als auch die lokale Progression zu reduzieren.
Im Weiteren werden die neuesten verfügbaren Richtlinien und deren Empfehlungen beschrieben und kommentiert:
• European Society of Cardiology (ESC): Guidelines on the diagnosis and treatment of peripheral artery diseases (Task Force on the Diagnosis and Treatment of Peripheral Artery Diseases. Eur Heart J 2011)
• Antithrombotic Therapy in Peripheral Artery Disease. American College of Chest Physicians (ACCP) EvidenceBased Clinical Practice Guidelines, 9th ed. (Chest 2012)
Die Tabellen 1 und 2 beschreiben die nachfolgend im Text angegebenen Rekommendationsgrade. Die Empfehlungen werden für asymptomatische und symptomatische PAVK sowie für Interventionen bei PAVK strukturiert. 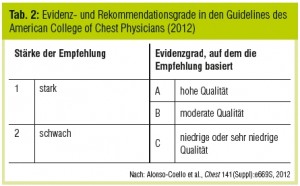
Asymptomatische PAVK
Dieses Patientenkollektiv ist wichtig, da in allen Alterstufen asymptomatische Patienten überwiegen. Während in den ESC-Guidelines keine Empfehlung zu finden ist, geben die
ACCP-Guidelines eine Grad-2/B-Empfehlung für die Verwendung von Azetylsalizylsäure (ASS) in einer Dosierung von 75–100 mg bei asymptomatischer PAVK.
Die entscheidende und durchaus schwierig zu beantwortende Frage ist, ob man die Thrombozytenfunktionshemmung bei diesen Patienten als Primärprävention betrachtet. Eine – in den neuen Empfehlungen nicht berücksichtigte – rezent publizierte Metaanalyse mit Daten von über 100.000 Studienteilnehmern, die durchschnittlich 6 Jahre lang ASS nahmen, zeigte eine Reduktion der kardiovaskulären Ereignisse (hauptsächlich der nichttödlichen Myokardinfarkte) um 10 %. Das Risiko, eine klinisch relevante Blutung zu erleiden, stieg aber um 30 %. Die Autoren geben eine Number needed to treat (NNT) von 120 und eine Number needed to harm (NNH) von 73 an (Seshasai et al., Arch Intern Med
2012; Abb. 3 auf Seite 29). Es gibt aber auch Argumente, „Patienten“ mit asymptomatischer PAVK als ein Kollektiv mit hohem kardiovaskulärem Risiko zu betrachten, das von einer antithrombotischen Therapie profitieren könnte. So zeigte eine Metaanalyse der Ankle Brachial Index Collaboration (JAMA 2008), dass ein DopplerIndex (DI) kleiner als 0,9 das Risiko für kardiovaskuläre Ereignisse verdoppelt. Das heißt, wenn man z. B. einen Framingham-Risiko-Score verwendet, wird aus einem Patienten mit moderatem Risiko +DI < 0,9 (ohne Claudicatio-Symptomatik) ein Hochrisikopatient.
Leider gibt es auch bezüglich der Reduktion von Tumorfällen unterschiedliche Daten. Von Rothwell et al. (Lancet 2011) wurde eine Metaanalyse publiziert, die eine Reduktion von
Tumortodesfällen abhängig von der Dauer der ASS-Therapie zeigte, weiters ganz rezent vom gleichen Autor (Lancet 2012) eine Analyse, die einen präventiven Effekt von ASS auf die Metastasierung beschreibt.
Positive Effekte bezüglich Malignomen konnten in der in der oben zitierten Metaanalyse von Seshasai et al. (Arch Intern Med 2012) nicht nachgewiesen werden. Die relative Risikoreduktion bezüglich malignombedingten Todesfällen war nicht signifikant, der tumorprotektive Effekt von ASS wird als fraglich bezeichnet.
Publizierte Guidelines und vorhandene Evidenz ersparen somit nicht die individuelle patientenspezifische Entscheidung, ob bei asymptomatischer PAVK ASS gegeben werden soll oder nicht.
Symptomatische PAVK
Hier sind die Empfehlungen eindeutiger. Die ESC-Guidelines geben eine Grad-I/ C-Empfehlung für Thrombozytenfunktionshemmer. Das heißt, die Gabe ist indiziert auf Basis eines Expertenkonsensus (und nur weniger Studien).
Die ACCP-Guidelines schätzen die Evidenz optimistischer ein und geben eine 1/A-Empfehlung, das heißt, der Benefit überwiegt die Risken deutlich, die Evidenz wird als von hoher Qualität beschrieben. Basis dieser Überlegung ist, dass auf Patienten mit PAVK die gleiche relative Risikoreduktion zutrifft wie auf Patienten mit Myokardinfarkt oder Schlaganfall. Eine Metaanalyse der Antithrombotic Trialists’ Collaboration (ATT Collaboration, Lancet 2009) beinhaltet 16 Studien und 17.000 Patienten mit Sekundärprävention, darunter sechs Studien mit Patienten mit Myokardinfarkt und zehn
Studien nach transitorischer ischämischer Attacke (TIA) oder Apoplexie. ASS führte zu einer signifikanten Reduzierung von weiteren vaskulären Ereignissen (6,7 % vs. 8,2 %/
Jahr; p < 0,0001). Es zeigte sich ein nichtsignifikanter Anstieg von hämorrhagischen Insulten bei Reduktion der Gesamtschlaganfälle um ein Fünftel.
Für PAVK-Patienten gibt es Subgruppenanalysen aus den ATT-Daten: Aus 42 Studien wurden 9.706 Patienten analysiert und es fand sich eine 23%ige relative Risikoreduktion.
Niedrig dosiertes Aspirin (75–100 mg ) war zumindest genauso effektiv wie höhere Dosen (ATT Collaboration, BMJ 2002; Abb. 1).
 Aber auch hier finden sich Gegenargumente in Form von anderen Metaanalysen. Von Berger et al. (JAMA 2009) wurden 5.269 Patienten mit PAVK analysiert. Das Ergebnis war
Aber auch hier finden sich Gegenargumente in Form von anderen Metaanalysen. Von Berger et al. (JAMA 2009) wurden 5.269 Patienten mit PAVK analysiert. Das Ergebnis war
enttäuschend, die Behandlung mit ASS (mit oder ohne Dipyridamol) zeigte für den primären Endpunkt der kardiovaskulären Ereignisse keinen statistisch signifikanten Effekt.
Einzig und allein nichtfatale Apoplexien konnten statistisch positiv beeinflusst werden. Das Problem, dass Metaanalysen, stark abhängig von den inkludierten Studien, unterschiedliche Ergebnisse liefern, ist leider nicht lösbar. Darum gibt es ja Guidelines, um für den praktischen Alltag Lösungen und Empfehlungen anzubieten.
Weiters erhebt sich die Frage, ob andere Substanzen außer ASS wirksam sind und welchen Stellenwert Kombinationstherapien haben:
In den ACCP-Guidelines, die die antithrombotische Therapie ausführlicher behandeln als die ESC-Guidelines (diese geben dafür Empfehlungen von der Diagnostik bis zur Art der Intervention bei PAVK-Patienten), wird eine gleichwertige Empfehlung (1/A) für Clopidogrel in einer Dosis von 75 mg gegeben.
Die CAPRIE-Studie (CAPRIE Steering Committee, Lancet 1996) ist die einzige Studie, die ASS und Clopidogrel verglichen hat. In der prädefinierten Subgruppe der Patienten mit
PAVK zeigte sich, dass Clopidogrel effektiver war als ASS, um den kombinierten Endpunkt (Myokardinfarkt, Schlaganfall oder vaskulärer Tod) zu verhindern; die relative Risikoreduktion betrug 23,8 %. Die Gruppe der Patienten mit PAVK war sozusagen für das statistisch grenzwertig signifikante Ergebnis des Gesamtkollektives verantwortlich. In der Clopidogrel-Gruppe waren auch weniger Blutungen zu beobachten.
Eine ausdrückliche Empfehlung gegen Kombinationstherapien findet sich im ACCP-Dokument. Dies gilt sowohl für die duale Thrombozytenfunktionshemmung als auch für die Kombination mit oralen Antikoagulantien (OAK).
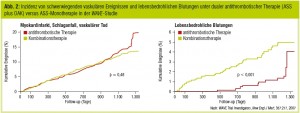
In der CHARISMA-Studie (Bhatt et al., New Engl J Med 2006) war die Kombination von ASS und Clopidogrel bezüglich der Reduktion von kardiovaskulären Endpunkten nicht signifikant effektiver als ASS alleine. Ähnliche Ergebnisse finden sich für die Kombination von ASS und OAK. Die WAVE-Studie verglich ASS und OAK vs. ASS alleine (WAVE Trial Investigators, New Engl J Med 2007; Abb. 2). Die Kombinationstherapie zeigte keinen Benefit für kardiovaskulären Tod, Myokardinfarkt oder Schlaganfall, hatte aber eine fast vierfach höhere Rate an schweren (inklusive zerebralen) Blutungen. Die Frage ist somit geklärt: Zur Progressionsprophylaxe der Atherosklerose bei PAVK sind Kombinationstherapien nicht geeignet.
Offen bleibt die Frage wie man umgeht, wenn ein Patient mit PAVK eine zusätzliche Indikation zur oralen Antikoagulation hat, wie z. B. eine akute venöse Thromboembolie oder Vorhofflimmern. Diese Frage muss patientenspezifisch entschieden werden, in den meisten Fällen wird im klinischen Alltag die orale Antikoagulation Vorrang vor der thrombozytenfunktionshemmenden Therapie haben.
Antithrombotische Therapie nach Intervention
Hier hat die antithrombotische Therapie eine zweifache Aufgabe: Das allgemeine kardiovaskuläre Risiko zu senken und die Offenheitsraten und die Offenheitsdauer der Rekonstruktion zu optimieren. In einem 2011 publizierten Cochrane-Review wurden 16 Studien mit Patienten nach infrainguinaler Gefäßoperation metaanalysiert. Die primäre Offenheitsrate nach 1 Jahr war unter ASS (± Dipyridamol) signifikant besser. Eine Subgruppenanalyse zeigte, dass Patienten mit einer Kunststoffprothese von Thrombozytenfunktionshemmern mehr profitierten als Patienten mit einem Venenbypass (diese profitierten von OAK). Interessanterweise konnte in diesen Kollektiven von Patienten mit weit fortgeschrittener Atheroskerose eine allgemeine kardiovaskuläre Protektion nicht gezeigt werden (Brown et al., Cochrane Database Syst Rev 2011). Dass Kunststoff und Venenbypässe höchstwahrscheinlich eine unterschiedliche Rezidivprophylaxe benötigen, wurde auch in der prospektiven BOA-Studi (Lancet 2000), die Patienten nach Bypassoperationen in 2 Gruppen (ASS oder OAK) randomisierte, gezeigt. Auch hier zeigte eine Subgruppenanalyse, dass Kunststoffbypässe von ASS, Venenbypässe von OAK profitieren. Der Nachteil der oralen Antikoagulation ist allerdings eine erhöhte Blutungsneigung.
Die Kombination von ASS und OAK zeigt in den vorhandenen Studien keine einheitlichen Ergebnisse. Die Kombination von ASS und Clopidogrel vs. ASS alleine wurde in der CASPAR-Studie bei Bypässen mit Anschluss unterhalb des Kniegelenkes getestet (Belch et al., J Vasc Surg 2010). Eine Subgruppenanalyse zeigte einen positiven Effekt nur in Fällen mit Kunststoffbypässen.
Zusammenfassend geben die ESC-Guidelines eine I/A-Empfehlung für ASS nach infrainguinalem Bypass und jeweils eine II/B-Empfehlung für orale Antikoagulation nach infrainguinalem Venenbypass und für ASS und Clopidogrel bei Kunststoffbypässen unterhalb des Knies.
Nach Katheterinterventionen wird ASS alleine empfohlen (I/C-Empfehlung), eine duale Thrombozytenfunktionshemmung nach Stentimplantation für mindestens einen Monat (I/C-Empfehlung). Hier findet sich eine Diskrepanz zu den aktuellen ACCP-Guidelines. Diese empfehlen nach Stent-PTA ASS oder Clopidogrel als Monotherapie (1/A-Empfehlung) und sprechen sich prinzipiell gegen eine duale Thrombozytenfunktionshemmung aus. ACCP akzeptiert die Übertragung von Daten aus der koronaren Strombahn in die Peripherie nicht. Die Argumente dafür sind die verschiedenen Durchmesser der Gefäße, verschiedene Stenttypen und die weniger dramatische Konsequenz eines Stentverschlusses in der Peripherie, die das erhöhte Blutungsrisiko nicht lohnt. Einzige Ausnahme ist auch hier der Kunststoffbypass unterhalb des Knies (2/C-Empfehlung für ASS und Clopidogrel für ein Jahr).
Offene Fragen
ASS-/Clopidogrel-Resistenz: Es gibt keine einheitliche Definition der „Aspirinresistenz“, es wird daher empfohlen, den Begriff durch „Therapieversagen unter Thrombozytenfunktionshemmung“ zu ersetzen (Berent & Sinzinger, Vasa 2011). Es stehen auch keine evidenzbasierten Tests zur Verfügung, die geeignet wären, Therapiekonsequenzen zu überlegen. Obwohl einige Studien zeigen konnten, dass eine Erhöhung der ASS-Dosis auf 300–500 mg auch bei Nonrespondern zu einer ausreichenden Plättenfunktionshemmung führt, zeigen alle großen Metaanalysen, dass niedrig dosiertes ASS (75–100 mg) zumindest genauso gut wirkt wie höhere Dosen. Das heißt, man erreicht mit hohen Dosen keine besseren klinischen Ergebnisse.
Genauso ungeklärt ist die Frage der Clopidogrel-Resistenz, die nicht in allen Fällen durch eine höhere Dosis aufgehoben werden kann. Hier wird immer wieder, aber höchst unterschiedlich in der Literatur diskutiert, ob dies im Zusammenhang mit der Einnahme von Protonenpumpenhemmern steht.
Neue Antithrombotika: Neue Antithrombotika wie Prasugrel und Ticagrelor werden bereits in kardiologischen Indikationen eingesetzt und zeigen in manchen Aspekten eine klinisch relevante bessere Thrombozytenfunktionshemmung (siehe Beitrag ab Seite 34). Für die periphere Strombahn gibt es derzeit noch keine Ergebnisse.
Thrombozytenfunktionshemmung bei Diabetes: Die Österreichische Diabetes Gesellschaft schreibt in ihren Guidelines (Wascher, Wien Klin Wochenschr 2009), dass jeder Diabetiker ab dem 40. Lebensjahr oder Diabetiker mit zumindest einem weiteren kardiovaskulären Risikofaktor mit Thrombozytenfunktionshemmern behandelt werden sollte. Es wird eine Dosis von 50–200 mg ASS empfohlen. Clopidogrel wird als First-Line-Therapie nur bei ASS-Kontraindikation oder Unverträglichkeit oder bei Auftreten eines Rezidivs unter ASS empfohlen.
In den Praxisempfehlungen der Deutschen Diabetes Gesellschaft (Diabetol Stoffw 2011) wird unter präventiven/therapeutischen Maßnahmen ebenfalls die Gabe eines Thrombozytenfunktionshemmers empfohlen.
Im Gegensatz zu diesen Empfehlungen stehen die im Jahre 2008 publizierten Ergebnisse der POPADAD-Studie (Belch et al., BMJ 2008): In diese Studie wurden 1.276 Typ-1- und Typ-2-Diabetiker mit einem DI von < 0,99 und keiner symptomatischen kardiovaskulären Erkrankung eingeschlossen. Die Ergebnisse zeigten keinen Effekt für die Verwendung
von ASS in der Primärprävention bei Diabetes und asymptomatischer PAVK.
Die diabetologischen Fachgesellschaften werden sicherlich die, in diesen Artikeln dargestellten Ergebnisse in ihren nächsten Richtlinien kommentieren bzw. umsetzen. Es geht in erster Linie um die Frage, welchen Stellenwert Clopidogrel in der Primärtherapie hat, und um die Frage der Primärprävention.
Resümee
• ESCGuidelines (2011) und ACCPGuidelines (2012) geben nicht immer übereinstimmende Empfehlungen für antithrombotische Therapien bei Patienten mit PAVK.
• Bei asymptomatischen Patienten sollte die Entscheidung patientenspezifisch, abhängig von der Gesamtrisikosituation erfolgen. Es ist nicht komplett geklärt, ob die Behandlung
einer asymptomatischen PAVK einer Primärprävention gleichzusetzen ist.
• Patienten mit symptomatischer PAVK erhalten niedrig dosiertes ASS oder Clopidogrel zur allgemeinen kardiovaskulären Prävention in Analogie zu Daten von Kollektiven
mit koronarer Herzkrankheit oder zerebraler arterieller Verschlusskrankheit.
• Eine duale Thrombozytenfunktionshemmung ist auch nach gefäßchirurgischen oder Katheterinterventionen nur in speziellen Fällen notwendig. Dies gilt für die Stent-PTA
und den Kunststoffbypass unterhalb des Knies. In anderen Fällen reicht ASS als Monotherapie. Für Patienten nach infrainguinalem Venenbypass dürfte die orale Antikoagulation Vorteile bieten.






















































































