Blutglukosesenkung bei Typ-2-Diabetes – Kann die kardiovaskuläre Prognose verbessert werden?
Typ-2-Diabetes mellitus gilt als unabhängiger Risikofaktor für kardiovaskuläre Ereignisse wie koronare Herzkrankheit, Schlaganfall, periphere arterielle Verschlusskrankheit und Herzinsuffizienz (zwei- bis vierfach höheres Risiko als bei Nichtdiabetikern). Kardiovaskuläre Komplikationen sind die Haupttodesursachen bei Typ-2-Diabetes.
Der Zusammenhang zwischen verbesserter glykämischer Kontrolle und Reduktion mikrovaskulärer Spätschäden ist gut belegt (z. B. UKPDS Group, Lancet 1998). Aufgrund der Ergebnisse großer Interventionsstudien bei Typ-2-Diabetikern mit langer Diabetesdauer und kardiovaskulärem Hochrisikoprofil (VADT, ACCORD, ADVANCE) wird hingegen die Frage, inwieweit die kardiovaskuläre Prognose bei wirklich allen Patienten durch eine besonders strikte glykämische Kontrolle tatsächlich verbessert werden kann, etwas kontroverser diskutiert (Yudkin et al., Lancet 2011).
Bei dem Versuch, diese Frage durch eine Synopsis der großen Studien klar zu beantworten, stößt man auf ein Problem, das eigentlich auch die klinische Realität abbildet: Allen Typ-2-Diabetikern gemeinsam sind die Erhöhung des Blutzuckers und noch einige andere klinische Merkmale des metabolischen Syndroms, aber ansonsten sind „die Typ-2-Diabetiker“ ein sehr heterogenes Patientenkollektiv, und ebenso heterogen sind daher auch die verschiedenen Studien, die versuchen, diese Frage zu beantworten, und deren jeweiligen Schlussfolgerungen. Was für den jüngeren, neu manifestierten Diabetiker essenziell ist, um das kardiovaskuläre Risiko zu vermindern (UKPDS), kann für einen älteren Patienten mit langer Diabetesdauer und makrovaskulären Spätschäden weniger Nutzen bringen (VADT, ACCORD, ADVANCE). Dazu kommt, dass es mittlerweile ein „Potpourri“ an blutglukosesenkenden Medikamenten gibt, deren Wirkmechanismen unterschiedlich und deren Effekte oft pleiotrop sind, was die isolierte Betrachtung der Blutzuckersenkung als Einflussfaktor für das kardiovaskuläre Risiko erschwert.
Bestmögliche glykämische Kontrolle von Anfang an
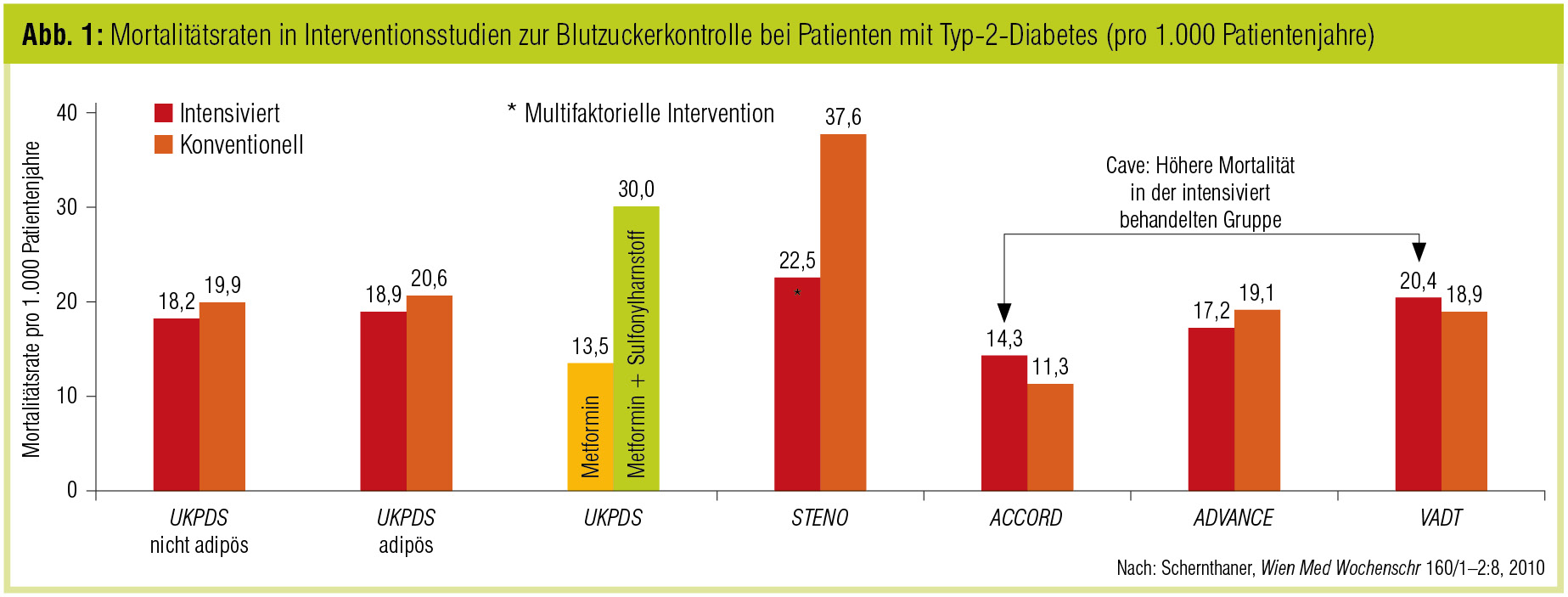
Die United Kingdom Prospective Diabetes Study (UKPDS) und deren Nachbeobachtungsstudie war lange die weitaus größte Interventionsstudie, die sich mit der Frage befasste, ob eine – durch eine intensivierte Diabetestherapie – verbesserte Glykämie die mikro- und makrovaskulären Komplikationen reduzieren kann. Die 10 Jahre laufende Interventionsstudie verglich bei Patienten mit neu manifestem Diabetes mellitus eine intensivierte blutzuckersenkende Therapie (mit Sulfonylharnstoff, Insulin oder Metformin) mit konventioneller Therapie (Diät). Die Patienten, die eine intensivierte Diabetestherapie erhielten, hatten ein um 0,9 Prozentpunkte niedrigeres HbA1c und ein deutlich niedrigeres Risiko für mikrovaskuläre Komplikationen, die Ergebnisse für die makrovaskuläre Komplikation Herzinfarkt waren jedoch knapp nicht signifikant (UKPDS 33; UKPDS Study Group, Lancet 1998). In der Subgruppe der adipösen Patienten, die Metformin erhielten, zeigte sich jedoch eine signifikante Reduktion der kardiovaskulären Endpunkte und der Mortalität (UKPDS 34; UKPDS Study Group, Lancet 1998; Abb. 1).
Gibt es ein metabolisches Gedächtnis?
In der 10-jährigen Nachbeobachtung der an der UKPDS teilnehmenden Patienten kristallisierte sich heraus, dass es so etwas wie ein „metabolisches Gedächtnis“ des Gefäßsystems geben dürfte, denn das makrovaskuläre Risiko derjenigen, die von Anfang an eine intensivere Therapie zur Verbesserung der Glykämie erhielten, war auch Jahre später noch geringer als jenes der Patienten, die zu Beginn ihrer Erkrankung weniger strikt („konventionell“) eingestellt gewesen waren. Die Patienten aus der damaligen Sulfonylharnstoff-Insulin-Gruppe hatten weiterhin ein signifikant geringeres relatives Risiko für diabetesassoziierte Endpunkte, mikrovaskuläre Komplikationen und zusätzlich eine niedrigere Inzidenz von Herzinfarkten und eine geringere Mortalität. In der Metformin-Gruppe war die Risikoreduktion für Herzinfarkt, diabetesassoziierte Endpunkte und Mortalität noch deutlicher ausgeprägt (Holman et al., New Engl J Med 2008; Tab.).
Für die therapeutische Praxis bedeuten die Ergebnisse der UKPDS, dass bei Typ-2-Diabetes bereits bei Diagnosestellung eine so optimal wie mögliche glykämische Kontrolle erzielt werden sollte, um sowohl mikro- als auch makrovaskuläre Spätschäden zu vermeiden.
Glukosesenkung bei längerer Diabetesdauer und makrovaskulärer Erkrankung
Die Action in Diabetes and Vascular Disease (ADVANCE) Study, die Action to Control Cardiovascular Disease in Diabetes (ACCORD) Study und der Veterans Affairs Diabetes Trial (VADT) konnten keinen Zusammenhang zwischen verbesserter glykämischer Kontrolle und der Reduktion makrovaskulärer Komplikationen zeigen – in der ACCORD-Studie war die Mortalität im intensivierten Studienarm sogar erhöht (ACCORD Study Group, New Engl J Med 2008; Abb. 1, 2). Im Unterschied zur UKPDS, die ausschließlich neu diagnostizierte Typ-2-Diabetiker ohne kardiovaskuläre Vorerkrankung untersuchte, lag die mittlere Diabetesdauer in ADVANCE, ACCORD und VADT zwischen 8 und 11,5 Jahren, und der Anteil an Patienten mit kardiovaskulären Erkrankungen betrug zu Studienbeginn zwischen 32 % und 40 %. Auch war die glykämische Kontrolle in den Interventionsgruppen mit einem HbA1c von 6,4 % (ACCORD) bis 6,9 % (VADT) „schärfer“ als in der UKPDS (HbA1c 7 % bzw. 7,4 %). Die Studiendauer (3,5, 5 bzw. 6 Jahre) war in den oben genannten drei Studien wesentlich kürzer als die der UKPDS.
Was sagen die Metaanalysen?
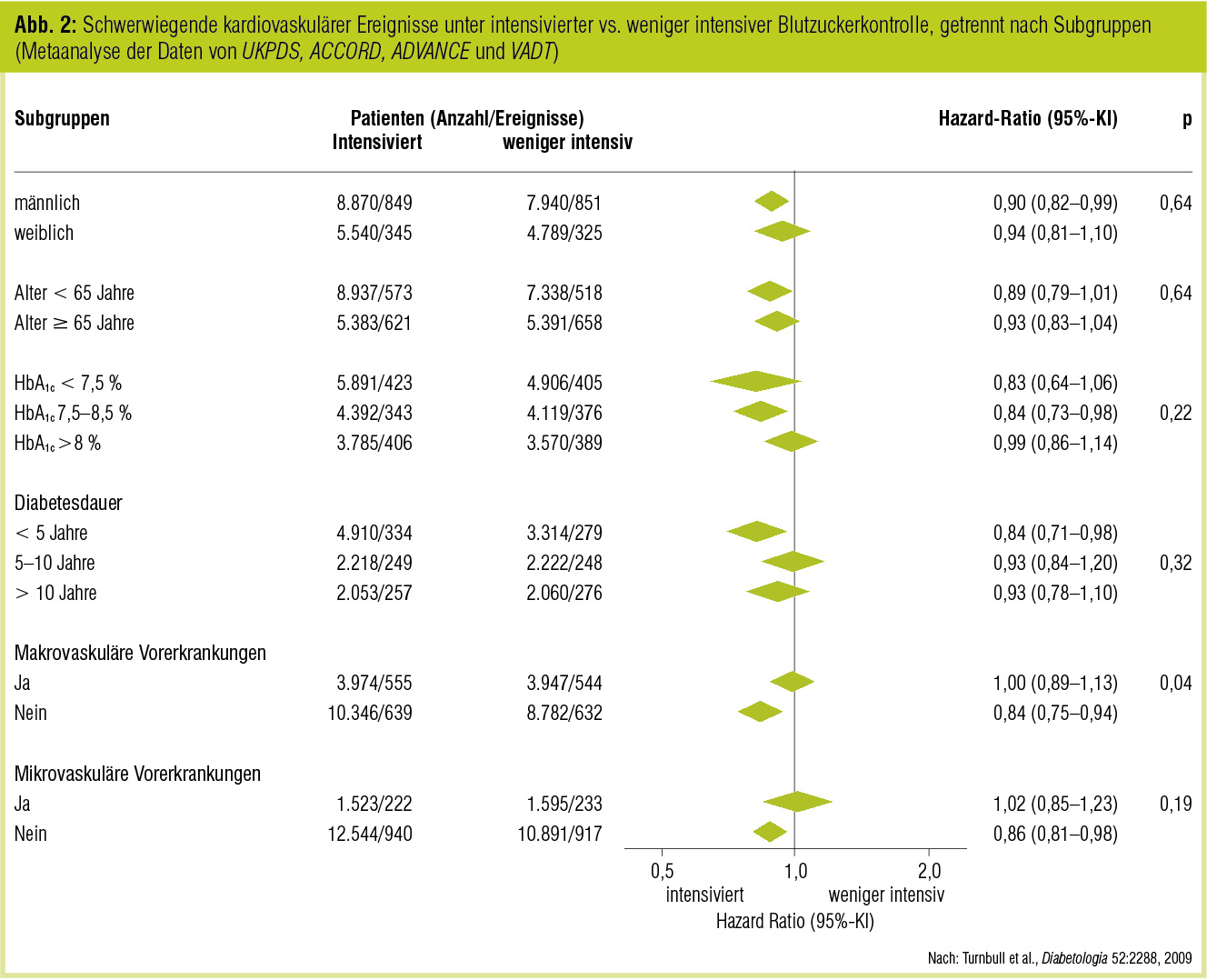
In einer Metaanalyse von ACCORD, ADVANCE, VADT und UKPDS (insgesamt über 27.000 Patienten; Abb. 2) konnte eine Reduktion der kardiovaskulären Ereignisse unter der intensivierten Therapie gezeigt werden, allerdings war die Mortalität nicht geringer, aber das Risiko schwerer Hypoglykämien erhöht (Turnbull et al., Diabetologia 2009).
In der Prospective Pioglitazone Clinical Trial In Macrovascular Events Study (PROactive; Dormandy et al., Lancet 2005) erhielten über 5.000 Typ-2-Diabetiker mit kardiovaskulärer Erkrankung entweder Pioglitazon oder Placebo. Im Hinblick auf den primären kombinierten Endpunkt (Mortalität, zerebro- und periphervaskuläre Ereignisse) war nur ein Trend zugunsten des Glitazons zu verzeichnen, während sich aus der Analyse der sekundären Endpunkte (Tod, Myokardinfarkt oder Schlaganfall) signifikant günstige Effekte von Pioglitazon ergaben. Da der HbA1c-Wert in der Interventionsgruppe im Mittel nur 0,5 Prozentpunkte niedriger lag als in der Placebogruppe, wurde dieser Effekt nicht alleine der Blutglukosesenkung, sondern auch den pleiotropen Effekten des Glitazons zugeschrieben.
Die Metaanalyse der Daten von UKPDS, PROactive, ADVANCE, VADT und ACCORD (insgesamt mehr als 33.000 Patienten), welche die Auswirkungen intensivierter blutzuckersenkender Therapien auf kardiovaskuläre Endpunkte und Mortalität analysierte, kam zu dem Schluss, dass eine HbA1c-Differenz von 0,9 Prozentpunkten zwischen intensivierter und konventioneller Gruppe zu einer Reduktion von koronarer Herzkrankheit und nichttödlicher Herzinfarkte führte. Es gab keine signifikanten Unterschiede hinsichtlich Schlaganfall und Gesamtmortalität (Ray et al, Lancet 2009).
Welche Studien mit neueren Antidiabetika sind gerade im Gange?
Zu neuen antidiabetischen Medikamentenklassen der Glucagon-like-peptide-1-Agonisten (GLP-1) und der Gliptine, die ihre blutzuckersenkende Wirkung über die Beeinflussung der enteroendokrinen Achse ausüben, gibt es noch keine Langzeiterfahrung hinsichtlich ihrer therapeutischen Sicherheit und ihrer Effekte auf das kardiovaskuläre Risiko. Es ist zu hoffen, dass die derzeit laufenden Studien Antworten dazu liefern werden:
Die Liraglutide Effect and Action in Diabetes (LEADER) Study, die 2016 abgeschlossen werden soll (über 8.000 Patienten; Liraglutid vs. Placebo zusätzlich zu „Standardbehandlung“; NCT01179048) und der Exenatide Study of Cardiovascular Event Lowering (EXSCEL) Trial („A trial to evaluate cardiovascular outcomes after treatment with Exenatide once weekly in patients with type 2 diabetes“; NCT01144338), die 2017 abgeschlossen werden soll (über 9.000 Patienten; Exenatid einmal wöchentlich vs. Placebo), werden erste Daten zum Einfluss der GLP-1-Agonisten auf das kardiovaskuläre Risiko bringen. Bei den Gliptinen sind sowohl für Saxagliptin (SAVOR-TIMI 53 mit 12.000 Patienten, Abschluss 2015; NCT01107886) als auch für Sitagliptin (TECOS mit 14.000 Patienten, Abschluss 2014; NCT00790205) große Studien im Gange.
Mit Spannung wurden erste Ergebnisse der Outcome Reduction With Initial Glargine Intervention (ORIGIN) Study erwartet, die eine frühzeitige Insulinisierung mit Insulin glargin mit konventioneller Diabetestherapie (jeweils mit und ohne Omega-3-Fettsäure-Gabe) im Hinblick auf kardiovaskuläre Morbidität und Mortalität verglich (ORIGIN Trial Investigators, N Engl J Med 2012). In dieser internationalen Doppelblindstudie wurden über 12.000 Patienten mit Typ-2-Diabetes, gestörter Glukosetoleranz und/oder gestörter Nüchternglukose untersucht. Sie erhielten entweder Insulin glargin, das bis zu einem Nüchternblutzuckerzielwert von < 95 mg/dl titriert wurde, oder eine Standardbehandlung. Der kombinierte Endpunkt beinhaltete Myokardinfarkt, Schlaganfall oder Tod. Nach einem Follow-up von 6,2 Jahren gab es keine signifikanten Unterschiede in der Ereignisrate zwischen Glargin- und Standardgruppe (siehe Abb. 1 auf Seite 15 in diesem Heft). In der mit Insulin glargin behandelten Gruppe waren mehr Hypoglykämien und eine Gewichtszunahme zu verzeichnen. Auch die Behandlung mit Omega-3-Fettsäuren führte zu keiner Verbesserung des kardiovaskulären Risikos (ORIGIN Trial Investigators, N Engl J Med 2012).
Zusammenfassung
Das Paradigma, dass Blutglukosesenkung wesentlich für die Verbesserung der kardiovaskulären Prognose bei Typ-2-Diabetes-mellitus ist, bleibt bestehen. Studien, die eine besonders strikte und rasche Absenkung der Blutglukose bei Patienten mit langer Diabetesdauer und vorbestehender kardiovaskulärer Erkrankung anstrebten, zeigten uns, dass „The lower, the better“ nicht für alle Patienten sinnvoll ist. Prinzipiell gilt, dass der Therapieansatz zur Verbesserung der kardiovaskulären Prognose von Patienten mit Typ-2-Diabetes-mellitus ein multifaktorieller sein muss (Lebensstil, Lipidprofil, Blutdruck, Plättchenaggregationshemmung), die Optimierung der glykämischen Kontrolle ist dabei natürlich ein zentraler Bestandteil.