Gastroenterologie/Diabetologie: Duale Agonisten und Triagonisten
Dual- und Triagonisten gelten als Weiterentwicklungen der inkretinbasierten Therapien und dürften neben ihrem antihyperglykämischen Effekt zudem einen Stellenwert in der zukünftigen konservativen Adipositas-Therapie haben.
Adipositas resultiert aus einem Ungleichgewicht aus Energieaufnahme und Energieverbrauch. Bisher hat die konservative Adipositas- Therapie jeweils einen dieser Faktoren fokussiert und entweder den Energieumsatz erhöht (z. B. Amphetamine, Sympathomimetika) oder die „Appetitzügelung“ angestrebt. Leider konnten in der Vergangenheit die wenigsten Medikamente einen Gewichtsverlust von über 10 % erreichen und waren zudem mit riskanten Nebenwirkungen (kardiovaskuläre Auswirkungen, Depression bis hin zu erhöhten Suizidraten) verbunden, sodass die meisten Präparate wieder vom Markt genommen werden mussten.
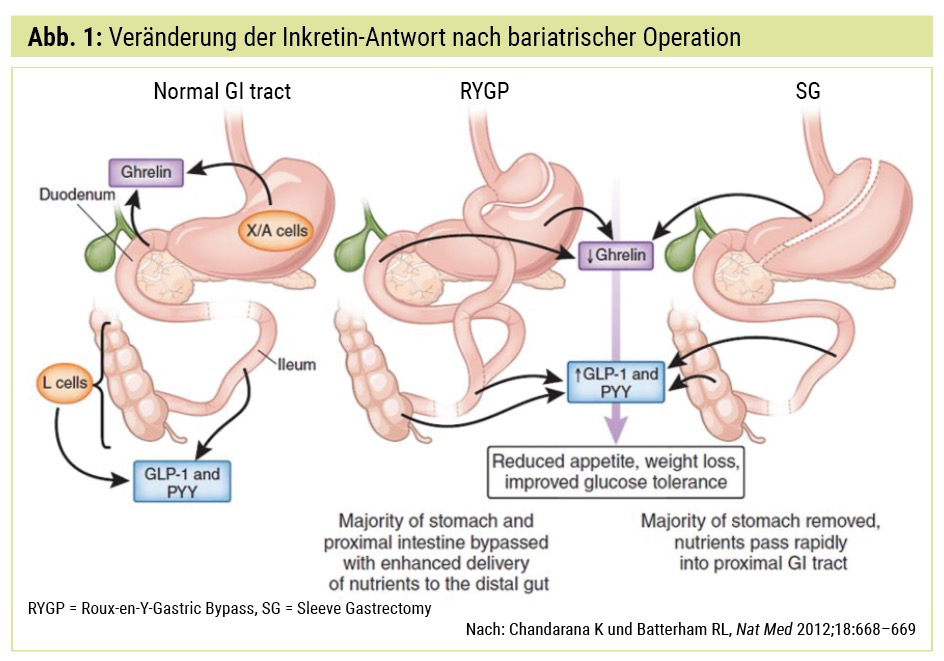
So blieb bis vor einiger Zeit die bariatrische Operation die einzige Möglichkeit für eine langfristige Gewichtsreduktion und Diabetesremission. Diese hat jedoch trotz ihrer zahlreichen Vorteile auch einige nicht zu unterschätzende Nachteile, so z. B. chirurgische Komplikationen, Dumping-Syndrom, Nährstoff- und Vitamin-Malabsorption sowie eine Zunahme an Suchterkrankungen.1 Wir haben jedoch vieles von der bariatrischen Chirurgie gelernt, so z. B. auch den langfristigen Effekt auf den körpereigenen Inkretin-Haushalt (Abb. 1)2.
Therapeutisches Target Inkretinsystem
Das Inkretinsystem ist seit Längerem Fokus der antihyperglykämischen und neuerlich auch der Adipositas-Therapie. So haben moderne GLP-1-Analoga neben ihrem blutzuckersenkenden Effekt auch eine gute Gewichtsreduktion gezeigt und sollen deshalb – natürlich auch wegen ihres kardiovaskulären Benefits – bei übergewichtigen Patienten mit Typ-2-Diabetes frühzeitig zum Einsatz kommen. Doch der gewichtsreduzierende Effekt der GLP-1-Analoga scheint limitiert, da sie primär auf die Reduktion der Kalorienzufuhr durch eine Verlängerung der Magenentleerungsphase sowie auf die Änderung des Appetits wirken.
Eine weitere Dosissteigerung ist meist aufgrund der Zunahme der gastrointestinalen Nebenwirkungen (Übelkeit, Erbrechen) nicht möglich.
Zudem bleibt der Energieumsatz unverändert. Dies hat zur Entwicklung der dualen Agonisten und Triagonisten geführt. Bei diesen gibt es bis dato mehrere Optionen.
Optionen für Dual- und Triagonisten
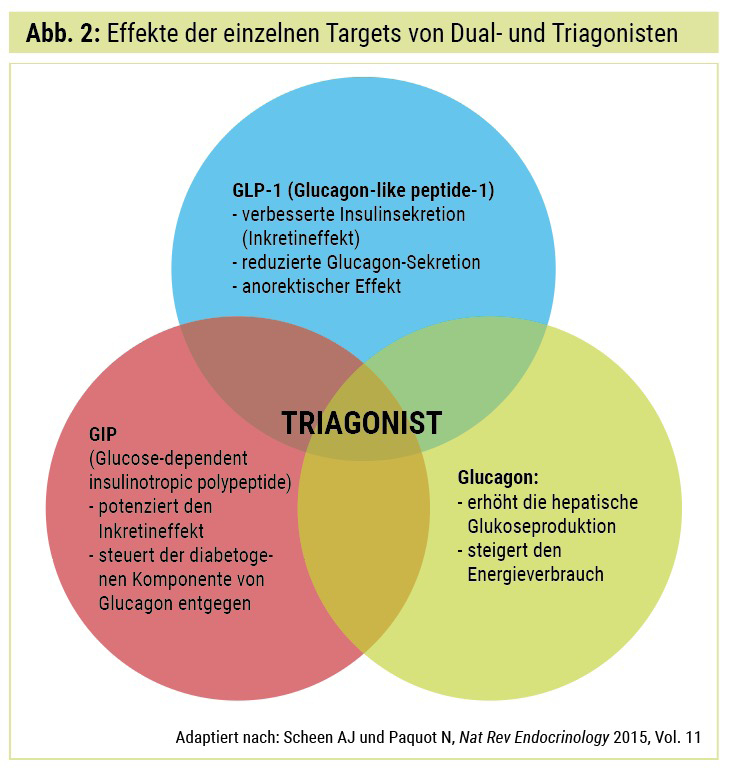
Option 1 Glucagon-Rezeptor/GLP-1-Rezeptor-Co-Agonist (GcgR/GLP-1RA): Der duale Agonist Glucagon hemmt die Lipogenese und stimuliert die Lipolyse, signalisiert zentral Sättigung und steigert den Energieverbrauch und die Thermogenese, wahrscheinlich durch Aktivierung des braunen Fettgewebes. Zwar hat Glucagon einen blutzuckersteigernden Effekt, der jedoch durch die GLP-1-Komponente in diesen Molekülen supprimiert wird.3 Einige dieser Moleküle befinden sich derzeit in klinischen Phase-I- und Phase-II-Studien.
Option 2 GIP-R/GLP-1R-Co-Agonisten (Twinkretine): GIP stellt neben GLP-1 das wichtigste uns bekannte körpereigene Inkretin dar. Die sogenannten Twinkretine aktivieren somit beide Inkretinrezeptoren, was zu einer Steigerung der antihyperglykämischen und gewichtsreduzierenden Wirkung führt, dies aber ohne oder mit geringeren Veränderungen der Magenmotilität. Der limitierende Faktor der GLP-1-Therapie, nämlich die gastrointestinalen Nebenwirkungen, kann somit deutlich reduziert werden.
Von den Twinkretinen ist derzeit Tirzepatide (vormals: LY3298176) eine in klinischen Studien getestete Substanz, für die bereits erstaunliche Erfolge gezeigt werden konnten. So kam es zu einer signifikanten Gewichtsreduktion von > 10 kg, und rund ein Viertel der Patienten konnte einen Gewichtsverlust von > 15 % erreichen.4
Aller guten Dinge sind 3? Packt man nun alle Agonisten in ein Molekül, so erhält man einen sogenannten Triagonisten (Abb. 2). Diese konnten zumindest im Tiermodel schon sehr gute Ergebnisse erzielen, und es wurde neben ihrem antiadipogenen Effekt zudem ein neuroprotektiver Effekt, z. B. in Alzheimer-Modellen, gezeigt.5
Resümee
Dual- und Triagonisten stellen vielversprechende Weiterentwicklungen der inkretinbasierten Therapien dar und geben Hoffnung auf eine potente konservative Adipositas-Therapie in naher Zukunft. Abzuwarten bleibt, wie sie sich bezüglich gastrointestinaler Nebenwirkungen, kardiovaskulärer Sicherheit und Langzeiterfolgen hinsichtlich Diabetes-Remission verhalten.
1 Davies MJ et al., Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2018; 41:2669–2701
2 Chandarana K and Batterham RL, Shedding pounds after going under the knife: metabolic insights from cutting the gut. Nat Med 2012; 18:668–669
3 Day JW et al., A new glucagon and GLP-1 co-agonist eliminates obesity in rodents. Nat Chem Biol 2009; 5:749–757
4 Frias JP et al., Efficacy and safety of LY3298176, a novel dual GIP and GLP-1 receptor agonist, in patients with type 2 diabetes: a randomised, placebo-controlled and active comparator-controlled phase 2 trial. Lancet 2018; 392:2180–2193
5 Li T et al., A novel GLP-1/GIP/Gcg triagonist reduces cognitive deficits and pathology in the 3×Tg mouse model of Alzheimer’s disease. Hippocampus 2018; 28:358–372