Herausforderung der Pharmakotherapie bei fortgeschrittener Nephropathie
Mindestens zwei Drittel aller Patienten mit Typ-2-Diabetes haben ein hohes Risiko für die Entwicklung einer eingeschränkten Nierenfunktion. In dieser Population steht sicherlich Hypertonie als Risikofaktor für die Entwicklung einer chronischen Niereninsuffizienz an erster Stelle; die Prävalenz beträgt hier ca. 70 %. Eine schlechte Blutzuckereinstellung ist in nahezu der Hälfte der Patienten festzustellen, welche als zusätzlicher Risikofaktor für die Entwicklung einer Niereninsuffizienz anzusehen ist, ebenso wie eine Mikroalbuminurie, welche bei 30 % der Patienten auftritt. Weiters findet sich die Dyslipidämie, wobei gerade bei Patienten mit fortgeschrittener Niereninsuffizienz, wie später noch angemerkt werden wird, hier eine Intervention derzeit durch die Evidenz nicht vollständig untermauert wird (Kannel, Am Heart J 1985; Mooradian, Nat Clin Pract Endocrinol Metab 2009; American Diabetes Association Standards of Medical Care, Diabetes Care 2011).
Ca. 40 % der Patienten mit Typ-2-Diabetes haben renale Komplikationen. Etwa die Hälfte davon hat einen Nierenschaden mit Proteinurie (Stadium 1 oder 2, d. h. eine Clearance zwischen 60 ml/min und 120 ml/min), während 20 % in den Stadien 3 bis 5 anzusiedeln sind (Koro et al., Clin Ther 2009). Die meisten Daten über die Anzahl der Betroffenen liegen aus den USA vor. Hier geht man davon aus, dass 7 Millionen Menschen an Typ-2-Diabetes leiden (zumindest diagnostiziert), weitere 2,4 Millionen nicht diagnostiziert sind und der Prädiabetes bei 10,1 Millionen zu finden ist (Plantinga et al., Clin J Am Soc Nephrol 2010; Centers of Disease Control and Prevention, National Diabetes Fact Sheet, 2007). Im Österreichischen Dialyse- und Transplantationsregister (ÖDTR 2012) zeichnete sich 2007 erstmals ein Rückgang der inzidenten Patienten mit diabetischer Nephropathie an der Dialyse ab.
Typ-2-Diabetes führt nicht nur zu renalen, sondern natürlich auch zu kardiovaskulären Komplikationen (Herzinsuffizienz, linksventrikuläre Dysfunktion oder koronare Herzerkrankung). So wie mit der eingeschränkten Nierenfunktion das Risiko für kardiovaskuläre Morbidität und Mortalität dramatisch ansteigt (Go et al., N Engl J Med 2004), so ist auch die Proteinurie per se ein Risikofaktor für kardiovaskuläre Ereignisse und für die Entwicklung einer diabetischen Nephropathie im Endstadium. Das Vorkommen von beiden Zuständen – Proteinurie plus Einschränkung der glomerulären Filtrationsrate (GFR) – potenziert das Risiko für kardiovaskuläre Ereignisse (Astor et al., Am J Epidemiol 2008). So verdoppelt sich das Risiko für Mortalität bei Vorhandensein von chronischer Niereninsuffizienz und Diabetes.
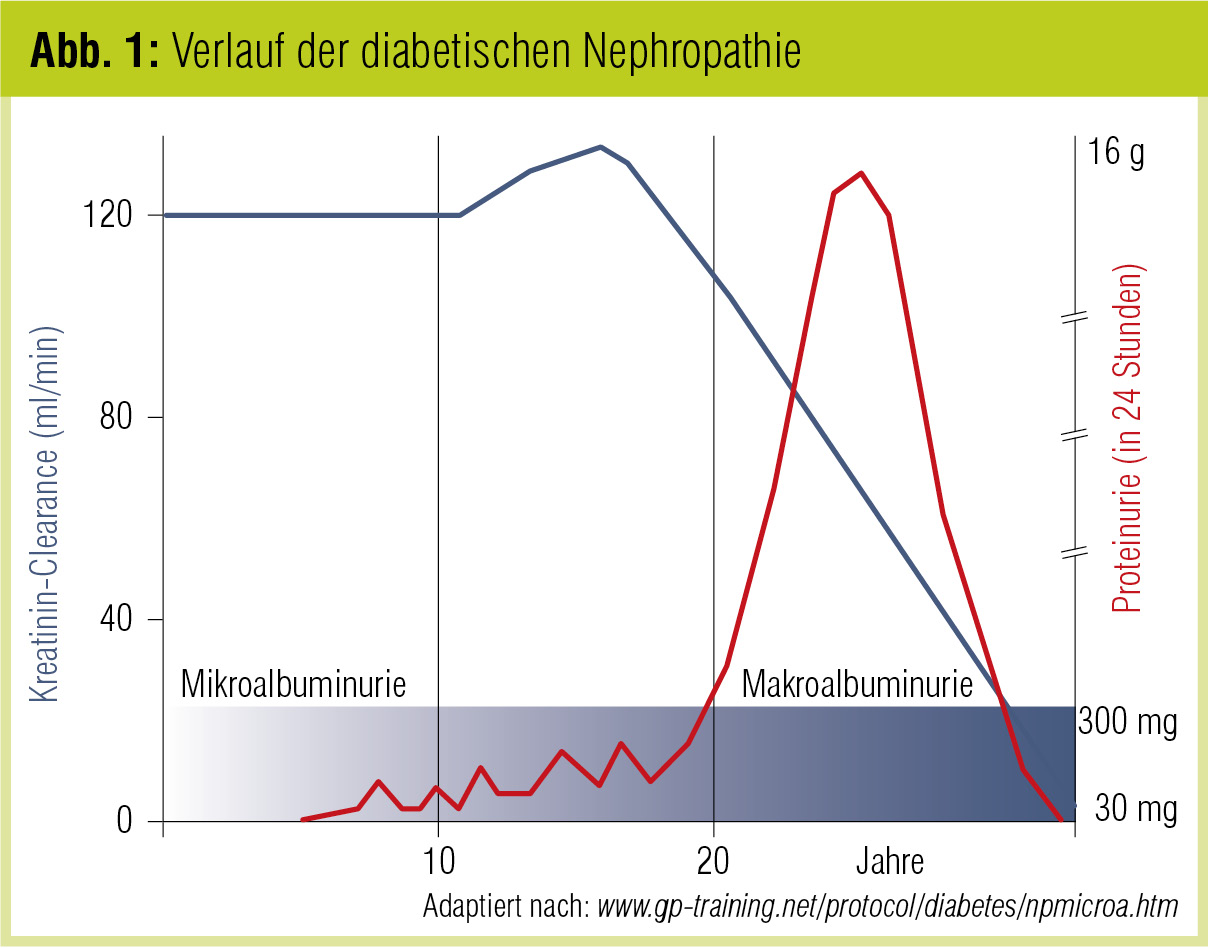
In Abbildung 1 findet sich der typische Verlauf der diabetischen Nephropathie: Wenn sich einmal eine Mikroalbuminurie bzw. eine große Proteinurie entwickelt, kommt es nach der Phase der Hyperfiltration zu einer kontinuierlichen Abnahme der glomerulären Filtrationsrate. Die Konsequenz daraus ist, dass die Mikroalbuminurie offensichtlich ein frühes Warnsignal darstellt und daher die Progression zu einer großen Proteinurie die nicht verhinderbare Abnahme der glomerulären Filtrationsrate ist. Daher sind eine frühe Erkennung und das entsprechende Management der Risikofaktoren essenziell, um die Nierenfunktion zu erhalten und auch das kardiorenale Outcome zu verbessern (vergleiche DIABETES FORUM 1/2012).
Unter den modifizierbaren Risikofaktoren bei Typ-2-Diabetes steht im Vordergrund die Blutdruckeinstellung, gefolgt von Proteinurie, Lipiden und entsprechenden Lifestylemodifikationen (Gewichtsabnahme, Nikotinkarenz, Salzrestriktion).
Pharmakotherapie der Hypertonie
Vor fast 30 Jahren zeigten Parving und Mitarbeiter (Lancet 1983), dass durch signifikante Blutdruckreduktion auch die Albuminurie signifikant gesenkt und somit die Abnahme der glomerulären Filtrationsrate verlangsamt werden kann. Bakris und Mitarbeiter (Diabetes Res Clin Pract 1998) hatten um die Jahrtausendwende die damaligen Studien zusammengefasst und festgehalten, dass je niedriger der Blutdruck, desto niedriger auch die Abnahme der glomerulären Filtrationsrate in dieser Population mit eingeschränkter Nierenfunktion ist. Der angegebene Zielblutdruck von unter 140/90 mmHg wurde in den folgenden Jahren noch weiter heruntergesetzt: Bei Diabetes mellitus wurde der Zielblutdruck auf 130/80 mmHg herabgesetzt, bei Vorhandensein einer Proteinurie von über 1 g/24 h sogar auf unter 125/75 mmHg (z. B. Auinger et al., Wien Klin Wochenschr 2009).
Diese Herangehensweise wurde in den letzten Jahren allerdings wiederum relativiert. Wie mittels der ACCORD-Studie (ACCORD Study Group., New Engl J of Med 2010) gezeigt werden konnte, wurde durch die intensive Blutdrucksenkung (120 mmHg vs. 135 mmHg systolisch) keine Verbesserung hinsichtlich kardiovaskulärer Ereignisse und Mortalität gezeigt. Im Gegenteil: Es wurden mehr Nebenwirkungen inklusive Hypotension, Hyperkaliämie und Abnahme der glomerulären Filtrationsrate gesehen. Dies wurde auch von Cooper-DeHoff et al. (JAMA 2010) bestätigt.
Zusammenfassend kann man daher festhalten, dass bei Patienten ohne Proteinurie ein Blutdruckziel von unter 140/90 mmHg angestrebt werden soll, und dass die Evidenz, den Blutdruck niedriger als unter 120/70 mmHg zu senken, sehr schwach ist. Im Gegenteil: Die European Society of Hypertension (ESH) und die European Society of Cardiology (ESC) warnen davor, den Blutdruck bei Patienten mit koronarer Herzerkrankung unter diesen Wert zu senken (Mancia et al., Eur J Hypertens 2009). Unterstützt wird dies durch die rezente ROADMAP-Studie (Haller et al., New Engl J of Med 2011), in der eine höhere Mortalität bei Patienten gesehen wurde, welche eine koronare Herzerkrankung aufwiesen und bei denen vor allem der Blutdruck deutlich unter 122 mmHg systolisch gesenkt wurde.
Pharmakotherapie der Proteinurie bzw. Angiotensin-II-Kontrolle
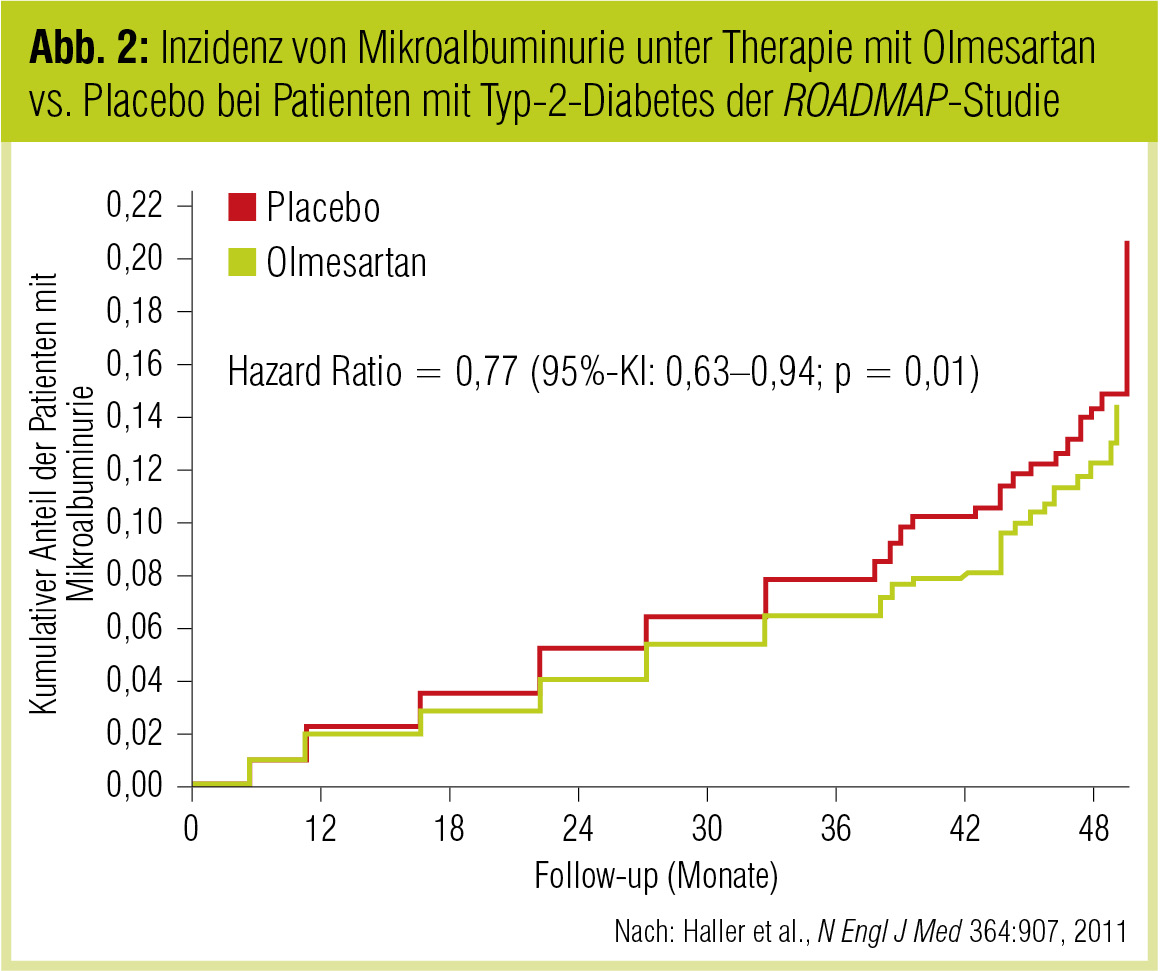
Basierend auf alten Daten (Gall et al., Diabetes 1995) wurde gezeigt, dass das Ausmaß der Proteinurie mit der Mortalität assoziiert ist. Laut einer Zusammenfassung von Heerspink und Mitarbeitern (Adv Chron Kidney Dis 2011) wurde in vielen Studien gezeigt, dass das renale Ergebnis umso besser war, je stärker die Proteinurie gesenkt wurde. Weiters wurde gezeigt, dass mit ACE-Hemmern die Mikroalbuminurie gesenkt werden kann – etwas, das mit Kalziumkanalblockern nicht zu erreichen ist (Ruggenenti et al., N Engl J Med 2004). Auch für die Therapie mit Angiotensinrezeptorblockern (ARB) wurde festgehalten, dass die Mikroalbuminurie weiter hinausgezögert werden kann (Risikoreduktion: 23 %; Haller et al., N Engl J Med 2011; Abb. 2).
In einer rezenten Metaanalyse (Hirst et al., Kidney Int 2012) wurde gezeigt, dass bei Typ-2-Diabetikern die Blockade des Renin-Angiotensin-Aldosteron-Systems (RAAS) sowohl die Progression von Normal- zu Mikroalbuminurie, als auch von Mikro- zu Makroalbuminurie signifikant hemmt. Zuvor hatten Barnett et al. (N Engl J Med 2004) gezeigt, dass durch RAAS-Hemmung die Progression der diabetischen Nephropathie hintangehalten werden kann. Allerdings muss festgehalten werden, dass in der bekannten RENAAL-Studie (Brenner et al., N Engl J Med 2001) zwar die Inzidenz für die Entwicklung einer Dialysepflichtigkeit deutlich verringert war, allerdings kam es hinsichtlich der Mortalität zu keiner Verbesserung.
Ein positiver Effekt der dualen Blockade des RAAS wurde in letzter Zeit bei kardiovaskulären Hochrisikopatienten der ONTARGET- und der ALTITUDE-Studie nicht bestätigt. Im Gegenteil: Es kam zu mehr Komplikationen hinsichtlich akuten Nierenversagens und Hyperkaliämie.
Zusammenfassend soll festgehalten werden, dass der Zielblutdruck bei einer Proteinurie über 1 g/Tag unter 130/80 mmHg, bei Patienten mit koronarer Herzerkrankung aber nicht unter 120/70 mmHg liegen soll. ACE-Hemmer und Angiotensinrezeptorblockern können beide gleichwertig verwendet werden, eine Kombination soll (doppelte RAAS-Blockade) vermieden werden.
Pharmakotherapie der Dyslipidämie
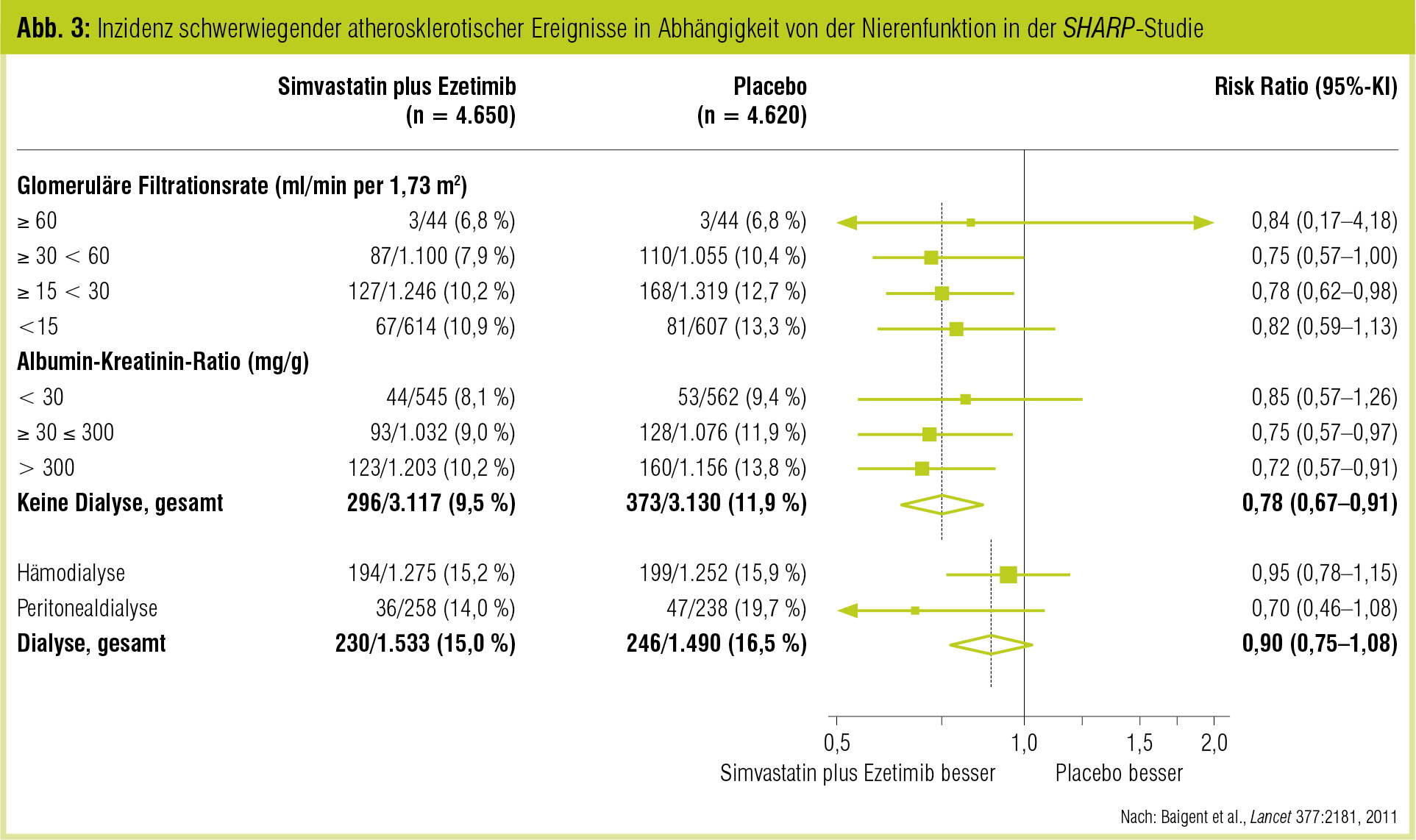
Große klinische Untersuchungen haben gezeigt, dass Statine eine signifikante Reduktion kardiovaskulärer Ereignisse erreichen (zusammengefasst von Solano & Goldberg, Cardiol Rev 2006). Bei Patienten mit eingeschränkter Nierenfunktion ist die Datenlage nicht so eindeutig. In der griechischen GREACE-Studie (Athyros et al., Curr Med Res Opin 2002) gab es Hinweise darauf, dass Atorvastatin die Nierenfunktion und die kardiovaskuläre Ereignisrate verbessert. Der Benefit war bei Patienten mit nur geringer Nierenfunktionseinschränkung am größten. Die Nephrologen sind bei den Dialysepatienten hinsichtlich der Gabe von Statinen restriktiver geworden. Während Daten der deutschen 4D-Studie (Wanner et al., New Engl J of Med 2005) bei diabetischen Dialysepatienten keinen Benefit durch Atorvastatin zeigten, konnte in der SHARP-Studie (Baigent et al., Lancet 2011) eine 17%ige Reduktion der vaskulären Ereignisse gezeigt werden (Abb. 3). Dies allerdings in der Kombination Simvastatin und Ezetimibe, wobei die kardiovaskuläre Mortalität in diesen Patienten nicht gesenkt bzw. die Progression der Niereninsuffizienz nicht hintangehalten werden konnte.
Zusammenfassung: Die American Diabetes Association empfiehlt Statine bei Patienten mit Typ-2-Diabetes unabhängig vom Lipidspiegel, wenn sie einen oder mehr Risikofaktoren für kardiovaskuläre Erkrankungen haben. Die fehlende Verbesserung der Gesamtmortalität bei Patienten mit eingeschränkter Niereninsuffizienz unter Statintherapie ist ungeklärt (zusammengefasst in NephSAP, Sept 2012, „Diabetic Kidney Disease“).
Resümee
Letztendlich ist eine multifaktorielle Intervention mit Blutdrucksenkung, Kontrolle der Lipide, des Blutzuckers sowie entsprechender RAAS-Blockade – wie in der STENO-2-Studie (Gaede et al., New Engl J Med 2003) beschrieben – immer noch die „State of the Art“-Therapie. Optimierung des Blutdrucks unter 130/80 mmHg, RAAS-Blockade (Verwendung eines ACE-Hemmers oder Angiotensinrezeptorblockers), Lipidsenkung (LDL-Cholesterin < 100 mg, bei Hochrisikopatienten < 70 mg/dl), eine entsprechende Blutzuckerkontrolle (HbA1c ca. 7 %) sowie entsprechende Lebensstilmodifikation mit Gewichtsreduktion, Raucherentwöhnung und Salzrestriktion sind das Um und Auf der Therapie.