Infektion und deren Bekämpfung
Das Management des diabetischen Fußsyndroms (DFS) und der Osteomyelitis erfordern eine interdisziplinäre Zusammenarbeit auf hohem Niveau. Etwa 2–5 % aller Diabetiker haben ein Fußulkus, wobei die Ursache bei 80 % aller Fälle traumatisch ist. 20 % aller Spitalsaufnahmen von Diabetikern erfolgen wegen eines DFS. Das DFS ist die Ursache für mehr als 60 % aller nichttraumatischen Beinamputationen bei Diabetikern und für mehr als 20 % aller Amputationen innerhalb des ersten Jahres nach Diabetesdiagnose.
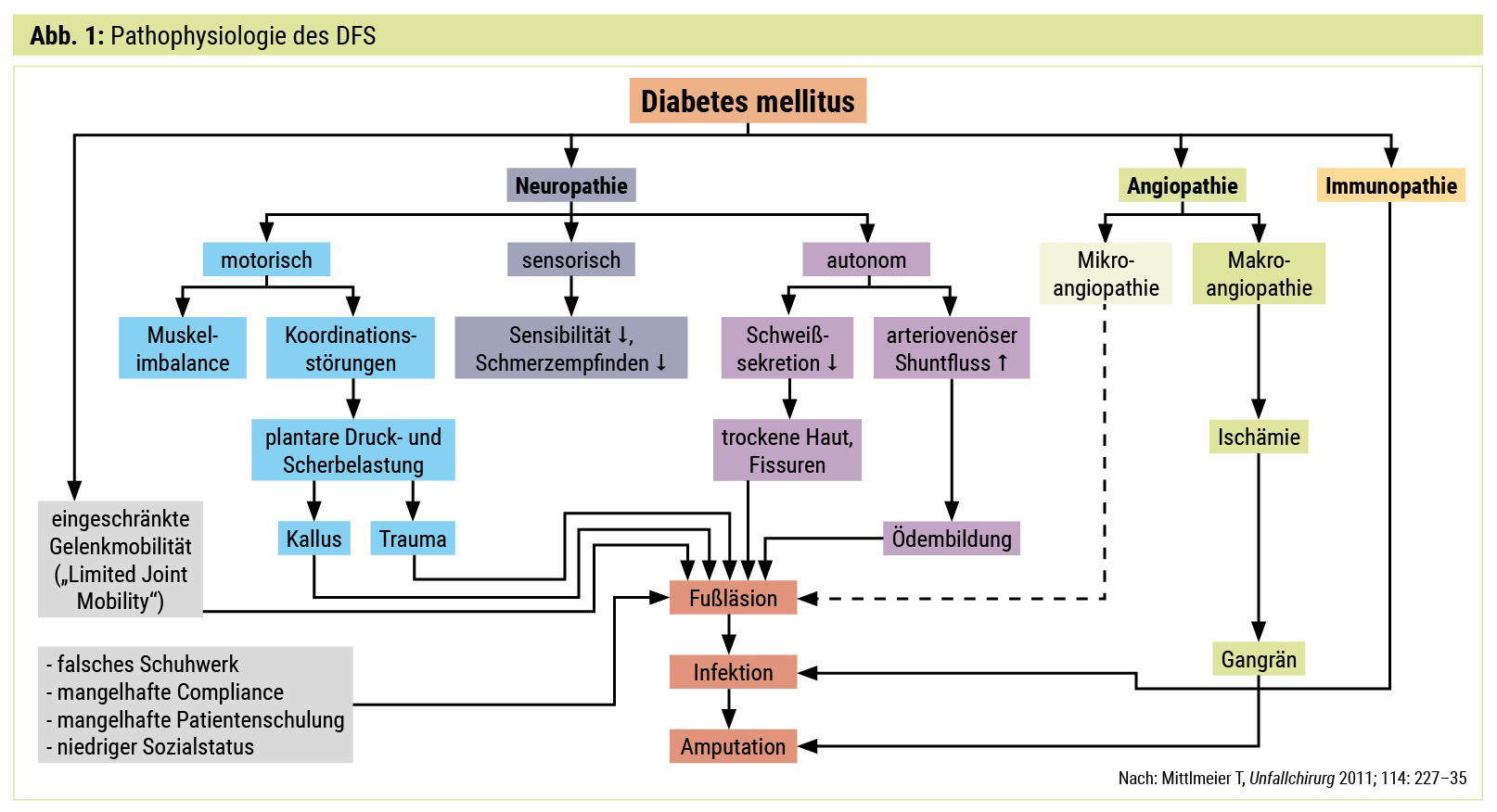
Die Basis von DFS und Osteomyelitis ist eine Läsion im Bereich des Fußes. Diese kann durch eine chronisch venöse Insuffizienz (CVI), durch eine periphere arterielle Verschlusskrankheit (PAVK), durch eine diabetische Polyneuropathie (PNP), durch eine ebenfalls durch den Diabetes verursachte oder geförderte Mikrozirkulationsstörung und nicht zuletzt durch eine Infektion verursacht werden, wobei Kombinationen der genannten Ursachen durchaus möglich sind (Abb. 1). Eintrittspforte für eine Infektion kann z. B. eine Onycho- bzw. Interdigitalmykose sein. Bereits kleine Traumata können bei Vorhandensein von reduzierter Mikrozirkulation, Polyneuropathie, Immunsuppression durch den Diabetes und Atrophie bzw. Migration der Fettpolster zu kleineren Verletzungen als Basis für ein DFS führen. Die Unterteilung der diabetischen Fußläsionen kann nach der Wagner-Armstrong-Klassifikation oder nach der PEDIS-Einteilung erfolgen (Abb. 2).
Diagnostik
Hinsichtlich der Infektion muss geklärt werden, ob der gefundene Keim auch tatsächlich die Infektion verursacht und, wenn ja, wie die Resistenzsituation aussieht und ob es sich um eine akute oder eine chronische Infektion handelt. Bei der antibiotischen Therapie sind schließlich die Gewebepenetration, das Nebenwirkungsspektrum und die Interaktionen zu bedenken.
Die Hauptverursacher von DFS und Osteomyelitis aus infektiologischer Sicht sind grampositive Bakterien, vor allem Staphylokokken (S. aureus, koagulasenegative Staphylokokken) und Streptokokken (z. B. Streptococcus pyogenes). Später im zeitlichen Verlauf treten gramnegative Erreger wie Pseudomonas aeruginosa, E. coli, Klebsiellen, Acinetobacter, Proteus mirabilis oder Citrobacter auf, die in Abstrichen häufig gefunden werden, jedoch nicht selten nur Kolonisationskeime sind (Abb. 3).
Erreger, die gelegentlich wohl eine Infektion verursachen können, zumeist aber Kontaminations- bzw. Kolonisationskeime sind, stellen im grampositiven Bereich S. epidermidis, Enterokokken und Korynebakterien dar, im gramnegativen Bereich P. aeruginosa, Acinetobacter-Spezies und Stenotrophomonas maltophilia.
Aus infektiologischer Sicht lassen sich fünf Stadien der Keimbesiedelung unterscheiden, nämlich Kontamination, Kolonisation, kritische Kolonisation, lokale Infektion und systemische Infektion. Die ersten beiden Stadien sind zumeist mit Hilfe von Spülungen, die nächsten beiden mit Hilfe von Antiseptika und Wundmanagement behandelbar. Erst das Stadium der systemischen Infektion bedarf einer Antibiotikatherapie.
50–60 % der schweren diabetischen Fußinfektionen gehen mit einer fortgeleiteten Osteomyelitis einher. Risikofaktoren für die Entstehung einer Osteomyelitis auf Basis eines DFS sind Amputation (OR 19,9), „probe to bone“, also Sondierbarkeit bis zum Knochen, (OR 6,7), PAVK (OR 5,5), Ulkus, das seit mehr als 30 Tagen besteht (OR 4,7), Polyneuropathie (OR 3,4), rezidivierendes Ulkus (OR 2,4) und Trauma (OR 2,4).
Das diagnostische Standardverfahren ist der mikrobiologische Abstrich, der allerdings mit der richtigen Technik abgenommen werden muss. Zunächst sollte die Wunde mit steriler Kochsalzlösung gereinigt werden; anschließend sollte ein Abstrich vom Wundgrund mit einem gewissen Druck entnommen werden, damit Gewebsflüssigkeit austreten kann. Wird hingegen oberflächliches Sekret, Eiter oder nekrotisches Material abgestrichen, ist das Risiko, nur Kolonisationskeime zu kultivieren, sehr groß. Wichtig ist, sich bewusst zu sein, dass das Ergebnis eines mikrobiologischen Abstrichs die Beschreibung des Materialzustands ist, wie es ins Labor gekommen ist. Dies muss nicht mit dem tatsächlichen Infektionserreger übereinstimmen.
Für die Diagnostik einer Osteomyelitis wäre eine Knochenbiopsie diagnostisch sinnvoll, da es hier nur eine Übereinstimmung von knapp über 20 % zwischen den in einem Wundabstrich kultivierten und den die Osteomyelitis verursachenden Erregern gibt. Leider wird die Knochenbiopsie bei DFS zu selten eingesetzt, was eine suboptimale Antibiotikatherapie nach sich zieht. Zur Verlaufskontrolle ist als bildgebendes Verfahren am ehesten die MRT geeignet.
Bei Osteomyelitis fehlen oft klinische Entzündungszeichen, und auch Entzündungsmarker im Blut können normal sein. Der Schmerz ist hingegen ein guter diagnostischer und auch Verlaufsparameter – wird er weniger, greift zumeist die antibiotische Therapie.
Antimikrobielle Therapie
Staphylococcus aureus ist immer behandlungswürdig und kann aufgrund der in Österreich sehr niedrigen MRSA-Rate mit einem klassischen, älteren Staphylokokken-Antibiotikum behandelt werden. Dies wäre z. B. Flucloxacillin (3 x 2–4 g i. v.), Cefazolin (3 x 2 g i. v.), Cefuroxim (3 x 1,5–3 g i. v.), Clindamycin (3 x 0,9–1,2 g i. v. oder 3 x0,6–0,9 g p. o.), Fusidinsäure (3–4 x 0,5 g p. o.) oder Moxifloxacin 1–2 x 400 mg p. o. oder i. v.).
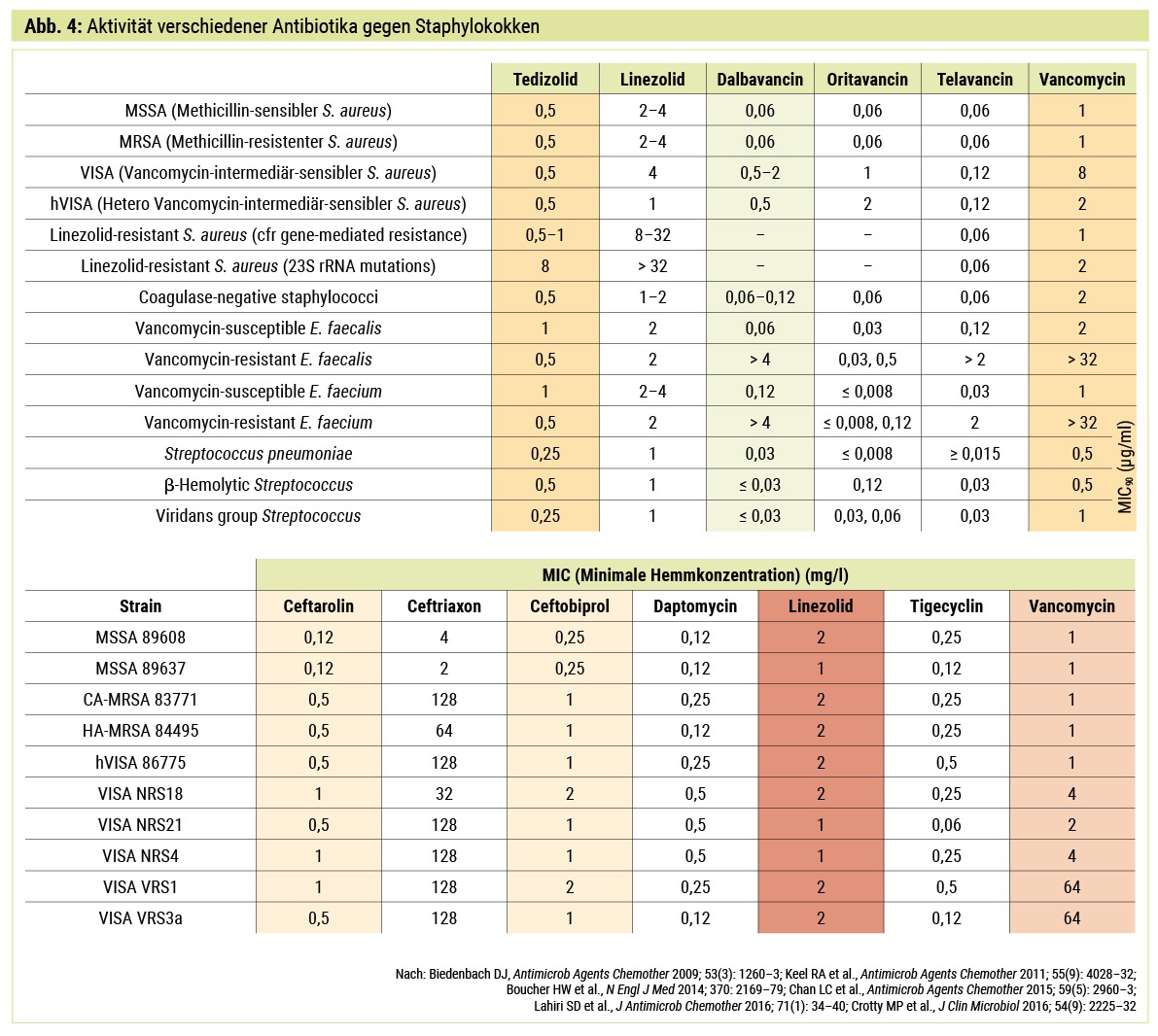
Bei methicillinresistenten Staphylokokken (MRSA, MRSE) sind Ceftarolin (das erste MRSA-wirksame Betalaktam; 3 x 0,6–1,2 g i. v.), Teicoplanin (1 x 15 mg/kg i. v.; Talspiegel 40–60 mg/l), Linezolid (2–3 x 0,6 g p. o. oder i. v.), Tigecyclin (1–2 x 150 mg, i. v.), oder Daptomycin (1 x 8–10 mg/kg i. v.) Optionen. Vancomycin sollte wegen seiner schlechten Knochengängigkeit und relativ starken Nephrotoxizität in dieser Indikation heute nicht mehr verwendet werden (Abb. 4). Wichtig ist bei allen angeführten Staphylokokkentherapien, dass das gramnegative Spektrum mit einem Kombinationspartner abgedeckt werden muss.
Für eine ambulante parenterale Antibiotikatherapie (APAT) stehen heute Dalbavancin, Oritavancin und Teicoplanin zur Verfügung. Dalbavancin wird zweimalig im Abstand von 8 Tagen in einer Dosierung von 1,5 g Xydalba® parenteral verabreicht, die Wirkdauer beträgt dann 8 Wochen. Hierbei soll eine aktuelle Studie im New England Journal of Medicine nicht verschwiegen werden, welche eindrucksvoll zeigte, dass bei einer Osteomyelitis die orale Therapie einer parenteralen nicht unterlegen ist.
Zunehmend können auch mehrfachresistente Enterobakterien nachgewiesen werden, welche – vor allem im ambulanten Setting – eine therapeutische Herausforderung darstellen können. Ertapenem, ein „Schmalspektrumcarbapenem“ ohne Pseudomonas-Aktivität, jedoch wirksam gegen ESBL-positive Enterobakterien, sollte bei DFS bzw. Osteomyelitis in einer Tagesdosis von 2 g verabreicht werden, weil sonst die Gewebespiegel zu gering sind. Bei stark eingeschränkter Nierenfunktion ist Ertapenem jedoch wegen möglicher zentralnervöser Nebenwirkungen kontraindiziert.
Die klassische antimikrobielle Therapie ist bei Vorliegen einer Osteomyelitis obligat, jedoch bei Ulzera ohne Knochenbeteiligung sollte modernes Wundmanagement vorrangig eingesetzt werden. Hierbei gibt es moderne topische Therapien, die, wie beispielsweise „platelet-rich fibrin“, mit und ohne Antibiotikazusatz (!) erfolgreich eingesetzt werden. Die größten Wermutstropfen sind Kosten und Verfügbarkeit.
Zu guter Letzt muss darauf hingewiesen werden, dass ohne eine entsprechende Compliance des Patienten – beginnend bei der Zuckereinstellung bis hin zum richtigen Schuhwerk – der Erfolg jeglicher Therapie bescheiden bleiben wird.
























































































_Felicitas_Matern_opt.jpg)
