Insulinresistenz: Prädiabetes ist ein proatherogener Zustand
Patienten mit Typ-2-Diabetes stellen ohne Zweifel ein kardiovaskuläres Hochrisikokollektiv dar. Nach der vielzitierten Publikation von Haffner et al. (N Engl J Med 1998) liegt das Risiko dieser Patienten, einen Myokardinfarkt zu erleiden, auf dem Niveau von Nichtdiabetikern mit vorangegangenem Herzinfarkt. Ausgehend von diesen Daten wurde das Konzept der kardiovaskulären Risikoäquivalenz von Typ-2-Diabetes und koronarer Herzkrankheit (KHK) formuliert, wenngleich spätere Studien zum Teil zu abweichenden Ergebnissen kamen (Bulugahapitiya et al., Diabet Med 2009).
Das kardiovaskuläre Risiko steigt bereits vor der Manifestation des Typ-2-Diabetes. So ergab eine Analyse der Stoffwechselsituation von 181 konsekutiven Patienten mit akutem Myokardinfarkt nicht nur eine erhöhte Inzidenz von unerkanntem Diabetes mellitus (31 %), sondern auch von gestörter Glukosetoleranz (35 %) in diesem Patientenkollektiv (Norhammer et al., Lancet 2002). Eine Untersuchung von Säly et al. (Atherosclerosis 2008) bei koronarangiographierten Patienten aus Graz ergab ein ähnliches Bild: Von 1.040 Patienten wiesen 190 eine gestörter Glukosetoleranz und 90 einen Zweistundenwert im diabetischen Bereich (> 200 mg/dl) im oralen Glukosetoleranztest (OGGT) auf; bei 366 Patienten wurde Diabetes mellitus anamnestisch erhoben oder anhand eines erhöhten Nüchternblutzuckers neu diagnostiziert. Insgesamt lag demnach bei fast zwei Dritteln dieser Patienten eine Glukosestoffwechselstörung vor.
Die Uhr beginnt im Prädiabetes zu ticken
Schon vor über 20 Jahren präsentierten Haffner et al. (JAMA 1990) eine Untersuchung bei US-Amerikanern mit mexikanischer Herkunft (die in der Folge für die San Antonio Heart Study rekrutiert wurden), die darauf schließen ließ, dass die kardiovaskuläre Risikoerhöhung bei Typ-2-Diabetikern lange vor der klinischen Manifestation der Erkrankung ihren Ausgang nimmt. Sie identifizierten einen Cluster atherogener Risikofaktoren (erhöhte Triglyzeride, erhöhtes LDL-Cholesterin, Hypertonie, erhöhte Nüchternglukose und erhöhtes Nüchterninsulin im Stadium der normalen Glukosetoleranz (NGT), die bei Personen, die später einen Typ-2-Diabetes entwickelten, ähnlich stark zum makrovaskulären Risiko beitrugen wie die Diabetesdauer. Basierend auf diesen Erkenntnissen formulierten Haffner und Kollegen die Hypothese der „Ticking Clock“, die für mikrovaskuläre Komplikationen mit dem Einsetzen der Hyperglykämie, für makrovaskuläre Probleme aber schon in der prädiabetischen Phase zu laufen beginnt.
Daten der Nurses’ Health Study (Hu et al., Diabetes Care 2002) bestätigen das bereits vor der Diabetesmanifestation signifikant erhöhte kardiovaskuläre Risiko. So hatten Frauen, die während der 20-jährigen Follow-up-Periode an Typ-2-Diabetes erkrankten, vor der Diagnosestellung ein 3,17-fach höheres Myokardinfarktrisiko als Teilnehmerinnen, die keinen Diabetes entwickelten; im Zeitraum nach der Diagnose lag das relative Risiko (RR) bei 3,79 – jeweils adjustiert für Body Mass Index, Rauchen und andere kardiovaskuläre Risikofaktoren. Ebenso war das Schlaganfallrisiko sowohl vor (RR = 2,30) als auch nach der Diabetesdiagnose (RR = 2,99) signifikant erhöht.
Neben den Risikofaktoren bzw. Risikomarkern des makrovaskulären Risikos geht auch das mikrovaskuläre Risiko der Manifestation des Typ-2-Diabetes voraus, wie dies für die Mikroalbuminurie (Mykkänen et al., Diabetes 1994), erhöhte und erniedrigte glomeruläre Filtrationsraten (Lorenzo et al., Diabetologia 2009) und für die Retinopathie (Alexander et al., Diabetes 2003) gezeigt wurde.
Diabetes alleine ist kein kardiovaskulärer Risikofaktor
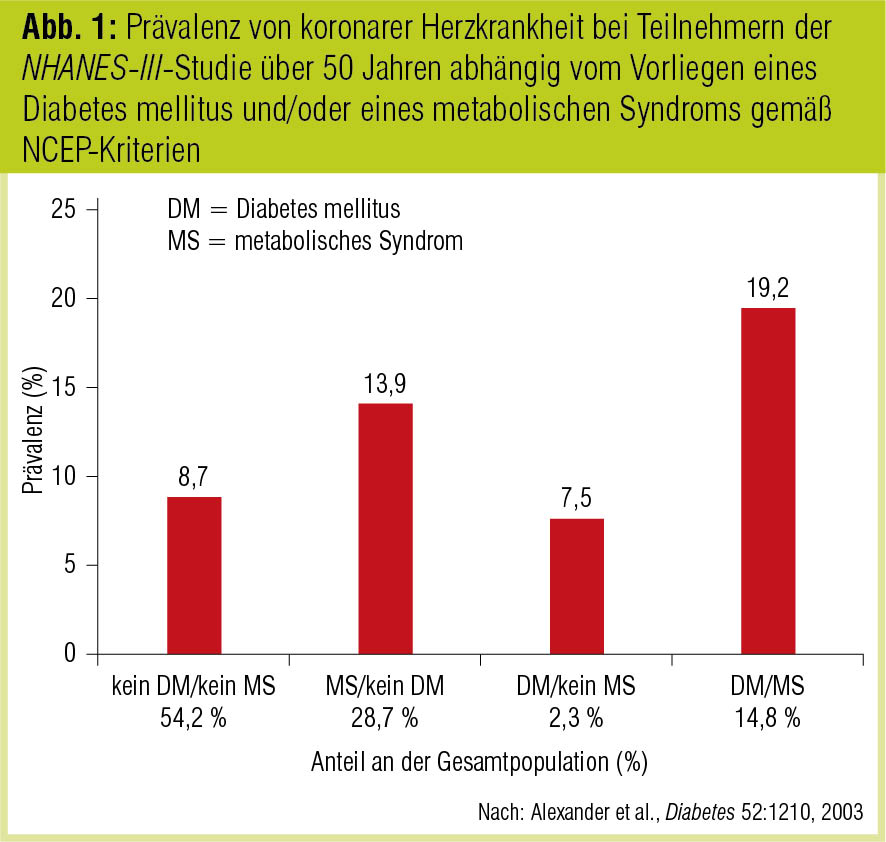
Interessant ist die Tatsache, dass in einer Analyse von über 50-jährigen Teilnehmern des NHANES-III-Survey das alleinige Vorliegen eines Diabetes ohne zusätzlich bestehendes metabolisches Syndrom das kardiovaskuläre Risiko nicht erhöhte (Alexander et al., Diabetes 2003). Kriterium für die Klassifikation als Diabetespatient war die Eigenanamnese oder ein Nüchternblutglukosewert von ≥ 126 mg/dl; für das metabolische Syndrom wurde die Definition des National Cholesterol Education Program (NCEP) herangezogen. Bei Diabetikern ohne metabolisches Syndrom lag die KHK-Prävalenz bei 7,5 % numerisch sogar unter der Prävalenz bei Nichtdiabetikern ohne metabolisches Syndrom, allerdings stellte diese Gruppe nur einen sehr kleinen Teil (2,3 %) des untersuchten Kollektivs (Abb. 1). Die höchste KHK-Prävalenz fand sich erwartungsgemäß bei Patienten mit Diabetes und metabolischem Syndrom. Allerdings erwies sich das metabolische Syndrom ebenso wenig als unabhängiger prädiktiver Parameter für eine prävalente KHK wie Hüftumfang, Triglyzeridspiegel oder Nüchternglukosespiegel. Erhöhtes HDL-Cholesterin und Hypertonie waren die relevantesten Prädiktoren und in ihrem prognostischen Wert Diabetes überlegen (Alexander et al., Diabetes 2003).
Chronische Inflammation und Prädiabetes
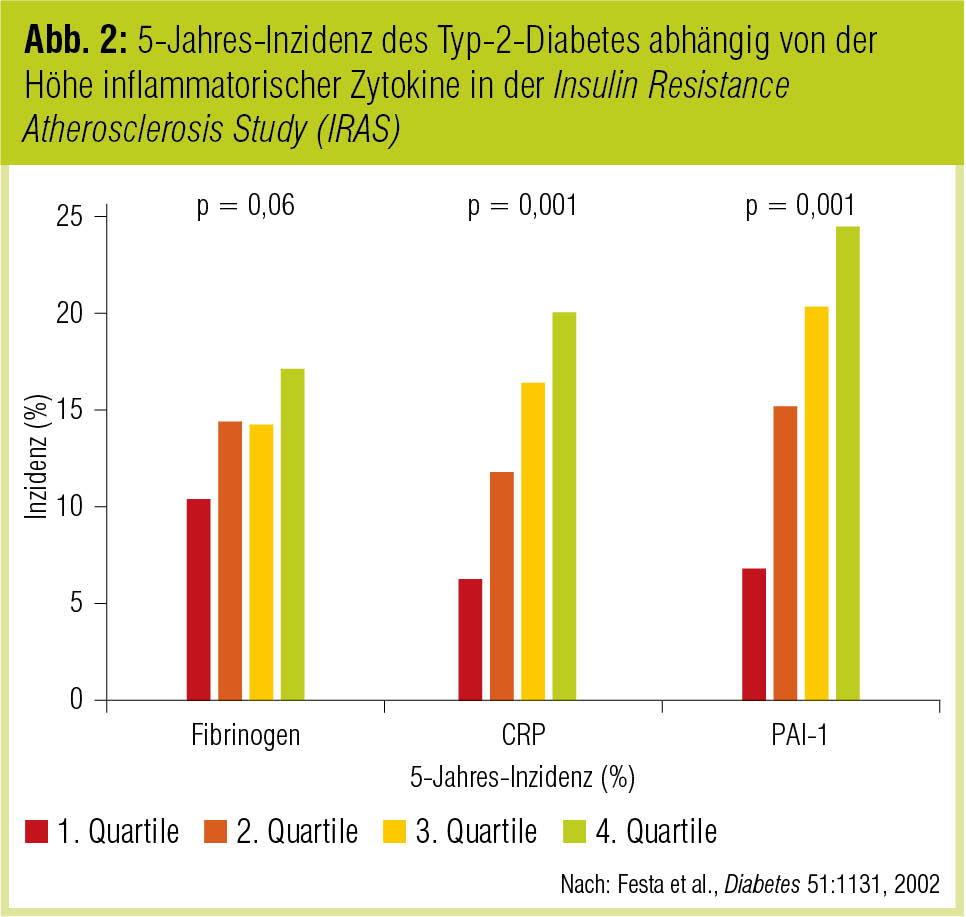
Für die atherogene Stoffwechsellage im Stadium des Prädiabetes sprechen auch Untersuchungen zum Zusammenhang zwischen dem proinflammatorischen C-reaktiven Protein (CRP) und Imbalancen des Stoffwechsel. So konnte gezeigt werden, dass die Höhe der CRP-Spiegel mit der Anzahl der Parameter des Insulinresistenzsyndroms (Dyslipidämie, Adipositas, Insulinresistenz, Hypertonie) korreliert (Festa et al., Circulation 2000). In der Insulin Resistance Atherosclerosis Study (IRAS) waren darüber hinaus CRP und Plasminogen-activator inhibitor 1 (PAI-1) signifikant mit der Diabetesinzidenz über 5 Jahre assoziiert (Festa et al., Diabetes 2002; Abb. 2).
Insulinresistenz: Bindeglied zwischen Diabetes- und Herz-Kreislauf-Risiko
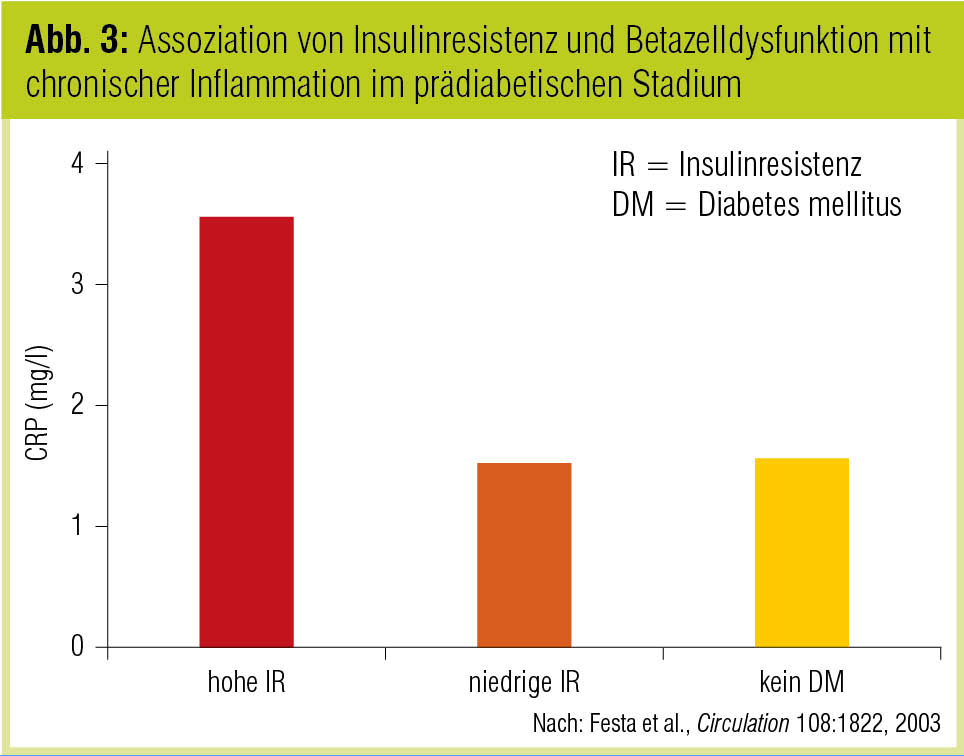
Das vermutlich grundlegende Bindeglied zwischen Diabetesrisiko und kardiovaskulärem Risiko ist die Insulinresistenz. In der San Antonio Heart Study war Insulinresistenz ein unabhängiger kardiovaskulärer Risikofaktor (Hanley et al., Diabetes Care 2002). Bei prädiabetischen Personen des IRAS-Kollektivs war eine ausgeprägte Insulinresistenz, nicht aber ein primärer Betazelldefekt mit einer proinflammatorischen Stoffwechsellage assoziiert (Festa et al., Circulation 2003; Abb. 3). Daraus wurde die Schlussfolgerung gezogen, dass Patienten mit Insulinresistenz die bevorzugte Risikogruppe für kardiovaskuläre Komplikationen darstellen und entsprechend in höherem Maß von kardiovaskulären Präventionsmaßnahmen profitieren als Prädiabetiker mit dominanter Insulinsekretionsstörung. Da die Korrelation zwischen Insulinresistenz und subklinischer Inflammation nicht durch den glykämischen Status beeinflusst war und durch Unterschiede im Körpergewicht – allerdings nicht statistisch signifikant – abgeschwächt wurde, würden Insulinresistenz und erhöhtes Körpergewicht die primären Interventionsziele im Rahmen präventiver Strategien darstellen, so die Autoren.
Weitere Determinanten des Diabetesrisikos
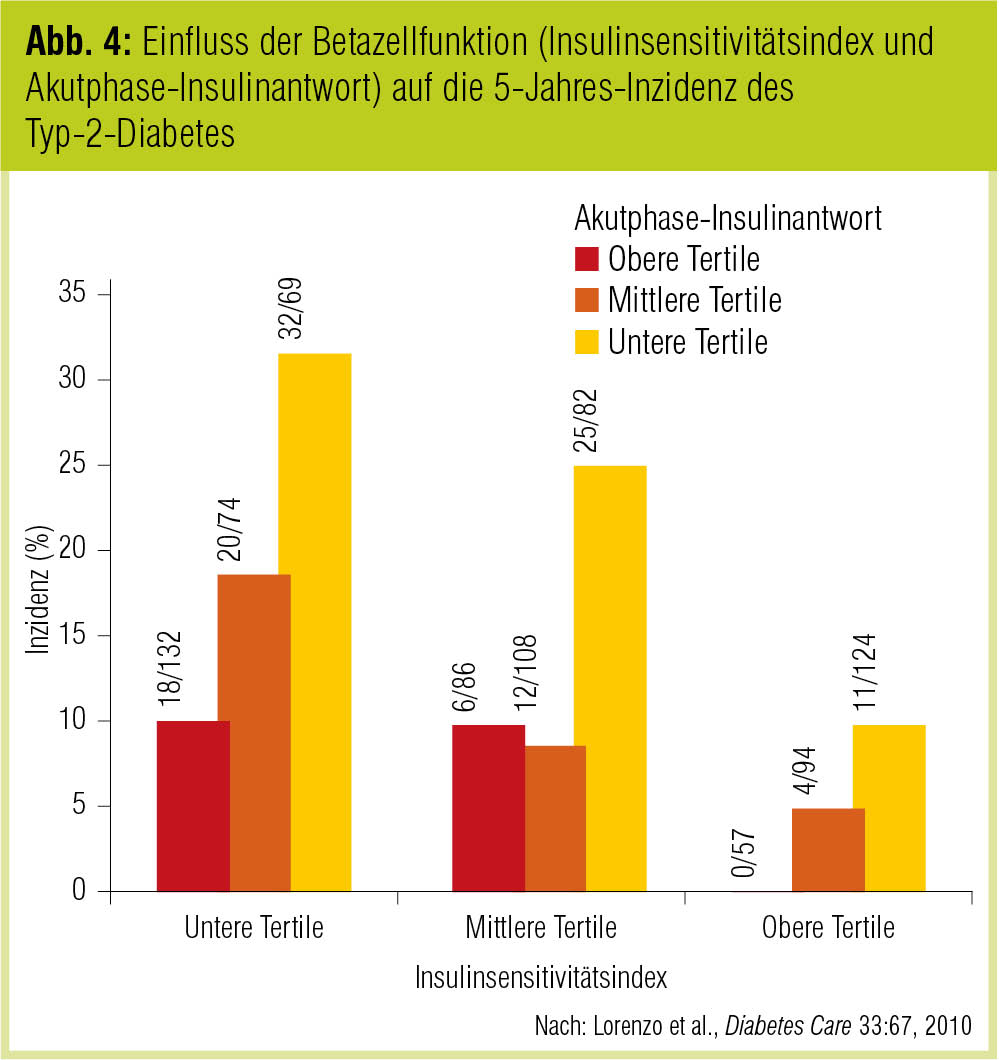
Gestörte Glukosetoleranz (IGT) ist ein wesentlicher Prädiktor für das Diabetesrisiko. In der San Antonio Heart Study war das Diabetesrisiko von Patienten mit metabolischem Syndrom bei gleichzeitigem Vorliegen einer IGT vervierfacht (Lorenzo et al., Diabetes Care 2003). Ebenso zeigte sich in der IRAS-Studie eine enge Assoziation zwischen IGT und Diabetesrisiko (Lorenzo et al., Diabetes Care 2010): So entwickelten von den insgesamt 826 Studienteilnehmern 15,5 % (7,9 % der Personen mit NGT vs. 31,2 % der Personen mit IGT zu Studienbeginn) einen Typ-2-Diabetes. Prädiktiv für das Diabetesrisiko waren Nüchternglukose, Zwei-Stunden-Wert im OGGT, Nüchterninsulin, HOMA-Insulinresistenz, Insulinsensitivitätsindex (ISI) und die unmittelbare Insulinantwort („acute-phase insulin response“, AIR). Abbildung 4 zeigt die Korrelation von ISI und AIR mit der Diabetesinzidenz im Verlauf von 5 Jahren. Das höchste Diabetesrisiko hatten Personen mit niedrigem ISI und niedriger AIR, während kein Patient mit ISI und AIR der jeweils unteren Tertile einen Typ-2-Diabetes entwickelte.
Als weiterer, dem CRP gleichwertiger unabhängiger Prädiktor für das Diabetesrisiko erwies sich in den IRAS-Analysen die Leberfunktion (Hanley et al., Diabetes 2004). So vervierfachten chronisch erhöhte Transaminasewerte bei Personen ohne Exposition gegenüber leberschädigenden Substanzen das Risiko für eine gestörte Glukosetoleranz, was den Schluss nahe legt, dass eine nichtalkoholische Fettlebererkrankung das Diabetesrisiko in ähnlichem Ausmaß steigert wie erhöhtes CRP.
Diabetesprävention versus KHK-Prävention
Auch wenn das Konzept der kardiovaskulären Prävention durch Verhinderung von Diabetesneuerkrankungen aus epidemiologischer Sicht bestechend erscheinen mag, so waren entsprechende Interventionen bisher wenig erfolgreich. Im Rahmen des Diabetes Prevention Program (DPP) konnte das Gewicht und die Diabetesinzidenz durch Metformin und noch weit deutlicher durch Lebensstilmodifikation gesenkt, nicht aber die Ereignisrate reduziert werden (Ratner et al., Diabetes Care 2005).
In der NAVIGATOR-Studie (NAVIGATOR Study Group, N Engl J Med 2010) konnten mittels einer Therapie mit Nateglinid in einem prädiabetischen Kollektiv weder neue Diabetesfälle noch kardiovaskuläre Endpunkte verringert werden, wobei die Studie im Rückblick in Bezug auf die glykämische Intervention wenig geeignet erscheint, diese Frage zu beantworten. Aber auch in den großen Endpunktstudien der vergangenen Jahre (ACCORD Study Group, N Engl J Med 2008; ADVANCE Collaborative Group, N Engl J Med 2008; VADT, Duckworth et al., N Engl J Med 2009) konnte mit einer intensiven glykämischen Kontrolle kein kardiovaskulär präventiver Effekt erzielt werden.
Die Frage, ob der fehlende Erfolg durch falsche Patientenselektion, zu kurze Studiendauer oder falsche Medikamentenwahl bedingt ist, bleibt unbeantwortet. De facto liegt das Risiko einer Konversion zum Typ-2-Diabetes bei Personen mit IGT oder mit gestörter Nüchternglukose bei 10 % pro Jahr, das Risiko für die Entwicklung einer KHK bei Personen mit IGT jedoch lediglich bei 1–2 % pro Jahr.
Als therapeutische Strategien für prädiabetische Patienten sind nach heutigem Erkenntnisstand aber primär verhaltenstherapeutische Ansätze für Patienten mit moderatem bis hohem Risiko, pharmakologische Therapien wie Metformin für jene mit sehr hohem Risiko und generell eine Intensivierung des kardiovaskulären Risikomanagements sinnvoll.