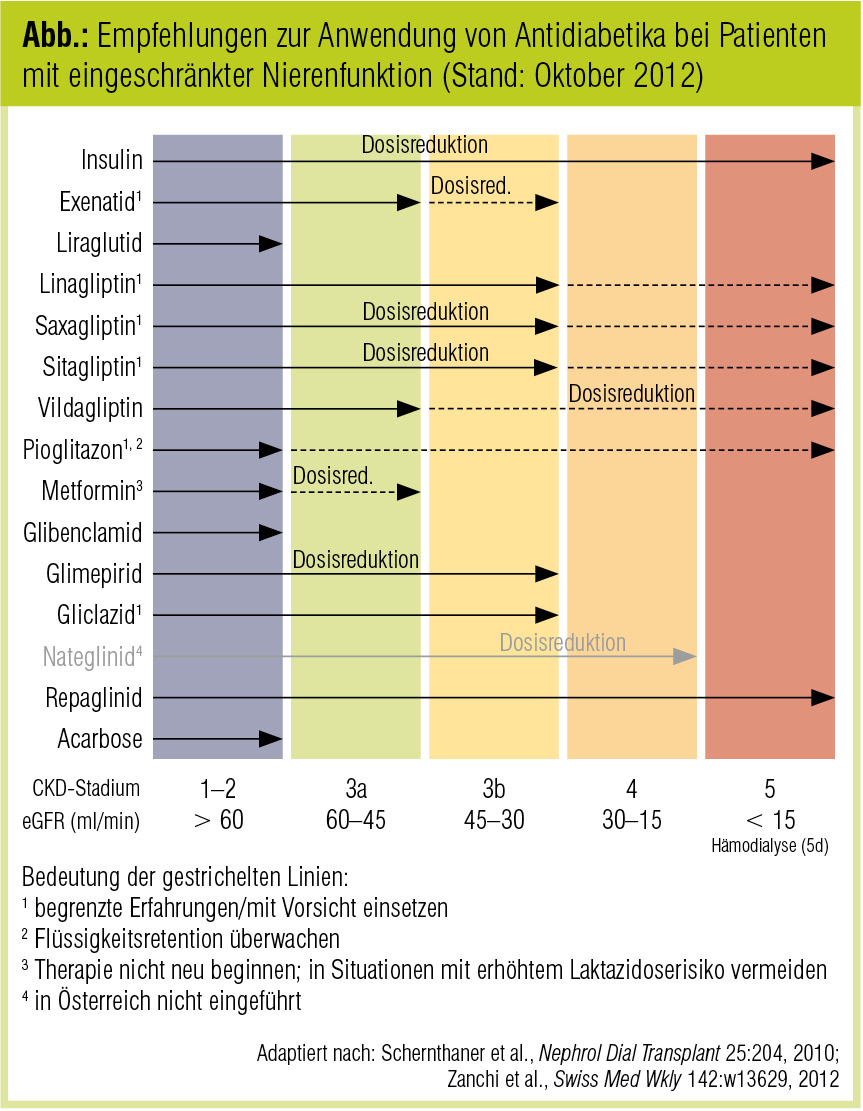
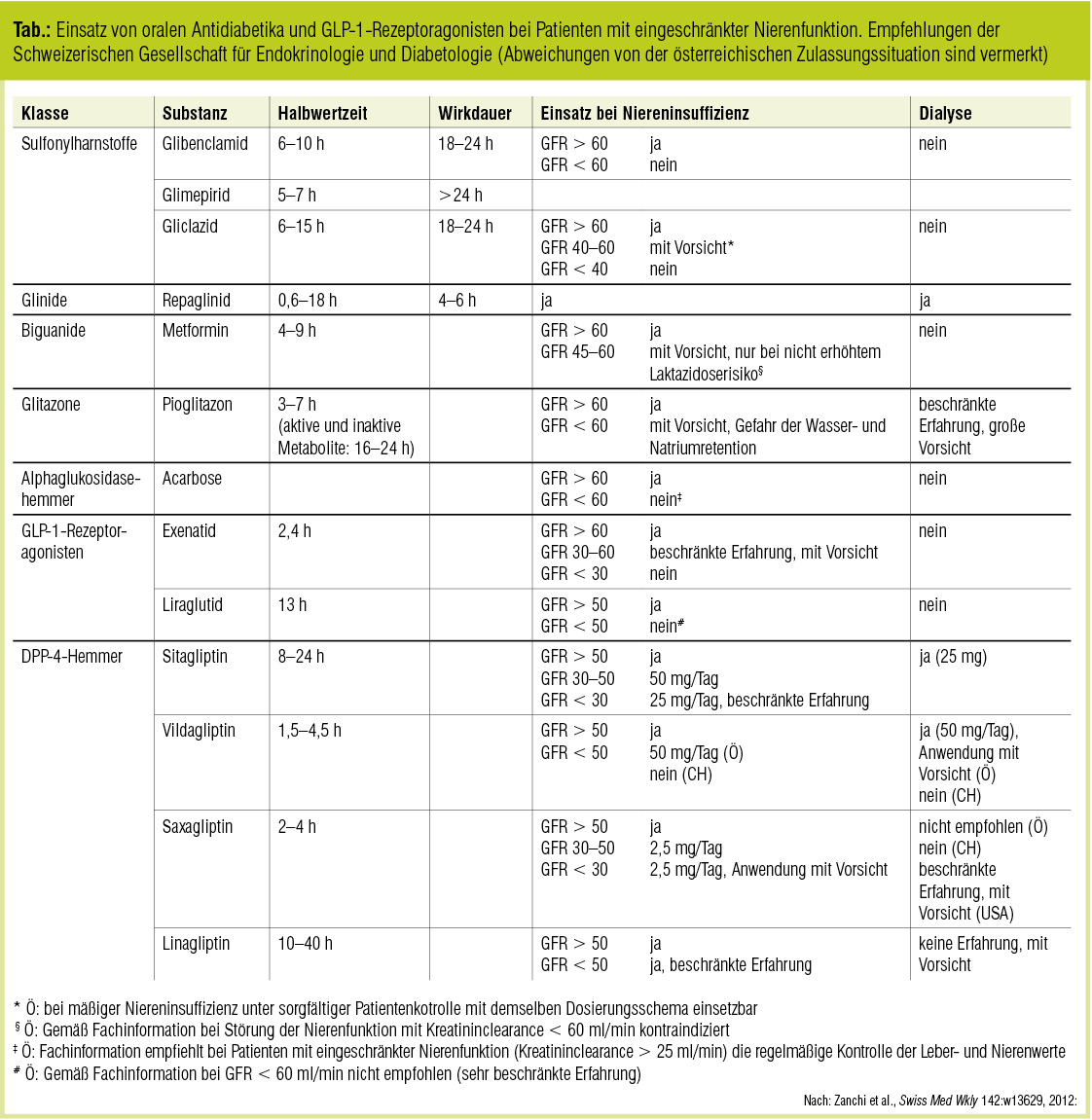
Möglichkeiten und Grenzen der antidiabetischen Therapie

Diabetiker haben ein mehr als 2,5-fach erhöhtes Risiko für eine chronische Nierenerkrankung (CKD) und eine dreifach erhöhte renale Mortalität (Fox et al., JAMA 2004; Seshasai et al., New Engl J Med 2011). Bei einer großen Zahl von Diabetikern muss daher im Erkrankungsverlauf mit dem Auftreten einer Niereninsuffizienz gerechnet werden. Häufig werden bei diesen Patienten therapeutische Anpassungen erforderlich, weil sich mit der Verschlechterung der Nierenfunktion die Pharmakokinetik etlicher Wirksubstanzen verändern kann; dies ist insbesondere dann relevant, wenn die glomeruläre Filtrationsrate (GFR) auf Werte von weniger als 60 ml/min abfällt (CKD-Stadium ≥ 3 gemäß KDOQI-Klassifikation; National Kidney Foundation, Am J Kidney Dis 2002). Entsprechend müssen einige Antidiabetika in ihrer Dosis reduziert werden, andere sind bei fortgeschrittener Nephropathie kontraindiziert und müssen abgesetzt werden.
Mit zunehmender klinischer Erfahrung und der Verfügbarkeit neuer Studiendaten haben sich in den vergangenen Monaten die Zulassungskriterien einiger Antidiabetika (insbesondere aus der Gruppe der DPP-4-Inhibitoren) für den Einsatz bei Patienten mit eigeschränkter Nierenfunktion geändert oder sind – wie im Fall von Metformin (siehe Beitrag Metformin bei Niereninsuffizienz) – in Diskussion. Im September 2012 hat die Schweizerische Gesellschaft für Endokrinologie und Diabetologie Empfehlungen zum Einsatz von antidiabetischen Arzneimitteln bei CKD publiziert (Zanchi et al., Swiss Med Wkly 2012). Diese werden im Folgenden in gekürzter und an die österreichischen Verhältnisse adaptierter Form wiedergegeben.
Renale Charakterisierung von Diabetespatienten
Die Nierenfunktion von Diabetikern sollte zumindest einmal jährlich anhand von Kreatininspiegel, geschätzter Filtrationsrate (eGFR) und Albumin-Kreatinin-Ratio im Harn überprüft werden (American Diabetes Association, Diabetes Care 2012). Während die Inzidenz der Proteinurie in den vergangenen Jahren durch strenger gefasste Blutzucker- und Blutdrucktherapieziele bei Diabetikern abgenommen hat (de Boer et al., JAMA 2011), lassen epidemiologische Daten aus dem NHANES-Programm keinen Rückgang der Inzidenz der Niereninsuffizienz, definiert als GFR < 60 ml/min, erkennen. Angesichts dieser überraschenden Ergebnisse wird gefordert, dass Diabetespatienten in renaler Hinsicht künftig besser charakterisiert werden und dass die Entwicklung neuer Substanzen mit alternativen Wirkmechanismen forciert wird.
Grundsätzliche Überlegungen
Die antiglykämische Therapie ist die einzige effektive Maßnahme zur Primärprävention der diabetischen Nierenerkrankung bei normoalbuminurischen normotensiven Patienten. Bei Patienten mit neu manifestiertem Typ-2-Diabetes in der UKPDS reduzierte die intensivierte Blutzuckersenkung sowohl die Inzidenz als auch die Progression der Mikroalbuminurie, unabhängig davon, welche Medikation zur Blutzuckerkontrolle – Metformin, Sulfonylharnstoffe (SH) oder Insulin – zum Einsatz kam (UKPDS Group, Lancet 1998). Bis zum heutigen Zeitpunkt konnte für kein einzelnes Antidiabetikum im Vergleich zu anderen Blutzuckersenkern eine Überlegenheit im Sinne einer Nephroprotektion demonstriert werden. Das Diabetesmanagement zielt daher in erster Linie darauf ab, eine HbA1c-Einstellung im Bereich von < 7 % zu gewährleisten und dabei sicherzustellen, dass die Nierenfunktion durch die Pharmakotherapie nicht beeinträchtigt wird (Snyder & Berns, Semin Dial 2004; Reilly & Berns, Semin Dial 2011).
Niereninsuffizienz ist einer der Hauptrisikofaktoren für Hypoglykämie. Unter den verfügbaren oralen Antidiabetika sind Sulfonylharnstoffe und Glinide mit dem höchsten Hypoglykämierisiko assoziiert. Werden SH mit Insulin kombiniert, steigt dieses Risiko um mehr als das 14-Fache (Bodmer et al., Diabetes Care 2008). Besondere Relevanz hat dieser Aspekt im Zusammenhang mit dem Lenken von Verkehrsmitteln. So sind bei Patienten mit therapiebedingt (SH, Glinide, Insulin) erhöhtem Hypoglykämierisiko regelmäßige Blutzuckerkontrollen erforderlich, um Blutglukosespiegel von > 5 mmol/l (90 mg/dl) sicherzustellen.
Sulfonylharnstoffe
SH-Derivate der ersten Generation wie das noch in der UKPDS verwendete Chlorpropamid oder Tolbutamid werden aufgrund des Risikos für prolongierte Hypoglykämien heute nicht mehr verwendet. Im Vergleich dazu haben SH der zweiten Generation – Glibenclamid (= Glyburid), Glimepirid und Gliclazid – kürzere Halbwertszeiten (HWZ), wobei die Wirkdauer dennoch bis zu 24 Stunden betragen kann. Die hypoglykämischen Effekte der SH kommen schneller zum Tragen und sind stärker ausgeprägt als jene von Metformin oder Rosiglitazon, können im Therapieverlauf aber auch schneller nachlassen (ADOPT-Studie, Kahn et al., New Engl J Med 2006).
Das SH-induzierte Hypoglykämierisiko bei Patienten mit CKD basiert primär auf der Akkumulation von aktiven Metaboliten. Dazu kommen weitere Faktoren wie Falschdosierung, Auslassen von Mahlzeiten, Malnutrition, exzessiver Alkoholkonsum, Leberfunktionseinschränkung, Herzinsuffizienz, hohes Alter und Arzneimittelinteraktionen (z. B. Azetylsalizylsäure, Sulfonamide, Gemfibrozil, Warfarin), die mit SH um Plasmaproteinbindungsstellen konkurrieren.
Glibenclamid (übliche Dosierung: 2,5–10 mg/Tag) wird hepatisch metabolisiert und zu etwa gleichen Teilen über Galle und Harn eliminiert. Bei Patienten mit CKD können dennoch aktive Metaboliten akkumulieren (weil die hepatobiliäre Elimination den Abfall der renalen Eliminationskapazität teilweise kompensiert) und schwere, über 24 Stunden andauernde Hypoglykämien auslösen. Glibenclamid sollte daher schon bei geringgradiger CKD (eGFR 60–90 ml/min) mit Vorsicht eingesetzt werden und ist bei eGFR-Werten von < 60 ml/min (CKD-Stadium 3 oder höher) kontraindiziert.
Glimepirid (1–8 mg/Tag). Einer von zwei hepatischen Metaboliten, die bei Niereninsuffizienz akkumulieren können, ist hypoglykämisch aktiv. Trotz kurzer HWZ (5–7 Stunden) kann Glimepirid Hypoglykämien auslösen, die über 24 Stunden bestehen bleiben. Glimepirid sollte bei geringgradiger CKD dosisreduziert verabreicht werden und ist in Österreich bei eGFR < 60 ml/min kontraindiziert.
Gliclazid MR (30–120 mg/Tag) wird hepatisch zu glykämisch inaktiven Metaboliten abgebaut und weist daher ein geringeres Risiko für schwere Hypoglykämien auf als Glimepirid (z. B. GUIDE-Studie; Schernthaner et al., Eur J Clin Invest 2004) oder Glibenclamid. Daten bei Patienten mit schwerer Niereninsuffizienz fehlen. Studien zeigen bei GFR von > 40 ml/min weder pharmakokinetische Veränderungen noch ein Risiko für Hypoglykämien. Gemäß Fachinformation kann bei Patienten mit einer leichten bis mäßigen Niereninsuffizienz unter sorgfältiger Patientenkontrolle dasselbe Dosierungsschema verwendet werden wie bei Nierengesunden.
Glinide
Glinide zeigen im Vergleich zu SH einen rascheren Wirkeintritt und kürzere Wirkdauer sowie eine geringere antihyperglykämische Potenz. Auch das Hypoglykämierisiko ist geringer als jenes der SH.
Repaglinid (0,5–12 mg/Tag) als einziger verfügbarer Vertreter der Substanzklasse (Nateglinid wurde in Österreich nicht eingeführt) wird hepatisch metabolisiert und zu weniger als 10 % renal ausgeschieden. Bei Patienten mit eingeschränkter Nierenfunktion verlängert sich die HWZ der Substanz leicht und die totale Plasmaclearance ist reduziert. Dennoch kann Repaglinid bei Patienten mit CKD und unter Dialysetherapie eingesetzt werden. Die präprandial verabreichte Dosis von 0,5–4 mg sollte in Abhängigkeit vom postprandialen Blutzuckeransprechen titriert werden. Die Einstellung soll laut Fachinformation mit Vorsicht erfolgen.
Metformin
Metformin (500–2.550 mg/Tag) ist international als antidiabetische First-Line-Therapie des Typ-2-Diabetes etabliert (Inzucchi et al., Diabetologia 2012). Primäre Wirkmechanismen sind die Hemmung der hepatischen Glukoseproduktion sowie die Verbesserung der insulinmediierten peripheren Glukoseverwertung.
Metformin wird unverändert in den Nieren über glomeruläre Filtration und tubuläre Sekretion eliminiert. Bei Niereninsuffizienz kann es zu einer Akkumulation von Metformin kommen, was mit einem geringen Risiko (Inzidenz: 5/100.000 Patientenjahre) für die Entwicklung einer Laktazidose mit potenziell fatalem Ausgang in Zusammenhang gebracht wurde (wenngleich ein Kausalzusammenhang niemals eindeutig nachgewiesen wurde; Lipska et al., Diabetes Care 2011). Aus diesem Grund ist Metformin laut Fachinformation bei akuten Störungen der Nierenfunktion sowie bei CKD mit einer Kreatininclearance < 60 ml/min kontraindiziert.
Nach den aktuellen Schweizerischen Empfehlungen ist Metformin im Fall von Erbrechen, Diarrhö und anderen dehydrierenden Ereignissen und ebenso vor Verabreichung jodhältiger Kontrastmittel abzusetzen. Patienten, bei denen unter Metformintherapie die eGFR unter 60 ml/min abfällt, sollten unter großer Vorsicht und regelmäßiger (mehr als einmal jährlicher) Evaluierung der Nierenfunktion beobachtet werden; bei GFR von < 45 ml/min sollte Metformin ebenfalls abgesetzt werden. Zu beachten ist außerdem, dass ein Magenbypass die Bioverfügbarkeit von Metformin um 50 % erhöht (Lipska et al., Diabetes Care 2011). Bei diesen Patienten sollte die Metformin-Dosis bereits bei leichter Einschränkung der Nierenfunktion verringert werden.
Einen Überblick über die Studienevidenz und aktuelle Empfehlungen zum Einsatz von Metformin bei CKD gibt der Beitrag Metformin bei Niereninsuffizienz.
Pioglitazon
Glitazone ermöglichen über die Verbesserung der Insulinresistenz in Leber, Fettgewebe und Muskulatur eine anhaltende Blutzuckerkontrolle. Relevant im renalen Zusammenhang ist, dass Pioglitazon (und ebenso das aus Gründen der kardiovaskulären Sicherheit vom Markt genommene Rosiglitazon) bei einem Teil der Patienten (5–15 %) zu einer Natrium- und Wasserretention führt, die durch Niereninsuffizienz verstärkt wird. Weiters ist die Glitazontherapie, vor allem bei postmenopausalen Frauen, mit einem erhöhten Frakturrisiko assoziiert.
Pioglitazon (15–45 mg/Tag) erfordert bei Niereninsuffizienz keine Dosisanpassung, da die Pharmakokinetik durch eine eingeschränkte Nierenfunktion nicht beeinflusst wird. Bei Patienten mit CKD sollte Pioglitazon aber aufgrund des Risikos einer Natrium- und Wasserretention und der Entwicklung einer Herzinsuffizienz bei eGFR < 60 ml mit großer Vorsicht eingesetzt werden. Die Daten zur sicheren Anwendung von Pioglitazon bei Dialysepatienten sind derzeit begrenzt, der Einsatz ist gemäß Fachinformation nicht empfohlen.
Alphaglukosidaseinhibitoren
Acarbose und die Spaltprodukte werden rasch und vollständig über die Nieren ausgeschieden. Acarbose (50–300 mg/Tag) kann laut Fachinformation bei Störungen der Nierenfunktion mit einer Kreatininclearance von ≥ 25 ml/min eingesetzt werden, wobei Leber- und Nierenwerte regelmäßig kontrolliert werden sollen. Von der Schweizerischen Gesellschaft für Endokrinologie und Diabetologie wird die Verwendung von Acarbose bei Patienten mit eingeschränkter Nierenfunktion aufgrund des Akkumulationsrisikos und der eingeschränkten Erfahrung nicht empfohlen.
GLP-1-Rezeptoragonisten
GLP-1-Rezeptoragonisten (GLP-1-RA) haben einen diuretischen Effekt, der Niereninsuffizienz besonders bei Patienten, die mit Hemmern des Renin-Angiotensin-Systems oder mit Diuretika behandelt werden, verstärken kann. Gastrointestinale Nebenwirkungen der GLP-1-RA (Erbrechen) können das Extrazellulärvolumen weiter verringern und akutes Nierenversagen auslösen. Bei Diabetikern mit fortgeschrittener Nierenerkrankung besteht oft eine autonome Neuropathie, welche die gastrointestinalen GLP-1-Nebenwirkungen verstärkt. Dennoch kann die Verwendung von GLP-1-RA bei Patienten mit CKD fallweise erwogen werden.
Exenatid BID (5–10 μg 2-mal täglich), Exenatid OW (2 mg 1-mal wöchentlich): Bei Patienten mit leichter bis mäßiger Nierenfunktionseinschränkung ist die Clearance von Exenatid um 13 % bzw. 36 % verringert, bei Patienten mit hochgradiger Nierenfunktionseinschränkung um 84 %.
Gemäß Fachinformation ist bei leichter Nierenfunktionseinschränkung (Kreatininclearance 50–80 ml/min keine Dosisanpassung von Exenatid BID erforderlich. Bei Patienten mit einer GFR zwischen 30 ml/min und 60 ml/min sollte Exenatid BID mit großer Vorsicht und in geringer Dosierung angewendet werden, da die Inzidenz und Intensität von gastrointestinalen Nebenwirkungen steigt. Bei Patienten mit terminaler Niereninsuffizienz oder einer schweren Nierenfunktionsstörung (Kreatininclearance < 30 ml/min) wird die Anwendung nicht empfohlen.
Die Anwendung von Exenatid OW wird ab dem CKD-Stadium 3 (GFR < 60 ml/min) nicht mehr empfohlen.
Liraglutid (0,6–1,8 mg 1-mal täglich): Bei Patienten mit geringgradiger Niereninsuffizienz ist keine Dosisreduktion notwendig, da sich die Halbwertszeit von Liraglutid selbst bei schwerer Niereninsuffizienz nicht verlängert, und die Clearance nicht verringert ist. Die Anwendung von Liraglutid bei Patienten mit moderater oder schwerer Niereninsuffizienz ist dennoch kontraindiziert, da Erfahrungen mit Liraglutid bei diesen Patientengruppen fehlen.
DPP-4-Hemmer (Gliptine)
Gliptine sind eine heterogene Substanzgruppe mit unterschiedlichen chemischen und pharmakokinetischen Eigenschaften.
Sitagliptin (100 mg/Tag) zeigt starke Plasmabindung und wird überwiegend (zu 87 %) unverändert über den Urin ausgeschieden. In Studien fand man bei Patienten mit leichter, mittelgradiger oder schwerer Niereinsuffizienz bzw. Dialysepatienten im Vergleich zu Kontrollpersonen 1,7-, 2,3-, 3,8- bzw. 4,5-fach erhöhte Sitagliptin-Plasmaspiegel. Entsprechend korreliert die HWZ von Sitagliptin mit dem Ausmaß der Niereninsuffizienz.
Bei Patienten mit GFR > 50 ml/min ist keine Dosisanpassung notwendig. Bei GFR 30–50 ml/min muss die Dosis auf die Hälfte reduziert werden (50 mg/Tag). Für Patienten mit GFR < 30 ml/min liegt die Sitagliptindosis bei 25 mg/Tag, die klinische Erfahrung bei diesen Patienten ist allerdings sehr beschränkt.
Vildagliptin (50–100 mg/Tag): Bei Patienten mit moderater bis schwerer Niereninsuffizienz ist die Vildagliptin-Exposition erhöht, wobei das Ausmaß der Exposition nicht mit dem Schweregrad der Nierenfunktionseinschränkung korreliert. Vildagliptin kann bis zu einer Kreatininclearance > 50 ml/min ohne Dosiseinschränkung eingesetzt werden. Unter einer Kreatininclearence von 50 ml/min ist eine Dosisanpassung auf 50 mg einmal täglich vorzunehmen.
In der Schweiz ist Vildagliptin bei moderater und schwerer Niereninsuffizienz kontraindiziert. Eine rezente Studie deutet aber darauf hin, dass Vildagliptin 50 mg auch in diesem Setting effektiv ist und gut vertragen wird (Lukashevich et al., Diabetes Obes Metab 2011). Die Europäische Arzneimittelbehörde hat Vildagliptin (50 mg) unter entsprechender Vorsicht auch bei Patienten mit terminaler Niereninsuffizienz unter Dialysetherapie zugelassen.
Saxagliptin (5 mg/Tag) wird primär renal ausgeschieden; ca. 20 % der verabreichten Dosis finden sich unverändert im Harn, 20–50 % in Form von glykämisch aktiven Metaboliten.
Bei Patienten mit leichter Nierenfunktionseinschränkung war die Exposition gegenüber Saxagliptin um das 1,2-Fache und gegenüber den Hauptmetaboliten um das 1,7-Fache im Vergleich zu Kontrollen erhöht, bei moderater Niereninsuffizienz um das 1,4- bzw. 2,9-Fache und bei Patienten mit schwerer Niereninsuffizienz um das 2,1- und das 4,5-Fache. Daher ist bei Patienten mit leichter Niereninsuffizienz (CrCl > 50 ml/min) keine Dosisanpassung notwendig, während die Dosis bei Patienten mit moderater und schwerer (mit Vorsicht) Niereninsuffizienz auf 2,5 mg reduziert werden muss. Bei Patienten mit terminaler Niereninsuffizienz ist die Anwendung von Saxagliptin derzeit nicht empfohlen, obwohl rezente Daten darauf hinweisen, dass die Substanz auch in diesem Kollektiv effektiv und gut verträglich ist (Nowicki et al., Diabetes Obes Metab 2011).
Linagliptin (5 mg/Tag) ist bei Patienten in jedem Stadium der Niereninsuffizienz ohne Dosisanpassung einsetzbar.
Resümee
Die Evaluierung der Nierenfunktion und die Anpassung der Therapie an die GFR und die pharmakologischen Daten der Antidiabetika sind ein wesentlicher Bestandteil des Managements des Typ-2-Diabetes. Die Empfehlungen müssen laufend an die Erkenntnisse aus größeren randomisierten Studien mit längeren Nachbeobachtungszeiten angepasst werden.