Revaskularisation und antithrombotische Therapie bei Diabetikern
Obwohl die koronare Herzkrankheit (KHK) weltweit noch immer die häufigste Todesursache darstellt, konnte in den letzten Jahrzehnten ein deutlicher Rückgang der Morbidität und Mortalität beobachtet werden (Rosamond et al., Circulation 2008). Dieser Erfolg ist auf eine Reduktion der kardialen Risikofaktoren wie arterielle Hypertonie, Hyperlipidämie und Nikotinkonsum durch Optimierung der Primären Sekundärprophylaxe zurückzuführen. Dem gegenüber steht allerdings eine zunehmende Inzidenz von Diabetes mellitus (Hardoon et al., Circulation 2008; Ford et al., N Engl J Med 2007). Die häufigste Todesursache bei Typ1 und Typ-2 Diabetikern ist die KHK: Verglichen mit der Allgemeinbevölkerung haben Diabetespatienten ein zwei bis vierfach erhöhtes Risiko, an kardiovaskulären Komplikationen wie dem akuten Myokardinfarkt zu versterben (Haffner et al., N Engl J Med 1998). Wenn man den oben beschriebenen Rückgang der KHK Inzidenz und die gleichzeitige Zunahme des Diabetes mellitus bedenkt, so versteht man, warum Diabetiker einen zunehmenden Anteil der KHK Patienten einnehmen (ESC/EASD Guidelines on diabetes, prediabetes, and cardiovascular diseases; Rydén et al., Eur Heart J 2007). Laut rezenter Registerdaten sind bereits ein Drittel aller Patienten mit perkutaner Koronarintervention (PCI) Diabetiker (Novack et al., Catheter Cardiovasc Interv 2009). Da Diabetespatienten selbst unter optimaler antidiabetischer Therapie nicht nur eine erhöhte Inzidenz für KHK besitzen, sondern auch ein signifikant schlechteres Outcome nach einem kardiovaskulären Ereignis haben, rückt diese Patientenpopulation und eine Optimierung des therapeutischen Managements zunehmend in den Fokus der interventionellen Kardiologie.
Spezifika der Gefäßbiologie
Eine metabolische Dysregulation im Rahmen von Diabetes mellitus führt zu direkten und indirekten schädlichen Effekten auf das Gefäßsystem. Dabei werden zwischen mikrovaskulären (diabetische Nephropathie, Neuropathie und Retinopathie) und makrovaskulären Komplikationen (KHK, periphere und zerebrale arterielle Verschlusskrankheit) unterschieden. Während mikrovaskuläre Komplikationen durch eine adäquate Einstellung des Blutzuckerspiegels signifikant reduziert werden können, kann auch unter optimaler Therapie keine signifikante Reduktion makrovaskulärer Komplikationen beobachtet werden. Dieser mangelnde protektive Effekt impliziert einen weiteren, nicht glukoseabhängigen Mechanismus in der Progression von Atherosklerose und dem Auftreten makrovaskulärer Komplikationen.
Der Effekt von oxidativem Stress und der Einfluss eines unter schwankenden Insulinspiegeln veränderten Proteinmetabolismus auf die Entwicklung von Atherosklerose ist derzeit Gegenstand zahlreicher Studien. Darüber hinaus konnte im Gefäßsystem von Patienten mit Diabetes eine Störung der Endothelfunktion, Inflammation mit verstärkter Proliferation der glatten Muskelzellen sowie eine Thromboseneigung bei gestörter Plättchenfunktion beobachtet werden (Craeger et al., Circulation 2003).
Klinisch zeigt sich, dass Diabetiker unabhängig von der gewählten Reperfusionsstrategie, einer PCI oder einem aortokoronaren Bypass (ACBP) ein schlechteres Outcome mit erhöhten Restenoseund Verschlussraten haben (Hlatky et al., Lancet 2009). Intravaskuläre Ultraschallanalysen der Koronarien von Patienten mit Diabetes zeigten, dass die Koronargefäße diffuse, längerstreckige, stärker kalzifizierte Läsionen mit einer höhere Plaquemasse sowie neurotischem Kern besitzen (Marso et al., JACC Cardiovasc Imaging 2012). Weiters zeigten sich bei Diabetikern ausgedehnte atherosklerotische Veränderungen mit einem größeren Prozentsatz an Mehrgefäßerkrankungen sowie Hauptstammbeteiligungen. Eine rezent publizierte Studie konnte mittels Magnetresonanzangiographie eine geringere Dehnbarkeit der Koronargefäße bei Patienten mit Diabetes beobachten (Lin, Radiology 2011).
Basierend auf der veränderten Gefäßbiologie gilt es, bei Diabetikern sowohl das interventionelle Management als auch die antithrombotische Therapie entsprechend zu adaptieren.
Stabile koronare Herzkrankheit
Entsprechend den aktuellen Leitlinien der Europäischen Gesellschaft für Kardiologie (ESC) unterscheidet sich das Management bei stabiler KHK für Patienten mit und ohne Diabetes kaum voneinander (Wijns et al., Eur Heart J 2010). Sowohl für Diabetiker als auch Nichtdiabetiker mit stabiler KHK gilt, dass bei komplexer KHK mit Hauptstammbeteiligung, proximaler „Left anterior descending“Stenzes (LAD-Stenose) oder Mehrgefäßerkrankung eine Revaskularisierung mittels PCI oder ACBP empfohlen wird. Für Patienten mit einer stabilen und weniger komplexen KHK zeigten sowohl die BARI 2D Studie (Frye et al., New Engl J Med 2009) als auch der COURAGETrial (Boden et al., New Engl J Med 2007) diabetesunabhängig keinen Vorteil der PCI gegenüber einem konservativen Prozedere mit optimaler medikamentöser Therapie (OMT).
Bei der Frage nach der geeigneten Reperfusionsstrategie hingegen gibt es für Diabetiker gegenüber den Nichtdiabetikern eine eindeutigere Studienlage. Die SYNTAX Studie untersuchte die Fragestellung, ob Patienten mit komplexer KHK mehr von einer PCI mit einem Paclitaxeleluierenden Stent (PES) oder einem ACBP profitieren. Während in der ACBP Gruppe im Vergleich zur PCI kein Überlebensvorteil beobachtet werden konnte, so zeigte sich bereits im Followup nach einem Jahr eine deutliche Reduktion an kardiovaskulären Events für Patienten mit ACBP (Banning et al., J Am Coll Cardiol 2010). Die Reduktion der kardiovaskulären Events in der ACBP Gruppe ist in erster Linie auf eine geringere Anzahl an notwendigen Revaskularisierungen zurückzuführen. Ein Überlebensvorteil nach ACBP gegenüber PCI konnte in einer großen Metaanalyse für diabetische Patienten beobachtet werden (Hlatky et al., Lancet 2009). Auch die bereits zitierte BARI 2D Studie konnte für Diabetiker zumindest im Vergleich ACBP gegenüber OMT einen signifikanten Vorteil hinsichtlich Mortalität und Myokardinfarkt zeigen. Zusammenfassend sollte bei diabetischen Patienten mit stabiler aber komplexer KHK die Bypassoperation favorisiert werden. Ob sich dieser Vorteil des ACBP auch gegenüber der PCI mit Stents der neusten Generation bestätigen wird, gilt es abzuwarten.
Akutes Koronarsyndrom ohne ST-Hebungen
Im Rahmen des Euro Heart Survey (Dotevall et al., Diabet Med 2005) zeigte sich, dass 37% aller Patienten mit akutem Koronarsyndrom ohne ST Hebungen (NSTEACS) entweder bereits einen bekannten Diabetes haben oder es wird im Rahmen des Ereignisses Diabetes neu diagnostiziert. NSTEACS-Patienten mit Diabetes leiden statistisch an mehr Komorbiditäten wie arterielle Hypertonie und Niereninsuffizienz und präsentieren sich häufig mit atypischen Beschwerden. Atypische Beschwerden können epigastrische Schmerzen, Magen Darm Beschwerden, allgemeines Unwohlsein oder Schwindel sein, die häufig zu einer verzögerten Diagnosefindung beitragen. Im weiteren Verlauf entwickeln die Patienten mehr Komplikationen wie kardinale Dekompensation oder Blutungen (Dotevall et al., Diabet Med 2005) und haben eine doppelt so hohe Mortalitätsrate post NSTEACS (Donahoe et al., JAMA 2007). Diese Daten zeigen, dass Diabetiker eine Hochrisikopopulation darstellen, die ein besonders aggressives Management benötigen. Dies bestätigte der TACTICS-TIMI-18Trial (Cannon et al., New Engl J Med 2007), der für Diabetiker mit einer Risikoreduzierung von 27 % einen noch größeren Benefit von einem frühen invasiven Management aufzeigte als für Nichtdiabetiker (8 %). Die klinische Routine zeigt jedoch, dass Diabetiker verglichen mit Nichtdiabetikern sowohl medikamentös als auch interventionell häufig zurückhaltender behandelt werden (Hasin et al., Am J Cardiol 2009). Erklärungen dafür können das fortgeschrittene Alter und die oft stumme Ischämie der diabetischen Patienten sein. Ein restriktiveres interventionelles Management ist mit den oft diffus stenosierten Koronargefäßen und der Angst vor hohen Restenoseund Verschlussraten zu erklären (Cannon et al., New Engl J Med 2007).
Die aktuellen Leitlinien der ESC empfehlen bei Patienten mit NSTEACS dringend eine invasive diagnostische Abklärung mittels Koronarangiographie (Hamm et al,. Eur Heart J 2011). Entscheidend für den Zeitpunkt der Koronarangiographie sind das klinische Erscheinungsbild und das Risikoprofil des Patienten. Die Risikostratifizierung des Patienten soll entsprechend der Leitlinien bereits auf der Notfallambulanz durchgeführt werden und entscheidet über dringende (< 120 Min. nach erstem Arztkontakt), frühe (< 24 Std.) oder elektive (< 72 Std.) PCI. Bei fehlendem Schmerzrezidiv, keinen Anzeichen einer Herzinsuffizienz, normalem EKG und negativem Troponin wird keine routinemäßige Angiographie empfohlen. Neben dem etablierten GRACE-Risk-Score zählt unter anderem auch Diabetes mellitus zu den wichtigen Kriterien, die in die Entscheidungsfindung über den Zeitpunkt der Angiographie mit eingehen (Tab. 1, Tab. 2). Nachdem auch Blutungen einen entscheidenden prognostischen Faktor im Rahmen des NSTEACS darstellen, gilt es, neben dem ischämischen Risiko auch das Blutungsrisiko abzuschätzen. Das mit Diabetes assoziierte erhöhte Blutungsrisko findet entsprechend Berücksichtigung im CRUSADE-Risiko-Score für Blutungen (Subherwal et al., Circulation 2009).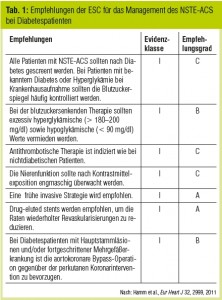
Akutes Koronarsyndrom mit ST-Hebungen
Basierend auf Subanalysen (Hochman et al., N Engl J Med 2006; Timmer et al., Arch Intern Med 2007; Subherwal et al., Circulation 2009) geben die ESC-Leitlinien für Patienten mit akutem Koronarsyndrom und ST-Hebungen (STEACS) – mit oder ohne Diabetes – das gleiche therapeutische Management vor: Bei Patienten mit einem Symptombeginn vor weniger als 12 Stunden wird die schnellstmögliche Reperfusionstherapie empfohlen. Grundsätzlich ist die primäre PCI die bevorzugte Therapieoption gegenüber der Fibrinolyse, wenn die Zeit vom ärztlichen – meist prähospitalen – Erstkontakt bis zur Wiedereröffnung des Infarktgefäßes innerhalb von zwei Stunden möglich ist (Tab. 3). Sollte eine primäre PCI in diesem Zeitfenster nicht möglich sein, so wird eine Fibrinolyse empfohlen. Für Patienten mit einem chronischen Koronargefäßverschluss konnte eine PCI 3–28 Tage nach Myokardinfarkt keinen klinischen Benefit gegenüber der OMT zeigen (Hochman et al., New Engl J Med 2006) .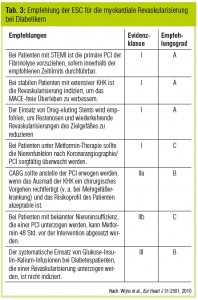
Drug-eluting Stent oder Bare Metal Stent?
Grundsätzlich konnte wie bei Nichtdiabetikern auch bei Diabetespatienten eine Überlegenheit von Drugeluting Stents (DES) gegenüber Bare Metal Stents (BMS) beobachtet werden. Bei Unterbrechung der dualen Antiplättchentherapie nach sechs Monaten steigt jedoch bei Diabetikern die Mortalität nach DES-Implantation signifikant gegenüber BMS an (Stettler et al., BMJ 2008). Aus diesem Grunde ist die Abschätzung der Compliance des Patienten sowie eine genaue Evaluierung möglicher zukünftiger operativer Eingriffe, die eine Unterbrechung der dualen Antiplättchentherapie erfordern, von besonderer Wichtigkeit. Sollten Zweifel an einer Fortführung der dualen Antiplättchentherapie über 12 Monate bestehen, ist bei Diabetikern ein BMS eindeutig zu bevorzugen. Dennoch konnte selbst bei Patienten mit Diabetes unter OMT eine höhere Rate an Stentthrombosen sowie Restenosen beobachtet werden (Kuchulakanti et al., Circulation 2006; Elezi et al., J Am Coll Cardiol 2010). Auch wenn das Outcome von Diabetespatienten durch die Entwicklung der DES verbessert werden konnte, so stellt diese Population noch immer eine Risikogruppe dar.
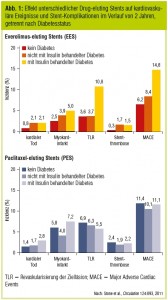
Die veränderte Gefäßbiologie bei Diabetikern wirft die Frage auf, ob es einen maßgeschneiderten DES für diese Patienten gibt. Eine rezent publizierte Studie verglich verschiedene DES bezüglich ihrer Sicherheit und Effektivität in einem Zwei-Jahres-Followup (Stone et al., Circulation 2006, Abb. 1). Während bei Nichtdiabetikern der Everolimuseluting Stent (EES) dem PES in harten Endpunkten wie Mortalität, Stentthrombose, Myokardinfarkt und Revaskularisierung überlegen war, konnte bei Diabetikern kein Unterschied gefunden werden. Es ist zwar zu diskutieren, ob für Patienten mit Diabetes der Beobachtungszeitraum von zwei Jahren zu kurz angesetzt ist, da eine symptomgetriggerte Revaskularisierung aufgrund der bei Diabetikern häufig stummen Ischämie möglicherweise erst zu einem späteren Zeitpunkt manifest wird. Auffällig ist jedoch, dass auch der Vorteil des EES hinsichtlich einer deutlichen Reduktion von Stentthrombosen und Myokardinfarkten zur Gänze in der diabetischen Population verloren geht. Auch in der ESSENCE- DIABETES-Studie (Kim et al., Circulation 2011) kann der bei Nichtdiabetikern beobachtete Benefit eines Zweitgenerations-EES gegenüber dem Sirolimuseluting Stent (SES) bei Diabetespatienten nicht beobachtet werden (Tab. 4). Subanalysen, die insulinabhängigen mit nicht-insulinabhängigem Diabetes verglichen, zeigten hingegen einen Unterschied für EES und PES: Während der EES verglichen mit PES eine signifikante Reduktion der notwendigen Revaskularisierungen für nichtinsulinabhängige Diabetiker aufwies, zeigte der PES eine Überlegenheit in diesem Endpunkt für Patienten mit insulinabhängigem Diabetes (Stone et al., Circulation 2011; Abb. 1).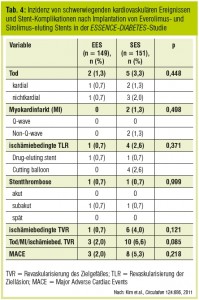
Zusammenfassend deutet die derzeitige Studienlage darauf hin, dass bei Patienten mit Diabetes im Koronargefäß spezielle inflammatorische, prothrombotische und proliferative Prozesse ablaufen, die ein schlechteres Ansprechen auf die handelsüblichen DES zeigen. Zum jetzigen Zeitpunkt gibt es keinen idealen Stent für Diabetiker, aber die Suche nach dem maßgeschneiderten Stent hat längst begonnen. Neben neuen Medikamentenbeschichtungen werden derzeit auch polymerfreie Stents sowie Stents mit biodegradablem Polymer oder Gerüst evaluiert.
Antithrombotische Therapie
Bei Patienten mit ACS ist die Einleitung einer antithrombotischen Therapie unumstritten. Der Beginn der Therapie sollte so früh wie möglich erfolgen. Nachdem sich für das lang routinemäßig verwendete Clopidogrel eine große Variabilität hinsichtlich der Thrombozytenfunktionshemmung herausstellte, sind in den letzten Jahren neue Substanzen wie Prasugrel und Ticagrelor auf den Markt gekommen (siehe Beitrag ab Seite 34). Während die initiale Gabe von Azetylsalizylsäure als Kautablette für alle Patienten mit ACS, sofern keine Kontraindikationen bestehen, empfohlen wird, soll der zweite Thrombozytenaggregationshemmer entsprechend dem klinischen Gesamtbild individuell gewählt werden. Nach den aktuellen ESC-Leitlinien gibt es hinsichtlich der antithrombotischen Therapie für Diabetiker mit ACS keine gesonderten Empfehlungen (Wijns et al., Eur Heart J 2010; Hamm et al,. Eur Heart J 2011). Dennoch zeigt eine Vielzahl an Studien für Diabetespatienten ein erhöhtes thrombotisches Risiko. Es konnten verschiedene Mechanismen für eine erhöhte Thrombozytenaktivität bei Patienten mit Diabetes nachgewiesen werden (Farhan et al., Herz 2012). Thrombozyten exprimieren auf ihrer Oberfläche Insulinrezeptoren, die über Steuerung des Kalziumeinstroms die Thrombozytenaktivität hemmen. In diabetischen Patienten mit Insulinresistenz ist dieser Mechanismus gestört, sodass die Thrombozyten eine erhöhte Aktivität aufweisen. Des Weiteren wurde in Thrombozyten von Patienten mit Diabetes bei einer großen Menge des hochpotenten Vasokonstriktors Thromboxan A2 eine gestörte Produktion des Vasodilatators Stickstoffmonoxid gefunden. Auch die verstärkte Ex-Nachpression von P-Selectin und des GlykoproteinIIb/ IIIa–Rezeptors (GPIIb/ IIIa) auf Thrombozyten führen zu einem prothrombotischen Zustand.
Diese Erkenntnisse führen zu der Frage, ob Diabetespatienten im Rahmen eines ACS von einer verstärkten antithrombotischen Therapie profitieren. Einige klinische Studien gingen dieser Fragestellung bereits nach und verglichen verschiedene Dosen Azetylsalizylsäure (Capodanno et al., Circ Cardiovasc Interv 2011) bzw. Clopidogrel (Mehta et al., Landet 2010) bei Patienten mit Diabetes miteinander. Es konnte zwar für höhere Dosierungen eine signifikante Reduktion der Thrombozytenaktivität und der ischämischen Ereignisse beobachtet werden, aber bei einer gleichzeitigen Assoziation mit erhöhtem Blutungsrisiko (Mehta et al., Lancet 2010) werden derzeit höhere Dosierungen von den Leitlinien nicht empfohlen.
Die neuen Thrombozytenaggregationshemmer Prasugrel und Ticagrelor zeigen mit ihrer effizienteren Thrombozytenfunktionshemmung bei Diabetikern ein besonders gutes Ansprechen. Sowohl eine Substudie des TRITON-TIMI-38-Trials für Prasugrel (Wilviott et al., Circulation 2008) als auch eine Substudie des PLATO-Trials für Ticagrelor (James et al., Eur Heart J 2010) zeigten das beste Ansprechen hinsichtlich einer Reduktion der Stentthromboseraten und des kombinierten Endpunkts (kardiovaskulärer Tod, Myokardinfarkt und Insult) bei Diabetikern. Da diese beiden Substanzen auch für nichtdiabetische ACE-Patienten empfohlen werden, gibt es für Diabetiker in den ESC-Leitlinien keine speziellen Empfehlungen. Eine rezent publizierte Studie verglich indirekt Ticagrelor mit Prasugrel in Patienten mit ACS (BiondiZoccai et al., Int J Cardiol 2011). Während Ticagrelor mit weniger Blutungsereignissen verbunden war, konnte für Prasugrel eine effizientere Senkung der Stentthromboseraten und ein besseres Ansprechen bei Akut-PCI beobachtet werden. Die Autoren schlussfolgern, dass Prasugrel aufgrund dieser Eigenschaften möglicherweise im STEACS und NSTEACS von Hochrisikopatienten zu bevorzugen ist. Um diese Hypothese zu belegen, müssen aber große randomisierte Studien abgewartet werden, die diese beiden Substanzen direkt miteinander vergleichen. Derzeit wird von Seiten der ESC sowohl für Ticagrelor als auch für Prasugrel im STEACS und NSTEACS die gleiche Empfehlung ausgesprochen.
Trotz der verstärkten Expression von GPIIb/ IIIa-Rezeptoren auf Thrombozyten in diabetischen Patienten wird die routinemäßige Verwendung von GPIIb/ IIIa-Rezeptorantagonisten in Patienten mit ACS nicht empfohlen. Ein Überlebensvorteil, der für diabetische Patienten mit NSTEACS unter frühzeitiger Gabe von GPIIb/ IIIa-Rezeptorantagonisten in einer Metaanalyse aufgezeigt wurde (Roffi et al., Circulation 2001), bestätigte sich in der EARLY-ACS-Studie (Giuliano et al., N Engl J Med 2009) nicht.