SARS-CoV-2 und Stoffwechsel: Risikoeinschätzung und Pathomechanismen
Aufgrund von Beeinträchtigungen der angeborenen Immunität weisen Menschen mit Diabetes mellitus ein im Vergleich zur Gesamtbevölkerung erhöhtes Risiko für Infektionen auf.1
Dieser Zusammenhang wurde bereits in epidemiologischen Untersuchungen der H1N1-Influenza- und MERS-CoV-Epidemien dokumentiert.2, 3 Anhand der derzeitigen Datenlage dürfte diese negative Assoziation im Fall einer Infektion mit SARS-CoV-2 allerdings nicht zutreffen: So zeigte etwa eine Metaanalyse von 33 Studien mit über 16.000 Patienten, dass 9,8 % der inkludierten Patienten mit COVID-19 auch einen Diabetes mellitus aufwiesen.Eine weitere Analyse, die über 80 Studien mit mehr als 78.000 Patienten im stationären Setting umfasste, ergab eine Diabetesprävalenz von 14,3 %, wobei diese bei Patienten über 60 Jahren (23,3 %) gegenüber jüngeren Patienten (8,8 %) deutlich höher lag.4, 5
Was jedoch aus Studien hervorging, ist der Einfluss von Diabetes auf Erkrankungsverlauf und Mortalität: Demnach wiesen Patienten mit Diabetes ein mehr als zweifach höheres Risiko für einen schweren Verlauf (charakterisiert durch Intensivpflichtigkeit, Entwicklung eines ARDS, invasive Beatmung; OR 2,75) und ein zweifach höheres Mortalitätsrisiko (OR 1,90) auf.4, 5 Zahlreiche Untersuchungen widmen sich nunmehr der Frage, ob die schlechtere Prognose dieser Patienten auf den Diabetes per se zurückzuführen ist oder ob diabetesassoziierte Komorbiditäten und Risikofaktoren die ausschlaggebenden Einflussfaktoren darstellen.
Patienten mit COVID-19 und Diabetes mellitus weisen im Vergleich zur nichtdiabetischen COVID-19-Kohorte deutlich öfter weitere Komorbiditäten wie Hypertonie (56,9 vs. 28,8 %), kardio- (20,9 vs. 11,1 %), und zerebrovaskuläre Erkrankungen (7,8 vs. 1,3 %) auf, wie aus einer retrospektiven Analyse hervorgeht.6 Gleichzeitig stellen diese und weitere Komorbiditäten (z. B. chronische Lungenerkrankung) in der diabetischen Kohorte unabhängige Risikofaktoren für eine erhöhte Mortalität dar, während diese Assoziation bei nichtdiabetischen Patienten nicht festgestellt werden konnte.6
Potenzielle prognostische Marker
Die französische Beobachtungsstudie CORONADO evaluierte die Daten von 1.317 hospitalisierten COVID-19-Patienten mit manifestem Diabetes mellitus in Hinblick auf klinische und biologische Charakteristika, die in Ergänzung zu Diabetes potenzielle Risikofaktoren für den primären Studienendpunkt (tracheale Intubation und/oder Tod innerhalb von 7 Tagen nach Aufnahme) darstellen könnten. Der BMI zum Zeitpunkt der Aufnahme wurde als unabhängiger Risikofaktor für den primären Outcome identifiziert, während höheres Alter, Schlafapnoe, mikro- und makrovaskuläre Komplikationen mit einem erhöhten Risiko für Tod innerhalb von 7 Tagen nach Aufnahme darstellten.7 In einer britischen Studie zeigte sich, dass Patienten mit Typ-1-Diabetes (OR 3,51) ein höheres COVID-19-Mortalitätsrisiko aufweisen als Personen mit Typ-2-Diabetes (OR 2,03).8 Aus einer Kohortenstudie, in der die schottische Gesamtbevölkerung erfasst wurde, ging zudem hervor, dass Nikotinabusus, Polypharmazie (antidiabetisch und andere) sowie diabetesassoziierte Komplikationen wie Retinopathie, Niereninsuffizienz, unzureichende glykämische Kontrolle, diabetische Ketoazidose und Hospitalisierung aufgrund einer Hypoglykämie innerhalb der letzten 5 Jahre das Risiko für einen tödlichen oder schweren Verlauf zusätzlich erhöhen.9
Einflussfaktoren genauer betrachtet
Hyperglykämie: Bislang gingen aus Studien heterogene Ergebnisse in Hinblick auf den Zusammenhang von glykämischer Kontrolle und Prognose hervor, wobei der Zeitpunkt im Krankheitsverlauf (vor, bei und während der stationären Aufnahme) zu berücksichtigen ist.10
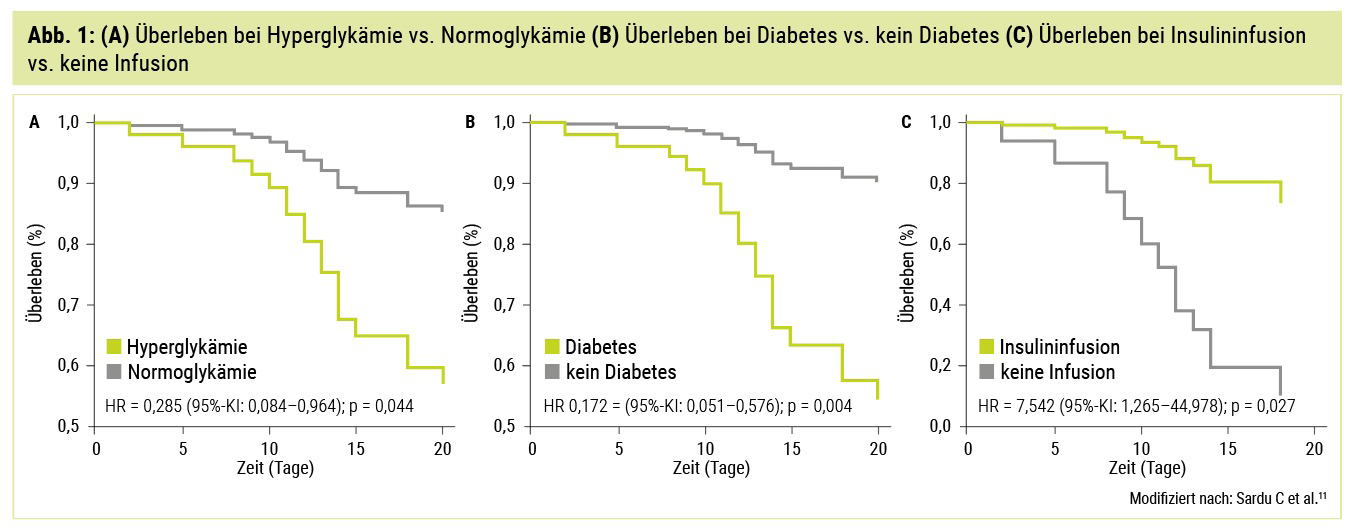
Insgesamt ist eine unzureichende glykämische Kontrolle bei stationärer Aufnahme und während der Hospitalisierung mit einem ungünstigen Outcome assoziiert. Zudem kann die direkte Beeinträchtigung der Betazellfunktion durch SARS-CoV-2 bei Patienten mit vorbestehendem Diabetes zu einer raschen Verschlechterung der metabolischen Kontrolle bzw. bei bislang stoffwechselgesunden Personen zu einer Diabetesneumanifestation führen.10 Eine Studie, die den Effekt einer Hyperglykämie in Bezug auf die systemische Inflammation (mittels Interleukin-6, IL-6) und Koagulation (mittels D-Dimer) untersuchte, zeigte einen positiven Einfluss einer besseren glykämischen Kontrolle auf systemische Inflammation und Outcome; Insulininfusionen waren in dieser Studie mit einer geringeren Mortalitätsrate assoziiert (Abb. 1).11
Adipositas: Zahlreiche Studien zeigten eine Assoziation zwischen Adipositas, ungünstigem COVID-19-Verlauf und erhöhter Mortalität (Abb. 2).6, 7, 12 In der CORONADO-Studie waren erhöhte BMI mit einer erhöhten Rate an Intubation und/oder Mortalität innerhalb von 7 Tagen nach stationärer Aufnahme assoziiert (OR 1,28). Entsprechend dem „Obesity Paradox“ war der Effekt bei morbid adipösen Patienten (Grad 3, BMI ≥ 40 kg/m2) im Vergleich zu Patienten mit Übergewicht oder Grad-1–2-Adipositas weniger ausgeprägt.7
Mögliche Ursachen für schlechtere Outcomes umfassen die Beeinträchtigung der invasiven Beatmung durch abdominelles Fettgewebe, den sowohl bei Menschen mit Adipositas als auch Diabetes vorliegenden prothrombotischen Zustand sowie die adipositasassoziierte Immundysregulation und systemische Inflammation.10 Die Überexpression von ACE2 im epikardialen Fettgewebe bei adipösen Patienten kann zudem die Virusinternalisierung in den Adipozyten und die Freisetzung von TNF-α und IL-6 begünstigen. Eine zusätzlich vorliegende nichtalkoholische Fettlebererkrankung dürfte weiter zu einer erhöhten Mortalität beitragen.13
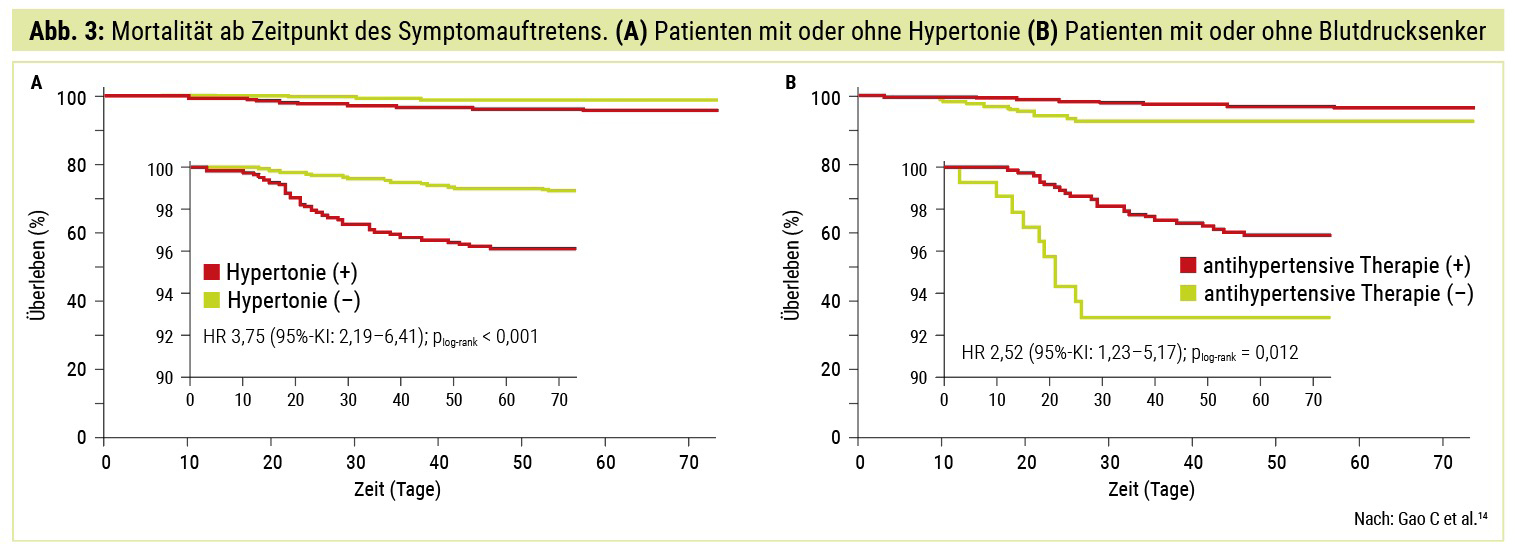
Hypertonie: Bluthochdruck stellt die häufigste Begleiterkrankung von COVID-19 sowie einen beträchtlichen Risikofaktor für ein erhöhtes Mortalitätsrisiko dar. So zeigte eine retrospektive Studie mit 2.877 hospitalisierten SARS-CoV-2-positiven Patienten, dass eine gleichzeitig vorliegende Hypertonie das Mortalitätsrisiko auf das Zweifache erhöht (4,0 % vs. 1,1 %; HR 2,12; p = 0,013). Patienten mit unbehandelter Hypertonie wiesen zudem ein signifikant höheres Mortalitätsrisiko auf als jene, die Blutdrucksenker einnahmen (7,9 % vs. 3,2 %, HR 2,17; p = 0,041) (Abb. 3).14
Zu Beginn der Pandemie wurde vermutet, dass die hohe Prävalenz auf den verbreiteten Einsatz von ACE-Inhibitoren in dieser Patientenkohorte zurückzuführen ist und diese Medikation durch die Stimulation der ACE2-Expression die Virusinternalisierung unterstützt. Diese Hypothese konnte bislang nicht belegt werden15, zudem gibt es Hinweise aus Studien und Metaanalysen, dass der Einsatz von RAAS-Hemmern die systemische Inflammation und das Risiko für einen schweren Verlauf sogar reduzieren könnte (relatives Risiko 0,65; p = 0,02).14, 16
Resümee
Ein schwerer Verlauf von COVID-19 ist durch üblicherweise innerhalb der 2. Erkrankungswoche einsetzendes ARDS, disseminierte intravaskuläre Koagulation in Kombination mit Zytokinsturm und Hyperkoagulabilität gekennzeichnet. Die mit COVID-19 assoziierten venösen und arteriellen thromboembolischen Erkrankungen sind u. a. auf Inflammation, Hypoxie und disseminierte intravaskuläre Koagulation zurückzuführen; Diabetes mellitus kann zur Hyperkoagulabilität beitragen:
Patienten mit Diabetes mellitus befinden sich in einem prothrombotischen Zustand, in dem Inflammation und Hyperglykämie zu einer Überaktivierung der Thrombozytenfunktion und einer erhöhten Plasmakonzentration von Fibrinogen und anderen Gerinnungsfaktoren beitragen können. Die hyperglykämieassoziierte Entstehung von AGEs („advanced glycation end products“) und ROS („reactive oxygen species“) führt zu Endothelschädigungen und strukturellen Veränderungen des Von-Willebrand-Faktors, die thrombotische Angiopathien begünstigen können.
Des Weiteren kann Diabetes mellitus aufgrund struktureller Veränderungen der Lunge und herabgesetzter Lungenfunktion einen ungünstigen Effekt auf den Verlauf von Atemwegserkrankungen aufweisen.17
- Shah BR et al., Diabetes Care 2003; 26(2): 510–13
- Yang JK et al., Diabet Med 2006; 23: 623–28
- Alqahtani FY et al., Epidemiol Infect 2018; 147: 1–5
- Kumar A et al., Diabetes Metab Syndr 2020; 14(4): 535–545
- Mantovani A et al., Nutr Metab Cardiovasc Dis 2020; 30(8): 1236–1248
- Shi Q et al., Diabetes Care 2020; 43: 1382–91
- Cariou B et al., Diabetologia 2020; 63(8): 1500–1515
- Barron E et al., Lancet Diabetes Endocrinol 2020; 8(10): 813–22
- McGurnaghan SJ et al., Lancet Diabetes Endocrinol 2021; 9(2): 82–93
- Apicella M et al., Lancet Diabetes Endocrinol 2020; 8: 782–92
- Sardu C et al., Diabetes Care 2020; 43(7): 1408–1415
- Caussy C et al., Lancet Diabetes Endocrinol 2020; 8: 562–64
- Zheng KI et al., Metabolism 2020; 108: 154244
- Gao C et al., Eur Heart J 2020; 41(22): 2058–2066
- Mancia G et al., N Engl J Med 2020; 382: 2431–40
- Meng J et al., Emerg Microbes Infect 2020; 9: 757–60
- Pitocco D et al., Med Hypotheses 2020; 143: 109923