Stellenwert der Blutzuckerkontrolle im kardiorenalen Kontinuum
Diabetespatienten haben, insbesondere beim Hinzutreten einer Nierenkrankheit, ein erhöhtes Risiko für kardiovaskuläre Komplikationen. Der Einfluss der glykämischen Kontrolle auf kardiovaskuläre Komplikationen und das Überleben beim Diabetiker mit renaler Mitbeteiligung ist trotz vielfältiger, zumeist Registeranalysen mit widersprüchlichen Ergebnissen als nicht geklärt zu betrachten.
Die meisten Guidelines zur Blutzuckerkontrolle beziehen sich aber auf das Management von Patienten mit Mikroalbuminurie oder Proteinurie, d. h. auf Patienten in den Stadien 1 und 2 nach den KDOQI-Kriterien der National Kidney Foundation (Am J Kidney Dis 2002), mit einer geschätzten glomerulären Filtrationsrate (eGFR) von ≥ 60 ml/min. Wissenschaftlich wenig untersucht sind Überlegungen zum optimalen HbA1c-Wert in den KDOQI-Stadien 3 bis 4 (eGFR 15–59 ml/min). Hier existieren wenige bis keine Interventionsstudien, die den Stellenwert der HbA1c-Reduktion bzw. verschiedener Diabetestherapien (Insulin; Vergleich oraler Antidiabetika) und das optimale Vorgehen bezogen auf das Fortschreiten der Nierenerkrankung aus diabetologischer Sicht untersucht haben.
In Kontrast zu steigenden Patientenzahlen steht daher ein ausgeprägter Evidenzmangel. Dadurch findet sich der am Krankenbett tätige Arzt in einer frustrierenden Situation, da klinische Praxis und akademische Überlegungen sich in verschiedenen Studien und Guidelines oft unterschiedlich darstellen. In einem rezenten Editorial von Schernthaner et al. (Nephrol Dial Transplant 2010) mit der Überschrift „Strict glycaemic control in diabetic patients with CKD or ESRD: beneficial or deadly“ wird auf diese Problematik eingegangen.
Typ-1-Diabetes und eGFR ≥ 60 ml/min
Die wichtigste Studie, die belegt, das ein HBA1c um 7 % renale Komplikationen des Typ-1-Diabetes beeinflussen kann, ist der oft zitierte Diabetes Control and Complications Trial (DCCT) mit seiner Epidemiology of Diabetes Intervention and Complications (EDIC) titulierten Nachbeobachtungsphase; aus diesem Studienprojekt sind zuletzt einige Publikationen erschienen (DCCT/EDIC Research Group, New Eng J Med 2011; de Boer et al., Arch Intern Med 2011; Molitch et al., Diabetes Care 2010).
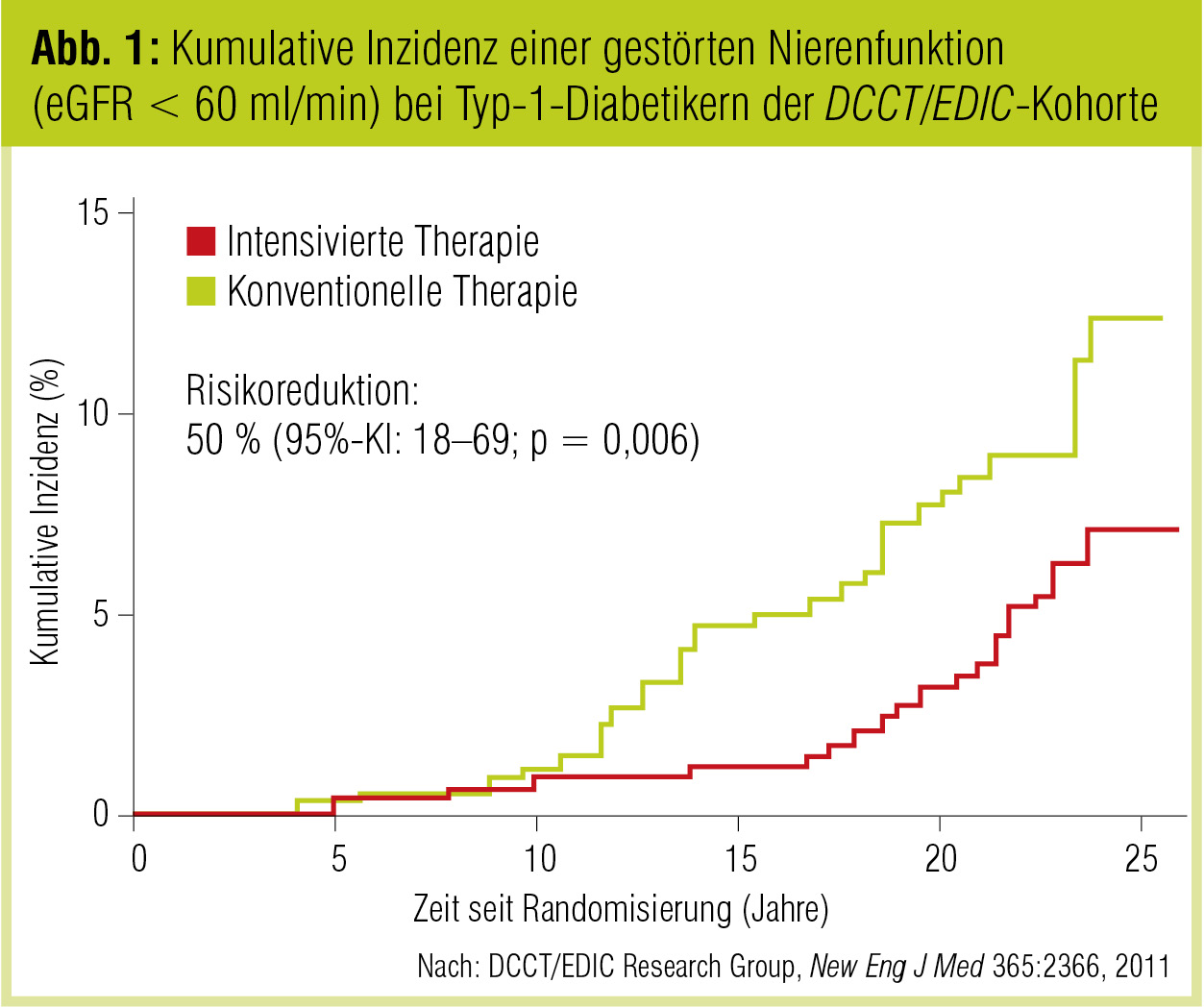
In der DCCT-Studie erhielten 1.441 Patienten randomisiert initial über 6,5 Jahre eine intensivierte (HbA1c < 8 %) oder eine konventionelle Insulintherapie (HbA1c 8–10 %) und wurden anschließend in der EDIC-Studie jährlich weiterverfolgt. Die Daten zeigen, das die intensivierte Therapie das Auftreten von Mikroalbuminurie als auch von Proteinurie verzögern oder verhindern kann. Die kürzlich publizierten Daten der EDIC-Studie konnten auch beweisen, dass über eine Periode von im Mittel 22 Jahren das Auftreten von renaler Insuffizienz (definiert als eGFR < 60 ml/min) um 50 % reduziert werden kann (Inzidenz: 24 Patienten in der intensivierten vs. 46 Patienten in der konventionellen Gruppe; 2 % vs. 5,5%; Abb. 1) Obwohl weniger Patienten in der intensivierten Gruppe ein terminales Nierenversagen entwickelten (8 vs. 16 Personen), war der Unterschied in diesem Punkt statistisch nicht signifikant.
Wenngleich sich in der EDIC-Phase die beiden Gruppen im Sinne der Qualität der Blutzuckerkontrolle annäherten (7,9 % vs. 8 %), waren diese vormaligen Langzeiteffekte aus der DCCT-Studie auf die Niere weiter nachweisbar. Die frühen Effekte metabolischer Kontrolle hatten also eine Langzeitauswirkung, ein Effekt, der in der Literatur als „metabolic memory“ bezeichnet wird. Trotz dieser langen Nachbeobachtungsdauer bleibt aber noch zu beweisen, ob es sich nur um ein „Verschieben“ des Auftretens – und sei es um Jahrzehnte – handelt. Auch in der Gruppe mit intensivierter Kontrolle konnte das Auftreten terminaler renaler Insuffizienz nicht vollständig verhindert werden, jedoch sind die Zahlen im Vergleich zu den vormalig noch in den 1990er-Jahren zur Epidemiologie der diabetischen Nephropathie publizierten deutlich geringer.
Typ-2-Diabetes und eGFR ≥ 60 ml/min
Eine verbesserte Blutzuckereinstellung per se kann auch beim Typ-2-Diabetiker in den initialen Phasen der Erkrankung einen Einfluss auf die Inzidenz der Mikroalbuminurie ausüben. Dies wurde in mehreren Studien gezeigt und oft zitiert, beispielhaft seien die Kumamoto-Studie (Shichiri et al., Diabetes Care 2000), die UKPDS 34 (UKPDS Group, Lancet 1998) sowie die Veterans Affairs Study (Levin et al., Diabetes Care 2000) angeführt.
In einer rezenten Metaanalyse von 7 Studien (Coca et al., Arch Intern Med 2012) wurden Kumamoto Study, UKPDS 33, UKPDS 34, Veterans Affairs Feasibility Trial, Veterans Affairs Diabetes Trial (VADT), ACCORD und ADVANCE nochmalig in Hinblick auf renale Endpunkte und intensivierte Blutzuckereinstellung analysiert. Die Beobachtungszeit in der Metaanalyse von 28.065 Patienten betrug 2–15 Jahre. Die medianen HbA1c-Werte waren in allen Studien in der intensivierten Therapiegruppe niedriger als in der Kontrollgruppe, mit einem Unterschied von mehr als einem Prozentpunkt in 4 Studien. Die kumulative Inzidenz von Kreatininverdopplung, terminalem Nierenversagen und Tod durch die renale Erkrankung war niedrig (4 %, 1,5 %, 0,5 %), verglichen mit dem Endpunkt Mikroalbuminurie und Makroalbuminurie (23 % bzw. 5%). Der Einfluss der intensivierten Therapie auf Mikro- und Makroalbuminurie war umso größer, je größer der erreichte HbA1c-Unterschied war. Kein Unterschied konnte aber für die anderen oben angeführten Endpunkte zwischen den Gruppen nachgewiesen werden.
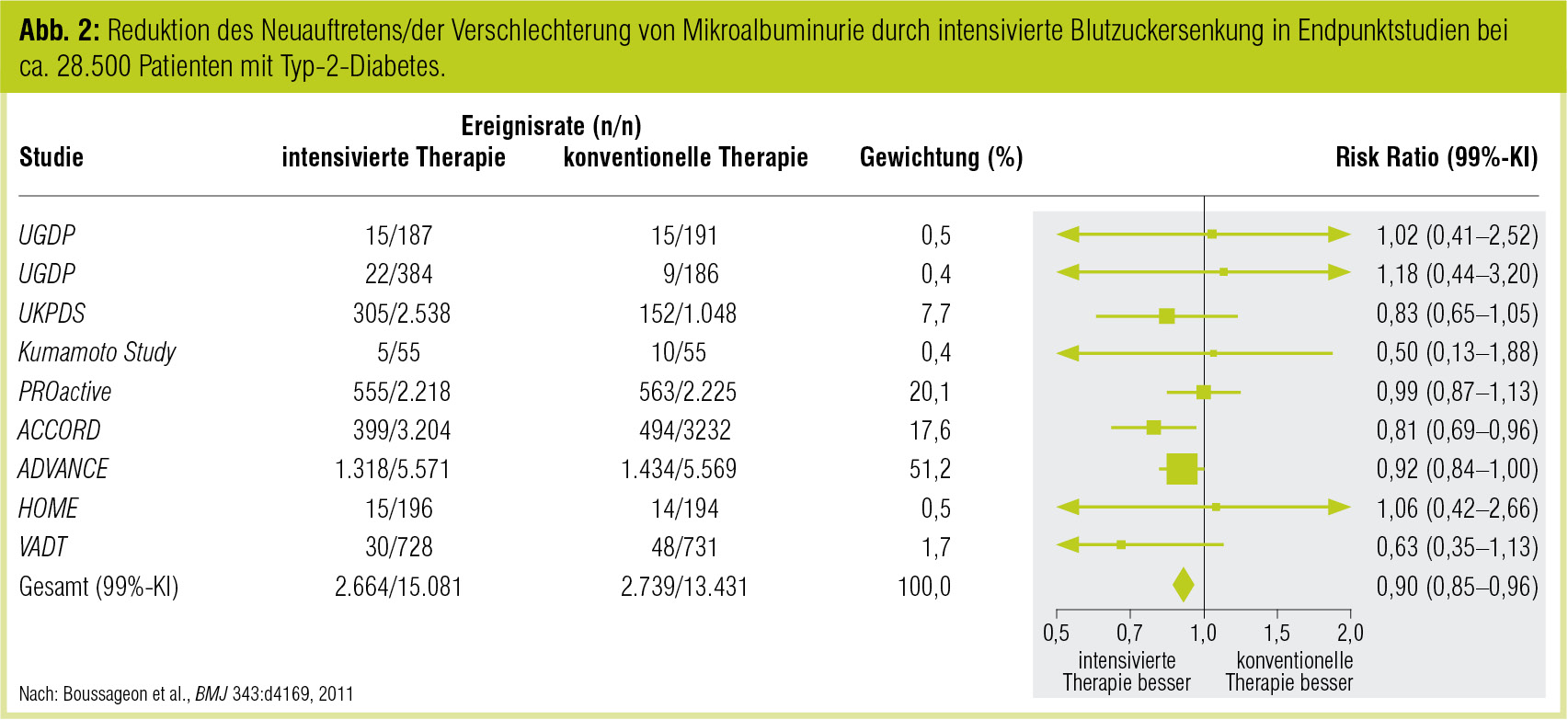
In einer ähnlichen Metanalyse mit 34.533 Typ-2-Diabetikern (Alter: 62 Jahre bei 7,8 Jahren Diabetesdauer) aus 13 Studien (Boussageon et al., BMJ 2011) werden ähnliche Schlüsse gezogen: Bei der Berechnung der Auswirkung der intensivierten Therapie auf die Mikroalbuminurie fand sich eine Risikoreduktion auf 0,9 (Abb. 2), bei einem allerdings 2,3-fach erhöhten Risiko für schwere Hypoglykämien. Gesamtmortalität und Tod aus kardiovaskulärer Ursache waren nicht unterschiedlich.
Diabetes und eGFR von 15–59 ml/min
Obwohl es bei fortgeschrittener renaler Insuffizienz zu einem drastischen Ansteigen des kardiovaskulären Risikos und der Mortalität kommt, fehlen größere Langzeitstudien mit klarer Zuordnung des HbA1c zu einem entsprechendem KDOQI-Stadium auf Basis der eGFR. Dagegen werden Untersuchungen zu Blutdruck (z. B. ONTARGET, AVOID), Cholesterin (z. B. SHARP) oder auch neuen Substanzen (z. B. Bardoxolon-Methyl, BEACON-Studie, rezent abgebrochen) bevorzugt in diesen Stadien durchgeführt, da ein Erreichen harter Endpunkte in einem absehbaren Zeitraum möglich ist. Hier fehlen gute Daten, die Hinweise darauf geben, ob man sich unabhängig von individuellen Rahmenbedingungen eher an den Zielwerten der KDOQI-Stadien 1–2 oder doch 5 orientieren sollte.
In der Primärprävention sind niedrigere HbA1c-Werte zu fordern als in fortgeschrittenen Stadien renaler Insuffizienz und Sekundärprävention. Hier hat sich ein HbA1c „Zielkorridor“ von 6,5–7,5 % als mit bestem Outcome korrelierend erwiesen, im KDOQI-Stadium 5d/Dialyse ein Bereich von 7–7,9 %. Unabhängig davon sollte aufgrund von Vorgeschichte, Komorbiditäten, Hypoglykämieneigung und Begleiterkrankungen insbesondere bei älteren Patienten eine individualisierte Festlegung der Therapieziele erfolgen. Das HbA1c ist in diesen Stadien jedoch nicht nur wichtig, um eine allfällige Progression der Niereninsuffizienz zu verhindern, es darf auch in dieser Situation nicht auf die Beeinflussung der Mikroangiopathie (Retinopathie, Neuropathie) durch eine gute Diabeteseinstellung vergessen werden.
Pharmakologische Aspekte
Bei nachlassender Nierenfunktion ist besonders das erhöhte Risiko der Hypoglykämie zu berücksichtigen. Die Wahl antidiabetischer und anderer Medikamente bedarf bei eingeschränkter Nierenfunktion erhöhter Aufmerksamkeit, da Zulassungseinschränkungen und Kontraindikationen vorliegen können (siehe dazu die Beiträge Möglichkeiten und Grenzen der antidiabetischen Therapie und Metformin bei Niereninsuffizienz):
Metformin ist wegen der erhöhten Gefahr einer Laktatazidose bei Frauen über einem Serumkreatinin von 1,4 mg/dl und bei Männern ab 1,5 mg/dl (entspricht einer Kreatininclearance von ca. 60 ml/min/1,73 m2) kontraindiziert. Es existieren Überlegungen, diese Zulassungsbeschränkungen zu ändern und eine niedrigere Dosis bei Niereninsuffizienz und eGFR < 60 zu ermöglichen (Inzucchi et al., Diabetologia 2012), jedoch haben diese Überlegungen zur doch selten auftretenden Laktatazidose und zum Benefit der Metformintherapie auch bei erniedrigter eGFR noch keinen Eingang in die offiziellen Zulassungsbeschränkungen gefunden. Zu beachten bleibt auch, dass in den pharmakologischen Richtlinien sehr oft auf die Kreatininclearance und noch nicht auf die eGFR Bezug genommen wird.
Unter den Sulfonylharnstoffen sollte auf die Gabe von Glibenclamid (heutzutage kaum mehr verwendet), welches vorwiegend renal eliminiert wird, wegen der Kumulationsgefahr mit Neigung zu schwerer und protrahierter Hypoglykämie verzichtet werden. Bei Glimepirid und Gliclazid ist häufig eine Dosisreduktion erforderlich, der Gebrauch von Glimepirid ist aber besonders wegen der aktiven Metaboliten gefährlicher (verursacht im Einzelfall lebensbedrohliche protrahierte Hypoglykämien) als Gliclazid. Lediglich bei Gliquidon (das nur zu 5 % renal eliminiert wird) ist keine Dosisanpassung notwendig.
Bei Verwendung von Gliniden ist ebenso auf eine Dosisreduktion zu achten.
Glitazone (Pioglitazon) können unter Berücksichtigung der erhöhten Neigung zu Natrium- und Flüssigkeitsretention unter engmaschiger klinischer Kontrolle eingesetzt werden, sie sind kontraindiziert bei gleichzeitig bestehender Herzinsuffizienz und Blasenkrebsanamnese. Insbesondere bei gleichzeitigem sekundärem Hyperparathyreoidismus oder renaler Osteopathie sollte auch das erhöhte Frakturrisko bedacht werden.
Glukosidasehemmer wie Acarbose und Miglitol sind ab einer eGFR < 30 ml/min zu vermeiden, da sie renal eliminiert werden.
GLP-1 Analoga: Exenatid wird bei einer Kreatininclearance von 30–50 ml/min dosisreduziert gegeben und bei < 30 ml/min nicht empfohlen. Im Fall von Liraglutid fehlen Daten zum Einsatz bei einer Kreatininclearance von < 60 ml/min.
DPP-4-Hemmer: Sitagliptin wird bei Kreatininclearance < 30 ml/min in der Dosis 25 mg/Tag, bei 30–50 ml/min in der Dosis von 50 mg/Tag gegeben; Vildagliptin: 50 mg/Tag bei Kreatininclearance < 50 ml/min; Saxagliptin: 2,5 mg/Tag bei Kreatininclearance < 50 ml/min, nicht empfohlen im CKD-Stadium 5d; Linagliptin: keine Dosisanpassung erforderlich.
Zu beachten bleiben auch die Kontraindikationen bei zunehmender Zahl an Kombinationspräparaten mit Metformin sowie Zulassungsbeschränkungen für die Kombinationstherapie mit anderen Medikamenten und Insulin.
Nierenersatztherapie und eGFR < 15 ml/min
Steigende Patientenzahlen an Diabetikern in der Dialyse sowie eine zunehmende Zahl an Medikamenten zur Diabeteseinstellung erfordern heutzutage eine differenzierte Sicht. Der HbA1c-Wert wird zwar in vielen Studien als Marker für die glykämische Kontrolle herangezogen, ist aber aufgrund teilweise verkürzter Überlebenszeit der Erythrozyten, begleitender Erythopoietintherapie mit erhöhtem Erythrozytenumsatz, Carbamylierung sowie Komorbiditäten und Inflammation in der Dialyse nur bedingt aussagekräftig. Alternativ wäre das glykosylierte Albumin zukünftig eine Alternative, jedoch ist dieses in der Klinik derzeit nicht verfügbar (Freedman, Diabetes Care 2012).
Alle Studien haben Limitationen, und es ist weiterhin unklar, ob glykämische Kontrolle das in der Nierenersatztherapie verringerte Überleben diabetischer Dialysepatienten entscheidend beeinflusst. Um das wahre Verhältnis zwischen dem Ausmaß der Diabeteskontrolle und dem Outcome evaluieren zu können, wären prospektive kontrollierte Studien (auch der verschiedenen angewandten Medikamente) notwendig. Registeranalysen leiden zumeist an fehlender Differenzierung zwischen Typ-1- und Typ-2-Diabetes und der jeweils durchgeführten Diabetestherapie. Neuere Studien aus großen Registerzahlen beschäftigen sich mit dem HbA1c bei terminalem Nierenversagen, zumeist mit Hämodialyse (KDOQI-5D, eGFR < 15 ml/min).
Die 7 großen Studien, die in den vergangenen 10 Jahren zum Thema publiziert wurden, zeigen unterschiedliche Ergebnisse hinsichtlich der Korrelation zwischen HbA1c und Outcome:
- Williams et al. (Kidney Int 2006) führten eine primäre Analyse von Daten aus dem Jahr 2002 durch und korrelierten das 1-Jahres-Überlebenraten von 23.504 prävalenten diabetischen Hämodialysepatienten mit dem Ergebnis einer einmaligen HbA1c-Messung. Anhand von Kaplan-Meier-Analysen wurde kein Unterschied im Überleben zwischen den verschiedenen HbA1c-Gruppierungen beobachtet, die 1-Jahres-Überlebenraten lagen bei 80–85 %.
Zu einem ähnlich negativen Ergebnis kommen Shurraw et al. (Am J Kidney Dis 2010) in einer rezenten kanadischen Studie. Hier wurden alle inzidenten 1.484 Hämodialysepatienten der Jahre 2001 bis 2007 von 21 Dialysestationen eingeschlossen und bis Ende 2008 nachbeobachtet. Korreliert wurde das Überleben mit mehreren gemittelten initialen Blutzuckerwerten und dem HbA1c bei Dialysebeginn. Auch höhere HbA1c-Werte (Hazard Ratio [HR] = 1,01 pro 1 % HbA1c-Anstieg um 1 Prozentpunkt) zeigten keine Korrelation zur Mortalität beim Diabetiker. - Im Kontrast dazu zeigen 5 Studien eine Assoziation zum HbA1c: Hayashino et al. (Diabetologia 2007) konnten im japanischen Arm der internationalen DOPPS-Studie 1.569 Patienten mit Diabetes in der Hämodialyse der Jahre 1997–2004 auswerten. Die multivariat adjustierte HR der Mortalität war in der Patientengruppe mit HbA1c > 7,3 % signifikant erhöht (HR = 2,36).
Die größte derzeit vorliegende Studie stammt von Kalantar-Zadeh et al. (Diabetes Care 2007). Es wurden 82.933 amerikanische Dialysepatienten über eine Zeitraum von 3 Jahren (2001–2004) untersucht. Nicht adjustierte Survival-Analysen zeigten wider Erwarten bei höheren HbA1c-Werten ein besseres Überleben. Wenn aber das Modell durch Komorbiditäten, Demographie, Anämie, Malnutrition, Entzündungsparameter und Dialysedetails angepasst wurde, zeigten sich höhere Gesamt- und kardiovaskuläre Mortalität. Vergleiche der HbA1c-Werte von 5–6 % mit Werten > 10 % zeigten eine HR von 1,41 bzw. 1,73.
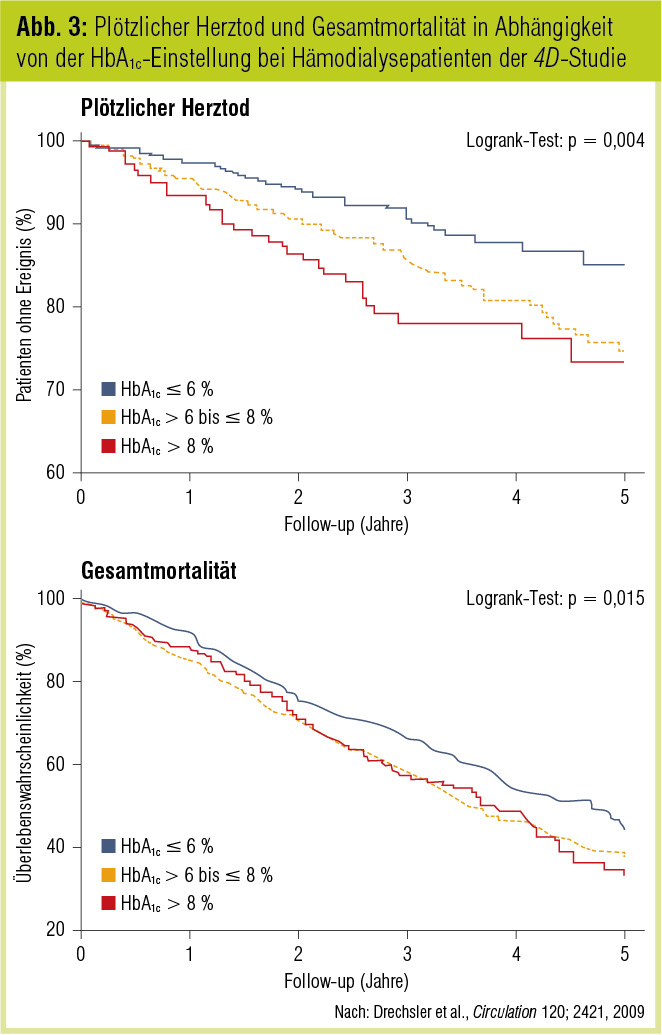
Eine rezente Studie betrifft eine detaillierte Datenanalyse der 4D-Studie (Drechsler et al., Circulation 2009). HbA1c wurde bei 1.255 deutschen Hämodialysepatienten mit Typ-2-Diabetes gemessen, das Follow-up betrug 4 Jahre. Das mittlere HbA1c der Patienten betrug 6,7 ± 1,3 %. In der vorliegenden Analyse wurden HR für „sudden cardiac death“, Myokardinfarkt, Schlaganfall, kardiovaskuläre Ereignisse und Gesamtmortalität bestimmt (Abb. 3). Patienten mit HbA1c > 8 % hatten ein zweifach höheres Risiko für „sudden cardiac death“ im Vergleich zu Patienten mit einem HbA1c von ≤ 6 % (HR = 2,14). Die erhöhte Gesamtmortalität bei HbA1c Werten > 8 % konnte jedoch hauptsächlich durch die Zunahme der Patienten mit „sudden cardiac death“ erklärt werden.
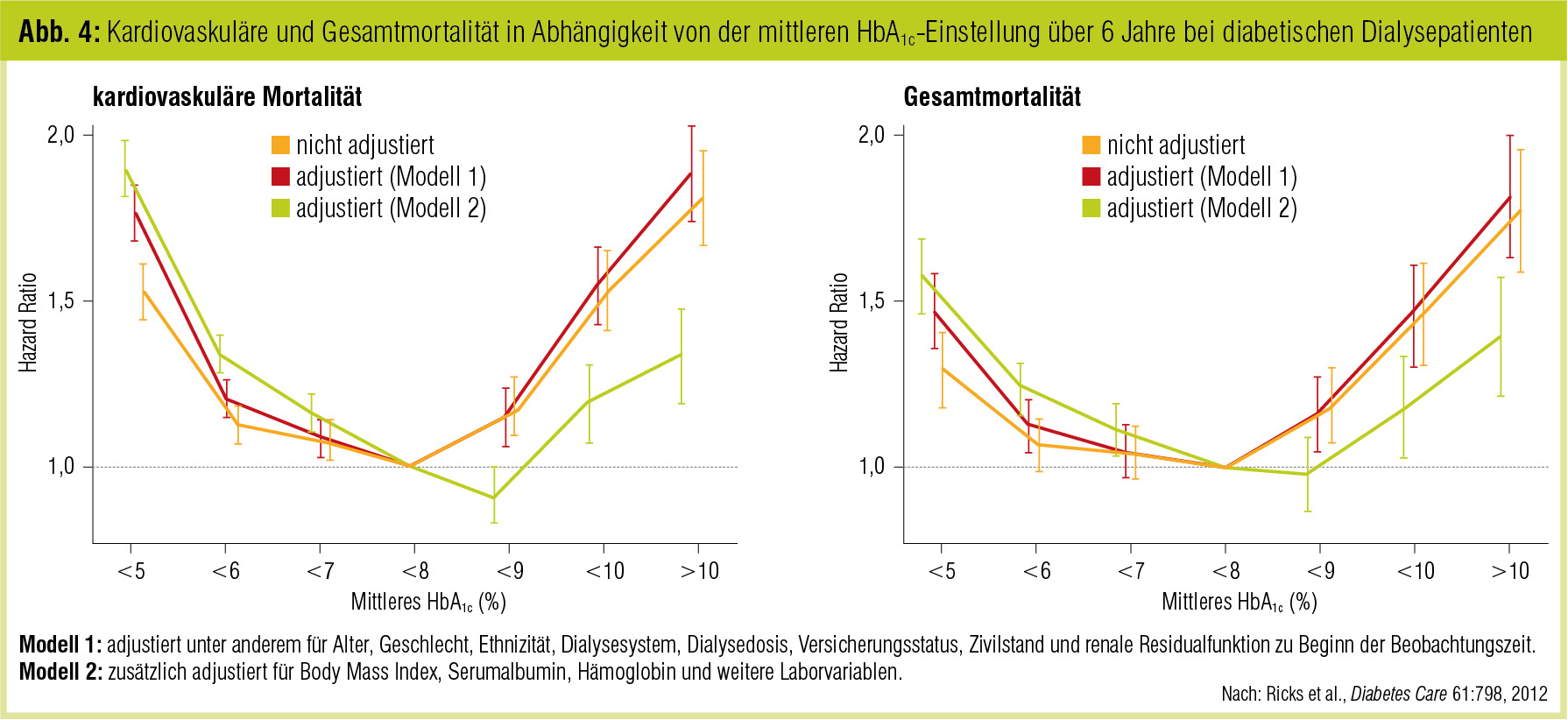
Im Jahr 2012 wurden bis dato 2 Studien mit Korrelation publiziert: Hier zeichnet sich ein HbA1c-Korridor von 7–7,9 % als bestmöglicher Kompromiss betreffend das Outcome ab (Ramirez et al., Diabetes Care 2012; Ricks et al., Diabetes 2012). In beiden Studien wurde eine U-förmige Beziehung zwischen HbA1c und Outcome demonstriert, in der Ricks-Studie an 54.000 US-amerikanischen diabetischen Dialysepatienten (Abb. 4), in der Ramirez-Studie als Detailauswertung der internationalen DOPPS-Studie an 9.200 Diabetikern. Es ist dies eine neuerlicher Hinweis darauf, das der beste HbA1c-Bereich in der Hämodialyse nicht im Bereich < 7 % liegt, sondern in einem Fenster von 7–7,9 % zu finden ist.
Diese Überlegungen haben auch in das Update der Leitlinie zur diabetischen Nephropathie der Österreichischen Diabetes Gesellschaft und der Österreichischen Gesellschaft für Nephrologie (Auinger et al., Wien Klin Wochenschr 2012) Eingang gefunden; dieser Zielbereich wird für Hämodialyse und Peritonealdialyse empfohlen.