Stellenwert neuer Antikoagulantien in der Schlaganfallprävention
Vorhofflimmern (VHF) ist einer der wichtigsten, aber leider oft ein unbehandelter Risikofaktor für den ischämischen Hirninfarkt. Zwei von drei Schlaganfällen können durch Gabe von Warfarin verhindert werden. Da zur oralen Antikoagulation bei VHF bisher nur Vitamin-K-Antagonisten zur Verfügung standen, wurde häufig wegen einer überbewerteten Blutungsgefahr, wegen des schmalen therapeutischen Fensters mit aufwändigem Therapiemonitoring oder des Interaktionspotenzials eine gezielte Schlaganfallprävention
bei VHF unterlassen.
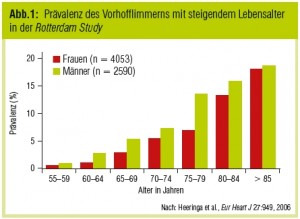
Die Prävalenz von nonvalvulären VHF steigt mit dem Alter steil an (Abb. 1) und lässt durch die ebenfalls steigende Lebenserwartung in unseren Breiten eine weitere Zunahme erwarten. Wie die Framingham-Kohorte zeigte, ist das Schlaganfallrisiko bei VHF um das Fünffache erhöht (Wolf et al., Stroke 1991). Ohne gerinnungsaktive Therapie besteht
bei VHF eine jährliche Insultrate von 5 %.
Aspirin alleine oder auch in Kombination mit Clopidogrel ist leider relativ ineffektiv in der Verhütung von Schlaganfällen bei VHF, sodass die Entwicklung von wirksameren
und sicheren oralen Antikoagulantien ein wesentlicher Forschungsauftrag war. Aktuelle Daten aus Kanada belegen eindrucksvoll die enorme „therapeutische Lücke“ in der
Schlaganfallprävention von VHF: Nur 10 % aller akuten Schlaganfallpatienten mit VHF waren bei Aufnahme auf der Stroke Unit oral antikoaguliert (Gladstone et al., Stroke
2009).
Der kardiogen-embolische Hirninfarkt
85 % aller Schlaganfälle sind durch fokale Ischämien im Gehirn bedingt. Von allen ischämischen Schlaganfällen ereignen sich 20–30 % bei Patienten mit VHF. Durch die irreguläre Bewegung des linken Vorhofes bilden sich dort Thromben unterschiedlicher Größe, die durch die Zirkulation direkt in die hirnversorgenden Gefäße verschleppt werden.
Im zerebralen Gefäßbaum führen diese kardiogenen Thromben im leichtesten Fall zu einer transitorischen ischämischen Attacke (TIA) ohne morphologisches Substrat in
der diffusionsgewichteten Magnetresonanzbildgebung (MRI), im schwersten Falle zum Großgefäßverschluss mit ausgedehntem Territorialinfarkt (Abb. 2). Im österreichischen
Stroke-Unit-Register lag die VHF-Prävalenz bei allen Patienten mit ischämischem Hirninfarkt in den vergangenen beiden Jahren zwischen 16–48 % – also durchaus unterschiedlich zwischen den 34 Stroke Units im Bundesgebiet. Kardiogenembolische
Schlaganfälle sind besonders schwere Schlaganfälle, die mit einem ausgeprägten klinischen Defizit (gemessen anhand eines hohen NIHS-Score) einhergehen. Sie ereignen sich oft in den frühen Morgenstunden, Frauen sind etwas häufiger betroffen. Vom zerebrovaskulären Gefäßbaum können alle Gebiete betroffen sein – das Karotisstromgebiet ebenso wie die vertebrobasiläre Zirkulation. Erstaunlicherweise treten kardiogenembolische Schlaganfälle im Sommer seltener auf.
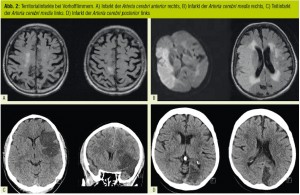 Diagnose und Therapie: Die ätiologische Diagnostik eines kardiogenembolischen Hirninfarktes fußt auf einem typischen Infarktmuster in der zerebralen Bildgebung, wobei
Diagnose und Therapie: Die ätiologische Diagnostik eines kardiogenembolischen Hirninfarktes fußt auf einem typischen Infarktmuster in der zerebralen Bildgebung, wobei
hier die MRI der Computertomographie (CT) in Sensitivität und Spezifität eindeutig überlegen ist. Weiters muss Vorhofflimmern detektiert oder/und im Herzecho eine kardiale Emboliequelle oder zumindest ein vergrößerter linker Vorhof nachgewiesen werden.
Je nach Zeitfenster, vom Onset der Klinik bis zum Eintreffen im Krankenhaus, kommen heute unterschiedliche Behandlungsmöglichkeiten zum Einsatz. Nach einer akuten zerebralen Bildgebung, die immer eine morphologische Darstellung des Gehirngewebes und des Circulus Willisi umfassen muss (kraniale CT plus CTAngiographie oder eine multimodale kraniale MRI), wird bei fehlenden Kontraindikationen die Rekanalisationsbehandlung entweder in Form einer systemisch verabreichten Thrombolyse (derzeit rekombinanter Tissue Plasminogen Activator, rtPA) oder eine lokalen Thrombusextraktion (z. B. Solitaire-Stent-Retriever) durchgeführt. Nach aktueller Evidenz liegen die Rekanalisationsraten etwa für die Arteria cerebri media je nach
Methode bei 36 % bis über 80 %. Das klinische Ergebnis beim Patienten ist naturgemäß neben der Rekanalisation des verschlossenen Gefäßes auch von der Kollateralisation,
der Zeitdauer der Okklusion und einer etwaigen chronischen Vorschädigung des Gehirns abhängig.
Da sich ein erheblicher Teil der ischämischen Hirninfarkte klinisch stumm ereignet und jeder Verlust von Hirngewebe ein direkter Wegbereiter von Demenz ist, kommt der oralen
Antikoagulation (OAK) bei VHF auch indirekt ein hoher Stellenwert in der Demenzprävention zu.
Schlaganfallprävention bei Vorhofflimmern
Aufgrund des hohen Schlaganfallrisikos bei nonvalvulärem VHF wurden klinische Risk Scores entwickelt, um rasch anhand weniger Parameter das Schlaganfallrisiko und die Notwendigkeit für eine OAK abschätzen zu können. Der bekannteste ist der CHADS-Score (Tab. 1), der zuletzt um drei weitere klinische Parameter (Alter > 65 Jahre, weibliches Geschlecht, periphere arterielle Verschlusskrankheit) auf den CHADS-VASc-Score (Tab. 2) erweitert wurde.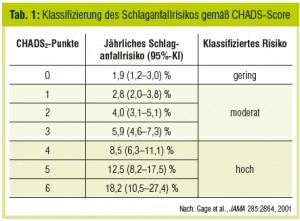
Mit dem CHADS-VASc-Score können besonders Patienten mit niedrigem Embolierisiko identifiziert werden: Jeder Patient, der aufgrund von Alter, Geschlecht und 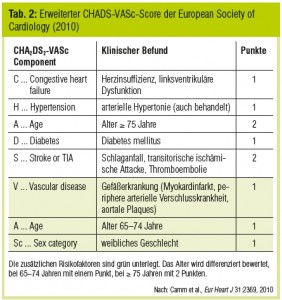 Vorerkrankungen zwei oder mehr Punkte erhält, ist nach den aktuellen Leitlinien der European Society of Cardiology (Camm et al., Eur Heart J 2010) ein Kandidat für OAK zur Schlaganfallprävention. Bis dato standen dafür nur die breit wirksamen Vitamin-K-Antagonisten zur Verfügung. Nun hat sich die Palette der oralen Antikoagulantien vorerst um drei spezifisch wirksame Substanzen erweitert: Dabigatran, Rivaroxaban und Apixaban wurden in großen ereignisgetriggerten Phase-III-Studien im Vergleich zu Warfarin in ihrer Wirksamkeit und Sicherheit bei der Schlaganfallverhütung untersucht.
Vorerkrankungen zwei oder mehr Punkte erhält, ist nach den aktuellen Leitlinien der European Society of Cardiology (Camm et al., Eur Heart J 2010) ein Kandidat für OAK zur Schlaganfallprävention. Bis dato standen dafür nur die breit wirksamen Vitamin-K-Antagonisten zur Verfügung. Nun hat sich die Palette der oralen Antikoagulantien vorerst um drei spezifisch wirksame Substanzen erweitert: Dabigatran, Rivaroxaban und Apixaban wurden in großen ereignisgetriggerten Phase-III-Studien im Vergleich zu Warfarin in ihrer Wirksamkeit und Sicherheit bei der Schlaganfallverhütung untersucht.
Dabigatran
Dabigatran ist ein direkter Thrombininhibitor, der mit zwei Dosierungen in der RE-LY-Studie (Connolly et al., New Engl J Med 2009) an über 12.000 Patienten im so genannten
PROBE-Design (prospektive, randomisiert, offen mit verblindeter Endpunktauswertung) untersucht wurde. 20 % der eingeschlossenen Patienten hatten vorher eine TIA oder
einen Schlaganfall. In der Dosis von 110 mg zweimal täglich war das Risiko für ischämische Ereignisse gleich hoch wie unter Warfarin, aber es gab weniger große Blutungen. Mit 150 mg zweimal täglich wurden im Vergleich zu Warfarin weniger ischämische Ereignisse und eine analoge Anzahl großer Blutungen beobachtet.
Es zeigt sich also ein klinischer Nettobenefit (vaskuläre Ereignisse, Blutungen, Todesfälle) sowohl für die 110mgDosis (RR = 0,92; Range: 0,84–1,02) ebenso wie für die 150mgDosis (RR = 0,91; Range: 0,82–1,00). Dies führte zur Zulassung durch die European Medicines Agency und mittlerweile auch zur Erstattungsfähigkeit in Österreich „zur Prävention von Schlaganfall und systemischer Embolie bei erwachsenen Patienten mit nichtvalvulärem Vorhofflimmern“ mit einem oder mehreren der folgenden Risikofaktoren:
• vorausgegangener Schlaganfall, TIA oder systemische Embolie
• linksventrikuläre Ejektionsfraktion < 40 %
• symptomatische Herzinsuffizienz ≥ NYHA 2
• Alter ≥ 75 Jahre
• Alter ≥ 65 Jahre mit einhergehendem Diabetes mellitus, koronarer Herzkrankheit oder arterieller Hypertonie.
Dabigatran (Pradaxa®) ist in zwei Dosen erhältlich, die reduzierte Dosis von zweimal 110 mg kommt bei eingeschränkter Nierenfunktion (glomeruläre Filtrationsrate [GFR] < 50 ml/min) zum Einsatz.
Rivaroxaban
Dieser orale direkte Faktor-Xa-Inhibitor wurde bei 14.264 Patienten mit VHF und erhöhtem Schlaganfallrisiko in einer Tagesdosis von einmal 20 mg versus Warfarin in der ROCKET-AF-Studie (Patel et al., New Engl J Med 2011) untersucht. 50 % der eingeschlossenen Patienten hatten zuvor einen Schlaganfall erlitten, sodass diese Kohorte wohl am aussagekräftigsten für die Sekundärprävention ist. In der Intentiontotreat-Analyse reduzierte Rivaroxaban das Schlaganfallrisiko (Hazard Ratio [HR] = 0,88; 95%KI: 0,74–1,03) mit einem gleichzeitig niedrigeren Risiko für intrakranielle Blutungen (0,5 % vs. 0,7 %, p = 0,02) oder für fatale systemische Blutungen (0,2 % vs. 0,5 %; p = 0,003). Somit belegte Rivaroxaban in dieser Indikation eine zumindest gleichwertige Wirkung wie Warfarin bei besserer Verträglichkeit.
Dass Rivaroxaban trotz seiner relativ kurzen Halbwertszeit nur einmal täglich verabreicht wurde, sorgte für heftigste Diskussionen über die Studienergebnisse. Allerdings betrug
auch im Warfarin-Arm der ROCKET-AF-Studie die mittlere Zeit im therapeutischen Zielbereich (INR = 2–3) nur 55 %. Seit kurzem ist Rivaroxaban (Xarelto®) mit 20 mg und 15mg – bei eingeschränkter Nierenfunktion – in Österreich für die Schlaganfallprävention zugelassen.
Apixaban
In der ARISTOTLE-Studie (Granger et al., New Engl J Med 2011) wurde ein weiterer oraler direkter Faktor-Xa-Inhibitor namens Apixaban versus Warfarin bei 18.201 Patienten mit VHF und zumindest einem zusätzlichen Risikofaktor untersucht. 20 % der eingeschlossenen Patienten hatten zuvor einen Schlaganfall erlitten. Nach einer mittleren Beobachtungsdauer von 1,8 Jahren war das Schlaganfall und Embolierisiko in der Apixaban-Gruppe (zweimal 5 mg per die) niedriger (HR = 0,79; 95%Kl: 0,66–0,95), mit einer niedrigeren Rate für Hirnblutungen (0,24 % vs. 0,47 %; p < 0,0001) und großen systemischen Blutungen (2,13 % vs. 3,09 %; p < 0,0001). Somit ist die Überlegenheit der Wirksamkeit gegenüber Warfarin bei besserer Verträglichkeit belegt.
Allerdings wurde die Studie auch heftig kritisiert, weil die Patienten im Warfarin-Arm nur 62% der Zeit im therapeutischen Bereich (INR = 2–3) lagen. Aber bereits in der zuvor publizierten AVERROES-Studie (Connolly et al., New Engl J Med 2011), die Apixaban 5mg zweimal täglich versus Azetylsalizylsäure in variabler Dosis (81–324 mg/Tag) in dieser
Indikation verglich, zeigte sich ein eindeutiger klinischer Nettovorteil für Apixaban: Bei 5.600 Patienten mit VHF wurde belegt, dass Apixaban das Schlaganfallrisiko um 50 %
senkt, bei gleicher Blutungsrate wie ASS.
In Österreich wird Apixaban unter dem Namen Eliquis® in der Indikation „Prävention von Schlaganfällen und systemischen Embolien bei Patienten mit VHF“ auf den Markt
kommen.
Stellenwert der neuen OAK aus heutiger Sicht
In allen drei Zulassungsstudien wurde ein für VHF und Schlaganfallverhütung repräsentatives Patientengut (mittleres Alter 70–73 Jahre, mehr Männer als Frauen, mindestens ein zusätzlicher vaskulärer Risikofaktor neben VHF) untersucht. Somit zeichnet sich bei den neuen OAK ein „Klasseneffekt“ mit besserer Verträglichkeit und zumindest gleicher bzw. sogar stärkerer Wirksamkeit als dosisadaptiertes Warfarin ab, der pathophysiologisch auf den gezielten Wirkmechanismus zurückgeführt wird. Ebenso entfällt die Notwendigkeit des Dosis-Monitoring, es werden Fixdosierungen verordnet. Ob dies im Hinblick auf die Adhärenz aller Patienten bei dieser Langzeitbehandlung einen Vorteil darstellt, wird noch zu untersuchen sein. Auch das Interaktionspotenzial mit anderen Medikamenten und der Ernährung ist erheblich geringer.
Da die Halbwertszeit der neuen OAK mit durchschnittlich 12 Stunden deutlich kürzer als die von Warfarin ist (Tab. 3), sind sie auch besser zu steuern. Die Wirkung der neuen OAK setzt sofort ein und endet nach Ausscheidung der Substanz bzw. deren Metaboliten (Dabigatran ist eine Prodrug). Dies ist für alle Patienten mit VHF unter OAK, die auf einen elektiven operativen Eingriff vorbereitet werden, ein enormer Vorteil. Besonders im stationären Bereich kann durch die rasche Umstellung von Vollheparinisierung auf die neuen OAK die Aufenthaltsdauer verkürzt werden.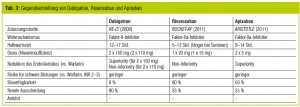
Da alle drei neuen OAK über die Niere ausgeschieden werden, muss die Dosis bei Nierenfunktionseinschränkungen reduziert werden. Eine GFR < 30 ml/min stellt eine definitive Kontraindikation dar. Wenn dies nicht beachtet wird, kann es durch Kumulation – speziell unter Dabigatran – zu lebensbedrohlichen Hämorrhagien kommen. Für Patienten > 75 Jahre wird deshalb halbjährlich die Bestimmung der GFR empfohlen.
Bei akuten Blutungen unter den neuen OAK hingegen werden – vor allem von Unfallchirurgen – zunehmend Probleme berichtet, weil kein direktes Antidot zur Verfügung steht. Bei Dabigatran wird eine Akutdialyse empfohlen, bei Rivaroxaban
die Gabe von Prothrombinkomplexkonzentrat.
Ungelöste Fragen im neurologischen Schlaganfallmanagement
1. Wann soll nach kardiogen-embolischer TIA bzw. Schlaganfall mit der sekundärpräventiven OAK begonnen werden?
Nach einem ischämischen Schlaganfall ist die Gefahr für eine Einblutung in das infarzierte Gewebe in den ersten 5–7 Tagen am höchsten. Je nach Größe und Lokalisation des Infarktareales kann eine solche Einblutung klinisch bedeutsam werden. Für die Vitamin-K-Antagonisten gibt es hierzu unterschiedliche Empfehlungen der European Stroke Organisation (ESO) und der American Heart Association (AHA). Bei TIA ohne morphologisches Substrat wird von der ESO ein sofortiger Beginn empfohlen, während die AHA innerhalb der folgenden zwei Wochen den Therapiebeginn empfiehlt.
Die Österreichische Gesellschaft für Schlaganfallforschung (ÖGSF) empfiehlt bei TIA und leichten ischämischen Schlaganfällen eine Wartezeit von 3–14 Tagen vor Beginn der OAK. Wenn ein großer Infarkt besteht, wird wegen der Einblutungsgefahr ein Zeitabstand von zwei (AHA) bzw. vier Wochen (ESO) empfohlen. Für die neuen OAK gibt es noch keine Richtlinien, lediglich für Dabigatran gibt es eine Empfehlung, nach einem großen Hirninfarkt mit dem Beginn der OAK zwei Wochen zuzuwarten.
Aus den Zulassungsstudien (RE-LY, ROCKET-AF, ARISTOTLE), die ja einen Teil der Patienten nach Schlaganfall rekrutierten, gibt es keine Angaben zum Zeitintervall für den
Therapiebeginn nach großem ischämischem Hirninfarkt.
2. Welche Reperfusionsmaßnahme soll bei einem zerebralen Großgefäßverschluss, der sich unter laufender Therapie mit einem neuen OAK ereignet, durchgeführt werden?
Bisher galt eine INR > 2,0 unter laufender WarfarinTherapie als absolute Kontraindikation für eine systemische Thrombolyse des ischämischen Hirninfarktes. Für die neuen OAK gibt es bis jetzt noch keine validierten Gerinnungstests, sodass die Wirkung nur anhand der Halbwertszeit abgeschätzt werden kann. Als akute Gerinnungstests werden für Dabigatran die Thrombinzeit (TZ) und die aktivierte partielle Thromboplastinzeit (aPTT) empfohlen, für Rivaroxaban die partielle Plasmathrombinzeit (PTZ). Bei Normalwerten
ist von fehlender Wirkung der neuen OAK auszugehen.
Schlaganfallpatienten, die mit Aphasie oder Bewusstseinstrübung auf die Stroke Unit kommen, können über die Vormedikation keine Angaben machen. Somit steht der Behandler vor einem Dilemma, wenn auf dem Medikationszettel eines der neuen Antikoagulantien vermerkt ist oder Angehörige entsprechende Angaben machen.
3. Können die neuen OAK auch bei anderen neurologischen Indikationen für die Schlaganfallprävention eingesetzt werden?
Neben dem kardiogenembolischen Hirninfarkt gibt es zahlreiche weitere seltene Schlaganfallursachen, die ebenso mit Rezidivneigung einhergehen (Tab. 4). Für diese Indikationen wurden bisher Vitamin-K-Antagonisten eingesetzt. Ob sich die Ergebnisse der neuen OAK aus den Schlaganfallpräventionsstudien bei VHF auf diese seltenen Indikationen umlegen lassen, muss noch offen bleiben.






















































































